碱性氨基酸-PAF26衍生多肽的抗菌性能研究
曹凤仪,马港庆,秦 琦,梅 林,朱根兴
(中原工学院材料与化工学院,河南 郑州 450007)
当有害微生物入侵人体时,会在人体内繁殖并导致感染性疾病如肺炎、肠炎、骨髓炎、脑膜炎等的发生[1]。目前,针对这类疾病临床最广泛的治疗方法是使用抗生素类药物,然而由于抗生素的广泛和不规范使用,导致了大量耐药菌和超级细菌的出现,严重威胁人类健康[2],迫切需要研究者开发新型抗菌药物来抵御耐药菌和超级细菌。
抗菌肽是一种广泛存在于生物体内的抗菌药物,目前已知的可以从生物体内提取的抗菌肽超过2 817种[3-4],然而天然抗菌肽存在结构复杂、提纯难度大等问题。随着科技的发展,人工合成技术已成为一种新型的开发和研制抗菌肽的方法[5-8]。人工合成抗菌肽通常以天然抗菌肽中活性多肽序列为基础。研究发现,抗菌肽通常富含疏水性氨基酸残基,包括亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、色氨酸等;并含有大量的阳离子氨基酸,使抗菌肽具有2~9个正电荷。此外,这种两亲性结构对抗菌肽的抗菌性能至关重要[5]。
PAF26抗菌肽是由6个氨基酸组成的具有抗菌性能的两亲性多肽。据报道,PAF26多肽具有优异的抗菌性能,并且不会溶解和破坏人体细胞[9-10]。因此,作者以PAF26多肽为基础,在多肽序列中引入碱性氨基酸,同时引入相应数量的苯丙氨酸,设计了4个碱性氨基酸-PAF26衍生多肽,并研究其对真菌、革兰氏阳性菌、革兰氏阴性菌的抗菌性能。
1 实验
1.1 培养基和菌种
沙氏葡萄糖液体培养基、胰酪大豆胨液体培养基,广东环凯微生物科技有限公司。
白色念珠菌(ATCC10231)、金黄色葡萄球菌(ATCC6538)、大肠杆菌(ATCC25922),上海鲁微科技有限公司。
1.2 碱性氨基酸-PAF26衍生多肽的设计
以PAF26多肽为基础,在多肽分子序列Ac-RKKWFW-NH2中引入2或4个碱性氨基酸:赖氨酸(K)或精氨酸(R);为保持亲疏水氨基酸比例不变,引入相应数量的苯丙氨酸(F)。作者设计了赖氨酸-PAF26衍生多肽(K2-F2、K4-F4)和精氨酸-PAF26衍生多肽(R2-F2、R4-F4),其分子序列和分子量见表1,委托吉尔生化(上海)有限公司合成。

表1 PAF26衍生多肽序列和分子量
1.3 碱性氨基酸-PAF26衍生多肽的抗菌性能测试
为研究碱性氨基酸-PAF26衍生多肽的抗菌性能,分别选择白色念珠菌(真菌)、金黄色葡萄球菌(革兰氏阳性菌)、大肠杆菌(革兰氏阴性菌)进行抗菌性能测试。
1.3.1 菌液的准备
白色念珠菌:取少量白色念珠菌第二代斜面菌株,接种至50 mL沙氏葡萄糖液体培养基中,26 ℃振荡培养。
金黄色葡萄球菌:取少量金黄色葡萄球菌第二代斜面菌株,接种至50 mL胰酪大豆胨液体培养基中,37 ℃振荡培养。
大肠杆菌:取少量大肠杆菌第二代斜面菌株,接种至50 mL胰酪大豆胨液体培养基中,37 ℃振荡培养。
将菌株培养过夜后,分别取0.2 mL菌液加入到25 mL新鲜培养基中进行再培养。用紫外可见分光光度计(UV1800PC,上海)测试600 nm处的吸光度值(OD),待吸光度值达到0.1后,进行抗菌实验。
1.3.2 衍生多肽的抗菌性能测试
多肽溶液的配制:分别称取10 mg 衍生多肽,配制成浓度(mg·mL-1)为1.000、0.500、0.250、0.125、0.062、0.031、0.015的多肽溶液。
抗菌实验:将不同浓度多肽溶液分别加入到96孔板中,每孔100 μL;并选择超纯水作为阴性对照组,每个浓度设置6个平行样。紫外光照射1 h进行灭菌处理后,每孔分别加入100 μL吸光度值为0.1的白色念珠菌、金黄色葡萄球菌、大肠杆菌的菌液;孵育10 min后,用酶标仪(DNM-9602,北京)测试初始吸光度值,记录为0 h吸光度值;将多肽溶液与菌液共培养24 h后,用酶标仪测试吸光度值,记录为24 h吸光度值。
2 结果与讨论
2.1 赖氨酸-PAF26衍生多肽的抗菌性能分析
2.1.1 白色念珠菌
K2-F2、K4-F4多肽与白色念珠菌共培养0 h和24 h的吸光度值见图1。
由图1可知,在沙氏葡萄糖液体培养基中,当K2-F2多肽浓度≥0.250 mg·mL-1、K4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽溶解性较差。与白色念珠菌共培养24 h后,当K2-F2多肽浓度≥0.125 mg·mL-1、K4-F4多肽浓度≥0.250 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制白色念珠菌生长的效果,且K2-F2多肽的抗菌效果优于K4-F4多肽的。
2.1.2 金黄色葡萄球菌
K2-F2、K4-F4多肽与金黄色葡萄球菌共培养0 h和24 h的吸光度值见图2。
由图2可知,在胰酪大豆胨液体培养基中,当K2-F2、K4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽溶解性较差。与金黄色葡萄球菌共培养24 h后,当K2-F2多肽浓度≥0.062 mg·mL-1、K4-F4多肽浓度≥0.125 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制金黄色葡萄球菌生长的效果,且K2-F2多肽的抗菌效果优于K4-F4多肽的。

a.K2-F2多肽 b.K4-F4多肽

a.K2-F2多肽 b.K4-F4多肽
2.1.3 大肠杆菌
K2-F2、K4-F4多肽与大肠杆菌共培养0 h和24 h的吸光度值见图3。

a.K2-F2多肽 b.K4-F4多肽
由图3可知,在胰酪大豆胨液体培养基中,当K2-F2、K4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽的溶解性较差。与大肠杆菌共培养24 h 后,当K2-F2、K4-F4多肽浓度≥0.250 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制大肠杆菌生长的效果,且K2-F2的抗菌效果优于K4-F4多肽的。
2.2 精氨酸-PAF26衍生多肽的抗菌性能分析
2.2.1 白色念珠菌
R2-F2、R4-F4多肽与白色念珠菌共培养0 h和24 h的吸光度值见图4。
由图4可知,在沙氏葡萄糖液体培养基中,当R2-F2、R4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽溶解性较差。与白色念珠菌共培养24 h后,当R2-F2多肽浓度≥0.125 mg·mL-1、R4-F4多肽浓度≥0.250 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制白色念珠菌生长的效果,且R2-F2多肽的抗菌效果优于R4-F4多肽的。和图1相比较,R2-F2、R4-F4多肽的抗菌效果优于K2-F2、K4-F4多肽的。
2.2.2 金黄色葡萄球菌
R2-F2、R4-F4多肽与金黄色葡萄球菌共培养0 h和24 h的吸光度值见图5。
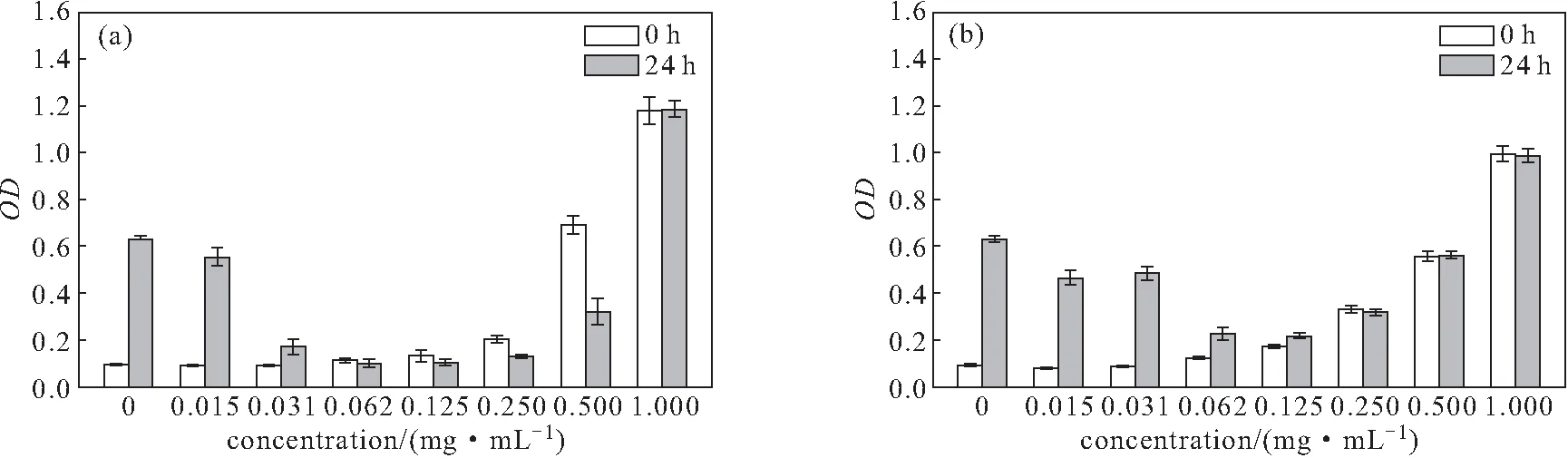
a.R2-F2多肽 b.R4-F4多肽
由图5可知,在胰酪大豆胨液体培养基中,当R2-F2、R4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽溶解性较差。与金黄色葡萄球菌共培养24 h后,当R2-F2多肽浓度≥0.031 mg·mL-1、R4-F4多肽浓度≥0.062 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制金黄色葡萄球菌生长的效果,且R2-F2多肽的抗菌效果优于R4-F4多肽的。和图2相比较,R2-F2、R4-F4多肽的抗菌效果优于K2-F2、K4-F4多肽的。
2.2.3 大肠杆菌
R2-F2、R4-F4多肽与大肠杆菌共培养0 h和24 h的吸光度值见图6。
由图6可知,在胰酪大豆胨液体培养基中,当R2-F2、R4-F4多肽浓度≥0.500 mg·mL-1时,吸光度值显著增大,说明该浓度多肽溶解性较差。与大肠杆菌共培养24 h后,当R2-F2多肽浓度≥0.125 mg·mL-1、R4-F4多肽浓度≥0.250 mg·mL-1时,菌液的吸光度值相比0 h没有大幅增大,说明该浓度多肽有显著抑制大肠杆菌生长的效果,且R2-F2多肽的抗菌效果优于R4-F4多肽的。和图3相比较,R2-F2、R4-F4多肽的抗菌效果优于K2-F2、K4-F4多肽的。
3 结论
设计了4种具有不同分子序列的碱性氨基酸-PAF26衍生多肽,并研究其对白色念珠菌、金黄色葡萄球菌、大肠杆菌的抗菌性能。结果表明,相比于赖氨酸-PAF26衍生多肽,精氨酸-PAF26衍生多肽具有更加优异的抗菌效果;相比于引入4个碱性氨基酸,引入2个碱性氨基酸的PAF26衍生多肽具有更加优异的抗菌效果;相比于大肠杆菌,碱性氨基酸-PAF26衍生多肽对白色念珠菌、金黄色葡萄球菌具有更加优异的抗菌效果。为新型抗菌肽的设计和开发提供了参考。
a.R2-F2多肽 b.R4-F4多肽

