K2CO3促进3-亚烷基氧化吲哚与1-硝基丙烷选择性Michael加成及加成-消除反应
李少毅,马 晶,胡珊珊,李佳佳,李小娟
(新疆师范大学化学化工学院,新疆 乌鲁木齐 830054)
3-取代氧化吲哚类结构单元存在于多种天然产物和药物分子结构中,具有广泛的生理活性,引起了化学、药学及生物学领域研究者的普遍关注[1-2]。3-亚烷基氧化吲哚是构建手性3-取代氧化吲哚骨架的重要砌块,由靛红和芳酮经缩合-脱水反应制得,其3-位双键受到两边羰基的拉电子作用电荷密度较低[3],通常作为Michael加成受体来构建3-取代氧化吲哚衍生物。适用的加成给体包括活性亚甲基化合物[4]、富电子芳环[5-6]、氮亲核试剂[7]、吡啶溴鎓盐[8]等。
2012年,王伟课题组[9]报道了3-亚烷基氧化吲哚氰基酸酯与硝基烷烃加成反应制得3,3′-双取代氧化吲哚衍生物。2014年,扬州大学颜朝国课题组[10]报道了1,8-二氮杂二环十一碳-7-烯(DBU)催化3-亚烷基氧化吲哚与硝基甲烷的双加成反应,得到氧化吲哚五元双螺环状二聚体产物。2016年,兰州大学李瀛课题组[11]报道了3-亚甲基氧化吲哚酯与α-卤代酰胺的底物控制反应,其中酰胺底物的N-取代基作为控制开关,在相同条件下经消除-加成-加成或环化-加成-消除等途径,高选择性地合成螺氧化吲哚产物或唑酮氧化吲哚产物。综合文献发现,3-亚烷基氧化吲哚与硝基丙烷的反应也存在底物控制,3-亚烷基氧化吲哚底物的N-保护基对产物起决定作用:采用无取代3-亚烷基氧化吲哚为底物时,主要得到Michael加成产物;在氮原子上引入保护基如甲基、苄基、叔丁氧羰基等,则得到相应的加成-消除产物。鉴于此,作者对K2CO3促进3-亚烷基氧化吲哚与1-硝基丙烷的选择性Michael加成及加成-消除反应合成含有羰基、硝基等功能基团的3-取代氧化吲哚衍生物进行研究,并对产物结构进行表征。
1 实验
1.1 试剂与仪器
3-亚烷基氧化吲哚(Ⅰa~Ⅰl),自制,依据文献[3]方法合成。所用试剂由泰坦科技探索平台购买,均为分析纯或化学纯。
RE-52C型旋转蒸发仪,上海兴创仪器设备有限公司;85-1型磁力加热搅拌器,金坛医疗仪器厂;KQ-2200DE型超声波清洗器,昆山超声仪器有限公司;TENSOR 27型傅立叶变换红外光谱仪(KBr压片),美国BIO-RAD公司;XT4-100B型熔点测定仪,天津天光光学仪器有限公司;Varian Enity Inova-400 MHz型核磁共振仪,美国VARIAN公司。
1.2 合成方法
在1 mL甲苯中加入K2CO3(0.2 mmol,1.0 eq)、3-亚烷基氧化吲哚(0.2 mmol,1.0 eq)和1-硝基丙烷(0.2 mmol,1.0 eq),混合物在室温下搅拌约5 h,薄层色谱(展开剂:石油醚/乙酸乙酯,3∶1)监测;反应结束后,柱色谱(200~300目硅胶,石油醚/乙酸乙酯,5∶1)纯化;随后在甲醇中重结晶,得到目标产物。
2 结果与讨论
2.1 合成条件优化
以3-亚烷基氧化吲哚Ⅰa与1-硝基丙烷为底物进行模板反应(图1),改变溶剂、碱催化剂、反应温度、投料比(3-亚烷基氧化吲哚、1-硝基丙烷、碱的物质的量比),探究最佳合成条件,结果见表1。
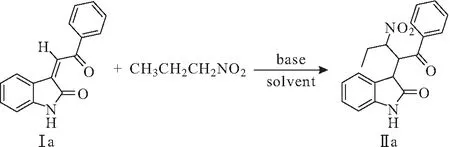
图1 3-亚烷基氧化吲哚与1-硝基丙烷模板反应Fig.1 Template reaction of 3-alkyleneoxindole with 1-nitropropane

表1 合成条件优化
从表1可知:
(1)在碱为K2CO3、室温、投料比n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.2∶1.0的条件下进行反应,考察溶剂(序号 1~5)对反应的影响。结果发现,以甲苯为溶剂时,收率最高,为72%。表明,溶剂极性的增加会导致收率下降,故选择溶剂为甲苯。
(2)在溶剂为甲苯、室温、投料比n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.2∶1.0的条件下进行反应,考察碱(序号5~11)对反应的影响。结果发现,碱性增强会使反应收率提高(序号5),在Cs2CO3促进下反应速率快,但生成较多副产物,收率下降(序号 8);有机碱的碱性相对较弱,收率较低(序号9~11)。故选择碱为K2CO3。
(3)在溶剂为甲苯、碱为K2CO3、投料比n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.2∶1.0的条件下进行反应,考察反应温度(序号5、12~14)对反应的影响。结果发现,当反应温度从室温升高到30 ℃、40 ℃时,收率均明显降低,0 ℃时底物反应不充分。表明,反应温度对反应影响较大,故选择反应温度为室温。
(4)在溶剂为甲苯、碱为K2CO3、室温的条件下进行反应,考察投料比(序号15~18)对反应的影响。结果发现,当n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶0.8∶1.0时,会使反应时间延长,同时底物有部分未反应,导致收率略有降低(序号 15);当n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶1.0时,收率较高(序号16);当n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶0.8时,反应时间明显延长,收率也明显降低(序号 17);当n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶1.2时,反应时间缩短,但反应体系变得较为复杂,收率降低(序号 18)。因此,选择投料比n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶1.0。
综上,确定最佳合成条件为:溶剂为甲苯,碱为K2CO3,室温,n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶1.0。
2.2 反应底物扩展
3-亚烷基氧化吲哚与1-硝基丙烷共轭加成产物如图2所示。3-亚烷基氧化吲哚的3-位双键虽然处于内酰胺羰基和苯酮羰基之间,其加成反应主要发生α,β-不饱和内酰胺体系的1,4-位。3-亚烷基氧化吲哚的对位取代基对实验结果影响不明显,R1为4-氟、4-氯、4-甲氧基、4-甲基、4-丙基等取代基时,收率67%~73%(图2,Ⅱb~Ⅱf)。3-亚烷基氧化吲哚的间位和邻位有取代基(如3-氯、2-甲基和2-氟)时,收率降低(图2,Ⅱg~Ⅱi)。1HNMR图谱表明,所得产物样品中存在两种非对映异构体,比例1∶(4~10)。
Noesy图谱可以说明不同种类氢原子之间的耦合关系,由产物的Noesy图谱可推测其非对映异构体比例。产物Ⅱd Noesy图谱(图3)显示,14号碳原子所在氢原子δ5.29(相关氢:17C-H-7.90,3C-H-7.26,9C-H-4.98,10C-H-3.95,16C-H-2.01,16C-H-1.79),9号碳原子所在氢原子δ4.98(相关氢:17C-H-7.90,3C-H-7.26,14C-H-5.29,10C-H-3.95,2C-H-0.82),而10号碳原子所在氢原子δ3.95(相关氢:17C-H-7.90,3C-H-7.26,14C-H-5.29,9C-H-4.98,16C-H-2.01,16C-H-1.79),显示产物主要异构体是syn/anti异构。

Ⅰa~Ⅰi:R1=H,4-F,4-Cl,4-OCH3,4-CH3,4-C3H7,3-Cl,2-CH3,2-F

注:(1)室温下,化合物Ⅰ(0.2 mmol,1.0 eq)、1-硝基丙烷(0.2 mmol,1.0 eq)及K2CO3(0.2 mmol,1.0 eq)在1 mL甲苯中反应;

图3 产物Ⅱd的Noesy图谱Fig.3 Noesy spectrum of product Ⅱd
由1HNMR图谱中两组特征峰面积比可计算syn/anti比例。产物Ⅱc1HNMR图谱(图4)在δ7.60与δ7.49处分别存在一组双峰,峰面积为0.2H和2H;δ6.90与δ6.70处分别存在两组双峰,峰面积为1H与0.1H;δ3.76与δ3.66处分别存在两组单峰,峰面积为1H与0.1H;δ1.16与δ0.87处分别存在两组三重峰,

图4 产物Ⅱc的1HNMR图谱Fig.4 1HNMR spectrum of product Ⅱc
峰面积分别为0.3H与3H。因此,可以推测两种异构体syn/anti比例为1∶10。
带有N-保护基的3-亚烷基氧化吲哚与1-硝基丙烷的反应主要得到加成-消除产物,保护基的位阻对反应结果影响不大,无论是N-Me、N-Bn、N-Boc等保护基,均以较高收率得到加成-消除产物(Ⅱj~Ⅱl,图5)。
N-保护基的3-亚烷基氧化吲哚(Z构型)与1-硝基丙烷的加成-消除反应主要得到热力学稳定性产物,化合物Ⅱj~Ⅱl呈单一E构型。

图5 N-保护基的3-亚烷基氧化吲哚与1-硝基丙烷的加成-消除反应Fig.5 Addition-elimination reaction of N-protected 3-alkyleneoxindoles and 1-nitropropane
2.3 目标产物表征
目标产物3-取代氧化吲哚衍生物Ⅱa~Ⅱl结构经1HNMR、13CNMR、HRMS、IR等测试表征,结果如下:
3-(1-苯甲酰基-2-硝基-丁基)吲哚-2-酮(Ⅱa):白色固体,收率72%,m.p.137~139 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.61(s,1H),10.38(s,0.2H),7.89(d,J=8.0 Hz,2H),7.61~7.52(m,2H),7.45(t,2H,J1=8.0 Hz,J2=16.0 Hz,2H),7.37(t,J1=8.0 Hz,J2=16.0 Hz,0.4H),7.25~7.24(m,1H),7.07~7.03(m,1H),6.91~6.87(m,0.2H),6.76~6.70(m,1H),6.58~6.51(m,0.2H),5.52~5.57(m,0.2H),5.37~5.31(m,1H),5.08~5.04(m,1H),4.81~4.78(m,0.2H),3.98~3.97(m,1H),2.08~2.00(m,1H),1.87~1.79(m,1H),0.98~0.94(m,0.6H),0.86~0.83(m,3H);13CNMR(DMSO-d6,100 MHz),δ:199.2,176.6,142.8,135.9,134.3,134.0,129.1,128.8,125.4,125.1,121.6,109.9,88.3,46.7,44.0,24.2,9.6;IR(KBr),ν,cm-1:3 186.40,1 716.84,1 651.18,1 472.51,753.48。
3-[1-(4-氟-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱb):白色固体,收率73%,m.p.155~157 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.60(s,1H),10.39(s,0.2H),7.98~7.95(m,2H),7.65~7.62(m,0.4H),7.29~7.19(m,3H),7.04(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.90(t,J1=8.0 Hz,J2=16.0 Hz,0.2H),6.76~6.69(m,2H),5.52~5.46(m,0.2H),5.41~5.35(m,1H),5.08~5.05(m,1H),4.79~4.76(m,0.2H),3.99~3.98(m,1H),2.13~2.03(m,1H),1.91~1.83(m,1H),0.96(t,J1=8.0 Hz,J2=16.0 Hz,1.5H),0.86(t,J1=8.0 Hz,J2=16.0 Hz,3H);13CNMR(DMSO-d6,100 MHz),δ:197.8,176.66~176.57(d,JCF=9.0 Hz),167.04,142.8,132.92~132.89(d,JCF=3.0 Hz),131.99~131.89(d,JCF=10.0 Hz),128.8,126.1,125.5,125.1,121.5,116.3,116.1,109.9,88.2,46.8,44.0,24.2,9.6;IR(KBr),ν,cm-1:3 177.43,1 715.16,1 681.81,1 549.22,752.93。
3-[1-(4-氯-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱc):白色固体,收率71%,m.p.154~156 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:8.07(d,J=8.0 Hz,2H),8.0(s,1H),7.60(d,J=8.0 Hz,0.2H),7.49(d,J=8.0 Hz,2H),7.30~7.29(m,1H),7.26~7.23(m,1H),7.02(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.90(d,J=8.0 Hz,1H),6.70(d,J=8.0 Hz,0.1H),5.22~5.17(m,1H),5.02~4.99(m,1H),3.76(s,1H),3.66(s,0.1H),1.78~1.70(m,1H),1.67~1.61(m,1H),1.16(t,J1=8.0 Hz,J2=16.0 Hz,0.3H),0.87(t,J1=8.0 Hz,J2=16.0 Hz,3H);13CNMR(CDCl3,TMS,100 MHz),δ:197.1,176.2,140.7,140.6,132.9,130.2,129.3,129.2,125.2,123.6,123.1,110.3,86.5,46.0,44.1,24.0,9.0;IR(KBr),ν,cm-1:3 187.29,1 708.18,1 547.59,1 457.90,749.58。
3-[1-(4-甲氧基-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱd):白色固体,收率72%,m.p.145~148 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.60(s,1H),10.40(s,0.2H),8.02(d,J=8.0 Hz,0.5H),7.91(d,J=8.0 Hz,2H),7.74(d,J=8.0 Hz,0.5H),7.25(t,J1=8.0 Hz,J2=16.0 Hz,1H),7.06(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.99~6.96(m,1H),6.92~6.86(m,1H),6.79~6.72(m,2H),5.29(t,J1=8.0 Hz,J2=16.0 Hz,1H),5.51~5.46(m,0.2H),5.02~4.98(m,1H),4.75~4.72(m,0.25H),3.93(d,J=8.0 Hz,1H),3.78(d,J=8.0 Hz,3H),2.06~1.99(m,1H),1.84~1.76(m,1H),0.97~0.94(m,0.7H),0.84~0.81(m,3H);13CNMR(DMSO-d6,100 MHz),δ:197.1,176.7,164.2,142.8,131.4,131.1,128.7,126.1,125.6,125.0,121.6,114.4,114.1,109.9,88.5,56.0,46.4,44.2,24.7,24.2,9.7;IR(KBr),ν,cm-1:3 179.41,1 707.53,1 596.50,1 542.62,725.79。
3-[1-(4-甲基-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱe):白色固体,收率70%,m.p.153~155 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:8.84(s,1H),8.42(s,0.1H),8.02(d,J=8.0 Hz,2H),7.30~7.27(m,3H),7.24~7.21(m,1H),6.99(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.92(d,J=8.0 Hz,1H),6.73(d,J=8.0 Hz,0.1H),5.19~5.14(m,1H),5.06~5.02(m,1H),4.91~4.88(m,0.1H),3.79(s,1H),3.71(s,0.1H),2.40(s,3H),1.72~1.57(m,2H),1.14~1.10(m,0.3H),0.84~0.81(m,3H);13CNMR(CDCl3,TMS,100 MHz),δ:197.8,177.1,145.2,140.8,131.9,129.7,129.0,128.9,125.2,123.9,123.0,110.4,86.7,46.0,44.5,24.0,21.7,9.1;IR(KBr),ν,cm-1:3 179.89,1 708.10,1 547.52,1 457.66,751.06。
3-[1-(4-丙基-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱf):白色固体,收率67%,m.p.130~132 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.61(s,1H),10.40(s,0.2H),7.83(d,J=8.0 Hz,2H),7.57(d,J=8.0 Hz,0.5H),7.28~7.22(m,1H),7.05(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.87(t,J1=8.0 Hz,J2=16.0 Hz,0.2H),6.77~6.71(m,2H),6.55~6.52(m,0.5H),5.48(t,J1=8.0 Hz,J2=16.0 Hz,0.2H),5.29(t,J1=8.0 Hz,J2=16.0 Hz,1H),5.02(d,J=8.0 Hz,1H),4.74(d,J=8.0 Hz,0.2H),3.96(s,1H),2.56(t,J1=8.0 Hz,J2=16.0 Hz,2H),2.03~1.98(m,1H),1.83~1.75(m,1H),1.58~1.52(m,2H),0.98~0.94(m,1H),0.85~0.81(m,6H);13CNMR(DMSO-d6,100 MHz),δ:198.6,176.6,149.4,142.8,133.6,129.1,129.0,128.7,125.5,125.0,121.6,109.9,88.3,46.6,44.1,37.5,24.2,24.0,13.9,9.6;IR(KBr),ν,cm-1:3 186.63,1 713.78,1 544.11,750.27。
3-[1-(3-氯-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱg):白色固体,收率56%,m.p.143~145 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.59(s,1H),10.49(s,0.2H),8.11~8.08(m,0.6H),7.98~7.94(m,3H),7.29~7.24(m,3H),7.04(t,J1=8.0 Hz,J2=16.0 Hz,1H),6.75~6.69(m,2H),5.52~5.46(m,0.2H),5.41~5.35(m,1H),5.08~5.04(m,1H),4.78~4.74(m,0.2H) 3.99~3.98(m,1H),3.71(d,J=4.0 Hz,0.2H),2.30~2.22(m,0.2H),2.13~2.04(m,1H),1.90~1.83(m,1H),0.97~0.93(m,0.6H),0.88~0.83(m,3H);13CNMR(DMSO-d6,100 MHz),δ:197.8,176.5,167.0,164.5,142.8,131.9,128.8,125.2,121.5,116.3,116.1,109.9,88.2,46.8,44.0,24.2,9.6;IR(KBr),ν,cm-1:3 170.17,1 714.41,1 556.96,1 369.28,747.60。
3-[1-(2-甲基-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱh):白色固体,收率61%,m.p.118~120 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:8.36(s,1H),7.98(d,J=8.0 Hz,1H),7.63(d,J=8.0 Hz,0.1H),7.42~7.32(m,2H),7.26~7.20(m,3H),7.00~6.97(m,1H),6.90(d,J=8.0 Hz,1H),6.72(d,J=8.0 Hz,0.1H),5.25~5.20(m,1H),4.98~4.95(m,1H),3.72(s,1H),2.41(s,3H),2.29(s,3H),1.77~1.62(m,2H),1.16~1.13(m,0.3H),0.90~0.87(m,3H);13CNMR(CDCl3,TMS,100 MHz),δ:201.3,176.5,140.8,139.6,135.3,132.3,132.1,129.1,129.0,126.1,125.0,123.9,123.0,110.3,86.8,49.0,44.1,24.1,21.1,9.2;IR(KBr),ν,cm-1:3 198.17,1 708.14,1 542.43,1 474.12,753.19。
3-[1-(2-氟-苯甲酰基)-2-硝基-丁基]吲哚-2-酮(Ⅱi):白色固体,收率31%,m.p.141~143 ℃。1HNMR(DMSO-d6,400 MHz),δ:10.67(s,1H),10.48(s,0.2H),7.97~7.84(m,0.5H),7.85~7.82(m,2H),7.59~7.56(m,1H),7.42(t,J1=8.0 Hz,J2=16.0 Hz,2H),7.38(d,J=8.0 Hz,1H),7.16(d,J=8.0 Hz,0.2H),7.04~7.02(m,1H),6.78~7.76(m,0.2H),6.65(d,J=8.0 Hz,1H),5.54~5.48(m,0.2H),5.49~5.43(m,1H),5.15~5.11(m,1H),4.77~5.73(m,0.3H),4.03(d,J=8.0 Hz,1H),2.23~2.15(m,1H),1.99~1.91(m,1H),0.92~0.89(m,3H),0.86~0.83(m,0.7H);13CNMR(DMSO-d6,100 MHz),δ:199.3,176.2,141.72~141.60(d,JCF=12.0 Hz),136.4,134.35~134.19(d,JCF=16.0 Hz),129.0,128.7,128.53~128.48(d,JCF=5.0 Hz),127.8,126.4,125.67~125.60(d,JCF=7.0 Hz),111.04~110.94(d,JCF=10.0 Hz),88.2,47.9,46.8,44.4,44.1,24.3,9.6;IR(KBr),ν,cm-1:3 184.87,1 714.93,1 549.43,1 436.96,684.91。
(E)-1-甲基-3-(1-苯甲酰基-2-丁烯基)吲哚-2-酮(Ⅱj):淡黄色固体,收率63%,m.p.133~135 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:7.65(d,J=7.2 Hz,2H),7.50(t,J=7.2 Hz,1H),7.40(t,J=7.2 Hz,2H),7.27(t,J=7.6 Hz,1H),7.08(d,J=7.6 Hz,1H),6.99(t,J=7.2 Hz,1H),6.86(d,J=7.6 Hz,1H),6.67(t,J=7.2 Hz,1H),4.65(s,1H),3.31(s,3H),2.41(s,2H),1.15(t,J=7.2 Hz,3H);13CNMR(CDCl3,TMS,100 MHz),δ:196.37,176.03,152.00,144.80,137.95,136.48,131.80,129.45,128.27,128.14,122.79,122.28,108.15,45.68,26.57,22.90,13.47;IR(KBr),ν,cm-1:3 056.24,2 968.29,2 934.03,2 876.13,2 309.40,1 713.06,1 650.24,1 612.02,1 550.62,1 493.36,1 469.88,1 374.33,1 345.74,1 126.05,794.09,698.45。
(E)-1-苄基-3-(1-苯甲酰基-2-丁烯基)吲哚-2-酮(Ⅱk):淡黄色固体,收率69%,m.p.165~167 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:7.68(d,J=6.8 Hz,2H),7.51(t,J=7.2 Hz,1H),7.46(d,J=7.6 Hz,2H),7.42(t,J=7.2 Hz,2H),7.34(t,J=7.2 Hz,2H),7.26(t,J=7.2 Hz,1H),5.02(s,2H),4.76(s,1H),2.41(s,2H),1.15(t,J=7.2 Hz,3H);13CNMR(CDCl3,TMS,100 MHz),δ:196.27,176.05,152.22,143.86,138.01,136.41,136.09,131.80,129.49,128.73,128.27,128.17,128.01,127.47,122.82,122.33,109.24,45.74,44.23,29.72,23.02,13.49;IR(KBr),ν,cm-1:3 056.24,2 968.29,2 934.03,2 876.13,1 711.86,1 649.80,1 612.00,1 597.66,1 550.54,1 487.61,1 466.70,751.31,698.88。
(E)-1-叔丁氧羰基-3-(1-苯甲酰基-2-丁烯基)吲哚-2-酮(Ⅱl):淡黄色固体,收率72%,m.p.153~155 ℃。1HNMR(CDCl3,TMS,400 MHz),δ:7.87(d,J=8.4 Hz,1H),7.61(d,J=7.2 Hz,2H),7.48(d,J=7.6 Hz,1H),7.39(t,J=7.2 Hz,2H),7.27(t,J1=2.8 Hz,J2=6.0 Hz,1H),7.06(t,J=7.2 Hz,2H),6.71(t,J=7.2 Hz,1H),4.74(s,1H),2.41(s,1H),1.64(s,9H),1.57(s,1H),1.23(s,1H),1.15(t,J= 7.2 Hz,3H);13CNMR(CDCl3,TMS,100 MHz),δ:195.27,182.79,175.50,148.06,147.39,140.42,138.97,136.97,136.10,126.73,126.60,126.54,124.17,90.63,86.13,85.81,83.79,67.41,66.35,59.68,54.85,28.12;IR(KBr),ν,cm-1:2 978.83,2 932.70,2 875.79,2 309.37,1 792.52,1 771.13,1 651.66,1 598.71,1 479.35,1 464.69,1 369.69,1 347.63,1 293.01,1 250.67,1 149.75,842.60,705.42,640.14。
3 结论
构建了一种新的合成3-取代氧化吲哚衍生物的方法,以K2CO3促进3-亚烷基氧化吲哚与1-硝基丙烷的选择性Michael加成及加成-消除反应,合成了12个目标产物(Ⅱa~Ⅱl),并通过1HNMR、13CNMR、HRMS、IR等表征其结构。确定最佳的合成条件为:溶剂为甲苯,碱为K2CO3,室温,n(3-亚烷基氧化吲哚)∶n(1-硝基丙烷)∶n(K2CO3)为1.0∶1.0∶1.0。该合成方法具有操作简单、条件温和、底物适用范围广等优点。

