双微导管联合弹簧圈填塞治疗对颅内动脉瘤患者认知功能、炎性因子及预后的影响
田秋思,梁彦彬,王 克,包志军,黄 伟
颅内动脉瘤(intracraninal aneurysm, IA)即颅内动脉管壁异常突出形成的血管性包块,目前认为该病的发生、发展与血管壁的原发病变及血流动力学的变化密切相关[1]。在破裂出血前,IA较大者存在脑缺血及神经压迫症状;而一旦瘤体裂开出血,患者可突发强烈头痛、意识不清等症状,严重者可导致死亡。因此该病以降低动脉瘤破裂出血风险作为治疗目的[2]。既往临床采用外科开颅手术夹闭动脉瘤治疗本病,但部分患者术后并发症频发,预后差[3]。栓塞治疗为利用纤维导管经体表进入体内治疗的一种手段,较传统手术方案而言具有更为显著的临床疗效,且预后更为满意[4]。此外,该项技术还具有操作简单、对载瘤动脉干扰少等优势[5]。故本研究分析双微导管联合弹簧圈填塞治疗对IA患者认知功能、炎性因子及预后的影响,以期为临床治疗提供新的思路。
1 对象与方法
1.1对象与分组 选取2017年7月—2019年7月本院收治的85例IA患者。纳入标准:满足IA诊断标准[6];临床资料完整。排除标准:多发动脉瘤者;存在重要脏器功能障碍者;对本研究所用药物、造影剂等过敏者;合并恶性肿瘤者;合并其他脑血管疾病者。85例根据手术方式的不同分为研究组45例及对照组40例。2组年龄、性别、Hunt-Hess分级及发生部位等比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组颅内动脉瘤患者基线资料比较
1.2治疗方法 所有研究对象入组后予止血、稳定颅内压、引流脑脊液及预防并发症等治疗,对照组在常规治疗基础上行开颅夹闭术,研究组在常规治疗基础上行双微导管联合弹簧圈填塞治疗。
1.2.1双微导管联合弹簧圈填塞治疗:患者全身麻醉及肝素化,采用Seldinger穿刺法将6F导管放置于动脉内,分别开展双侧椎动脉和颈内动脉造影。指引导管准确送至责任血管,采用3D血管造影术进行3D处理。根据3D处理结果将尖端塑性微导管送入动脉瘤内,放入1枚弹簧圈。在原指引导管尾段Y形阀上接第二个Y形阀,送入第二枚弹簧圈(位置不与第一枚弹簧圈重合)。然后取出最开始置入的弹簧圈,并置入第三枚弹簧圈。如此反复开展上述步骤,直至病变瘤体完全充满并保持血流通畅。
1.2.2开颅夹闭术:患者全身麻醉,采用从翼点进入等方式在患者头部切开一个弧形切口,长度7~8 cm。打开头骨,翻转皮瓣,在颞上线与冠状缝的交界线上钻孔,铣下骨窗。检测颅内压,弧形剪开硬脑膜,打开侧裂池,引流脑脊液减压。使动脉瘤瘤颈完全展现在手术视野中,使用临时瘤夹阻断血流,再选择合适的瘤夹彻底夹闭动脉瘤。止血缝合,关闭手术创口。
1.3观察指标
1.3.1手术指标:比较2组手术时长、住院时间。
1.3.2血流动力学指标:比较2组术前及术后24 h收缩压(SBP)、舒张压(DBP)、心率(HR)、每搏心输出量(SV)、心输出量(CO)、心排血指数(CI)。
1.3.3认知功能:术后7 d采用简易智能精神状态检查量表(MMSE)[7]评价2组认知功能,该量表包括计算及注意力、记忆力、定向力、语言能力、回忆力5个方面,各方面评分范围0~30分。
1.3.4炎性因子:抽取所有受检者术前及术后7 d清晨空腹静脉血3 ml,3000 r/min离心10 min取上清液,应用BD公司生产的FACSCalibur型流式细胞仪采用酶联免疫吸附法检测血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、转化生长因子-β(TGF-β)水平,试剂盒购自美国BD公司,严格按照说明书进行操作。
1.3.5预后:术后6个月采用改良Rankin量表(mRS)[8]和日常生活活动能力(ADL)量表[9]评价2组预后情况,前者总得分越低表示患者生活能力越好,后者总得分越高表示患者自主生活能力越好。
1.3.6术后并发症:比较2组脑积水、脑血管痉挛、短暂性脑缺血等术后并发症发生情况。

2 结果
2.1手术指标比较 研究组手术时长、住院时间均短于对照组(P<0.01),见表2。
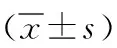
表2 2组颅内动脉瘤患者手术指标比较
2.2手术前后血流动力学指标比较 术前2组SBP、DBP、HR、SV、CO及CI水平比较差异无统计学意义(P>0.05);术后24 h,2组SBP、DBP、HR及SV水平均升高,CO、CI水平均降低,且研究组SBP、DBP、HR及SV水平较对照组高,CO、CI水平较对照组低,差异均有统计学意义(P<0.05或P<0.01)。见表3。
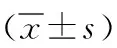
表3 2组颅内动脉瘤患者手术前后血流动力学指标比较
2.3术后认知功能比较 研究组术后7 d MMSE量表各方面评分均高于对照组(P<0.01),见表4。
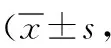
表4 2组颅内动脉瘤患者术后简易智能精神状态检查量表评分比较分)
2.4手术前后炎性因子比较 术前2组TNF-α、IL-6、TGF-β水平比较差异无统计学意义(P>0.05);术后7 d,2组TNF-α、IL-6、TGF-β水平均显著下降,且研究组低于对照组,差异均有统计学意义(P<0.05或P<0.01)。见表5。
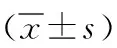
表5 2组颅内动脉瘤患者手术前后炎性因子比较
2.5预后比较 研究组术后6个月mRS评分低于对照组,ADL量表评分高于对照组,差异有统计学意义(P<0.01),见表6。
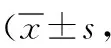
表6 2组颅内动脉瘤患者术后6个月mRS评分、ADL量表评分比较分)
2.6术后并发症比较 研究组术后出现短暂性脑缺血及脑积水各1例,术后并发症发生率为4.44%;对照组术后出现脑积水3例、脑血管痉挛2例,术后并发症发生率为12.50%。2组术后并发症发生率比较差异无统计学意义(P>0.05)。
3 讨论
IA是一种非常严重的病症,患病率为2%~4%。临床研究显示,约50%的IA因破裂而出现蛛网膜下腔出血,而蛛网膜下腔出血为导致脑血管意外的第三大原因,致死率为32%~67%[9-10]。IA已成为威胁我国的重要公共卫生问题,故寻求有效的临床治疗手段成为临床关注的焦点。
手术是治疗IA的主流手段,开颅夹闭术为传统方案,然而对大量患者预后分析发现,该方式存在诸多弊端:①手术损伤较大,术后并发症多,患者恢复时间长,并增加了患者身心负担;②对颅内动脉所处区域及流向的限制较多,例如位于海绵窦内或靠近前床突的动脉瘤位置靠下,术中瘤颈暴露不明显等可影响预期效果[11-13]。随着血管内治疗技术的不断进步和相关医疗器械的更新换代,本病治疗目标已不同于既往的瘤囊内栓塞,而是逐渐转变为血管内重建[14]。目前弹簧圈填塞已成为治疗颅内大型动脉瘤的有效手段,合理且精细填充弹簧圈能恢复颅内正常血流,截断载瘤动脉,防止血管内膜损伤和血栓等发生[15-16]。然而近年发现,单纯弹簧圈填塞存在填塞不完整、填塞后再脱落等现象,易术后复发,故如何均匀致密填塞动脉瘤尤为重要[17]。
双微导管技术即利用2根微导管植入不同作用的弹簧圈,兼具填塞封闭动脉瘤颈、保护已填塞的弹簧圈突出于载瘤动脉等作用[18]。同时,双微导管技术由于2根微导管相互保护,填塞动脉瘤会更迅速,进一步提高了手术安全性[19]。本研究结果显示,研究组手术时长、住院时间均短于对照组,术后6个月mRS评分低于对照组,ADL量表评分高于对照组,说明与传统开颅夹闭术相比,双微导管联合弹簧圈填塞治疗具有简单方便、疗效及安全性满意的特点,并对于避免患者预后不良有重要意义。同时,本研究结果还显示,研究组术后血流动力学指标、认知功能改善程度更为显著,分析其原因可能为双微导管联合弹簧圈填塞无须行抗血小板聚集治疗,可一定程度上避免动脉瘤破裂出血;部分患者术后恢复满意,促进了术后认知功能的恢复。
此外,病灶处大量分泌的巨噬细胞和淋巴细胞浸润引发的炎症反应在IA发病中起着重要作用。TGF-β是一种具有双向调节功能的多肽,在细胞各种正常生理活动中起着重要作用[20]。TNF-α主要由单核巨噬细胞产生,有学者在研究IA发病机制时发现,TNF-α表达水平显著升高,并且认为其水平异常升高可引起损伤部位发生严重的炎症反应,导致内皮细胞数量减少,从而引发动脉瘤[21]。同时,TNF-α还可促进IL-6的合成,而IL-6具有促进动脉粥样硬化作用。因此,有效降低炎性因子水平成为临床治疗IA的关键[22]。本研究结果显示,术后7 d,2组TNF-α、IL-6、TGF-β水平均显著下降,且研究组低于对照组,进一步说明双微导管联合弹簧圈填塞治疗可明显降低IA患者炎性因子水平。
综上,双微导管联合弹簧圈填塞治疗可显著降低IA患者体内炎性因子水平,改善患者认知功能、血流动力学指标及预后,且安全性高。

