脉冲群电磁场对体外培养成骨细胞增殖与矿化的影响
高玉海,何文芳,刘 菁,任 莉,吴思敏,陈克明
脉冲电磁场(PEMFs)为一种良好的生物物理治疗方法,已有诸多文献报道了其具有促进成骨细胞增殖与成熟矿化、增加青年大鼠峰值骨量、促进骨折愈合的作用[1-3]。因PEMFs具有无创伤、无感染、操作简单、无不良反应等特点,近年有学者将其用于神经修复、腰椎间盘突出症治疗等方面的研究[4-5]。脉冲群电磁场(PGEMFs)作为PEMFs的一种改良,作用效果如何尚未有文献报道。课题组前期已筛选出PEMFs促进成骨细胞增殖与成熟矿化的最佳作用频率、强度和时间,但动物实验结果表明,其存在一定的不稳定性。故本实验旨在通过观察PGEMFs对体外培养大鼠成骨细胞(ROBs)增殖与矿化的影响,以期为增加骨形成提供新思路。
1 材料与方法
1.1PGEMFs发生装置 PGEMFs电源由课题组联合中国科学院兰州近代物理研究所电源室研发(尚未申请专利)。该电源能够实现脉冲波、脉冲群波的稳定输出,通过连接计算机,运用自主设计的控制软件实现时间、频率、强度及脉冲波与脉冲群波的不同比例混合等。电源连接线圈可产生一定范围的均匀磁场,并能放置于细胞培养箱内。
1.2仪器与试剂耗材 CO2培养箱(Thermo Revco公司,美国);倒置相差显微镜(Olympus公司,日本);台式高速离心机(Heraeus公司,德国);高速冷冻离心机(湘仪实验室仪器开发有限公司,中国);低速离心机(北京医用离心机厂,中国);酶标仪(Bio Tek公司,美国);1000 ml、100 μl、10 μl移液枪(Eppendorf公司,德国)。
α-MEM培养基(Gibco公司,货号:2090463);胎牛血清(Lonsera公司,货号:S711-001S);青链霉素混合液(索莱宝公司,货号:P1400);胰蛋白酶-EDTA溶液(索莱宝公司,货号:T1300);Ⅱ型胶原酶(索莱宝公司,货号:C8150);地塞米松(Sigma公司,货号:D1756);维生素C(Sigma公司,货号:A7631);β-甘油磷酸(阿拉丁公司,货号:D106347);碱性磷酸酶(ALP)检测试剂盒(南京建成生物工程有限公司,货号:A059-1-1);100 mm、60 mm培养皿(Coring Costar公司,货号:430167/430196);35 mm培养皿(Thermo公司,货号:150460);一次性移液管(科进公司,货号:1441);1.5 ml离心管(科进公司,货号:2211S);10 μl、100 μl、1000 μl枪头(科进公司,货号:180805H、200592J、190498J)。
1.3实验方法
1.3.1大鼠颅骨成骨细胞培养:取出生48 h以内的SPF级SD大鼠乳鼠(甘肃省中医学院动物实验中心提供,合格证号:SCXK-甘-2009-0006-152),75%乙醇浸泡,无菌条件下取出颅骨,置入干净的培养皿中,去除骨膜、血管及结缔组织,磷酸盐缓冲溶液(PBS)漂洗2次。加入0.25%胰蛋白酶37℃消化15 min,弃去消化液;再加入0.1%Ⅱ型胶原酶37℃消化5次,每次12 min,收集并合并消化液,200目细胞筛过滤。收集消化液,1000 r/min离心10 min,弃去上清液,沉淀用含10%胎牛血清的α-DMEM培养液悬浮,吹打均匀后,调整细胞浓度至1×105/ml。置于37℃、5% CO2培养箱中培养,每3天换液1次。待细胞生长至80%融合时进行后续实验。成骨性分化培养的条件为在原培养液基础上加入地塞米松1×10-8mol/L、β-甘油磷酸1×10-2mol/L和维生素C 1×10-4mol/L。
1.3.2细胞增殖分析:将原代培养细胞用胰蛋白酶消化悬浮后,调整细胞浓度至3×104/ml,以每皿2 ml接种于60 mm培养皿中,24 h后根据实验设计进行分组,每组3皿。对照组:将ROBs放入线圈内90 min/d,但不通电;脉冲组:ROBs予50 Hz、0.6 mT、占空比为50%的PEMFS处理90 min/d;脉冲群组:ROBs予主脉冲频率10 Hz、子脉冲频率500 Hz、0.6 mT的PEMFs处理90 min/d。磁场处理完毕后,换含0.5% MTT的无血清培养基继续培养4 h,弃培养液,加入二甲基亚砜震荡至紫红色结晶全部溶解,于490 nm波长处测定吸光度(OD)。
1.3.3成骨性分化分析:将原代细胞接种于60 mm培养皿中,每3天换液1次,待细胞生长至接近融合时加入成骨性诱导剂(L-抗坏血酸50 mg/L、β-甘油磷酸10 mmol/L和地塞米松1×10-8mol/L),同时按实验设计进行分组和磁场处理。成骨性分化指标包括:①ALP:电磁场分别处理3、6、9、12 d后将ROBs用胰蛋白酶处理并回收,后用细胞裂解液裂解细胞,胞内ALP活性按试剂盒按说明书操作,520 nm波长处测定OD值,蛋白浓度用BCA试剂盒测定。②钙化结节数量和面积:成骨性诱导培养12 d后弃培养液,PBS液漂洗2遍,加入10%多聚甲醛固定10 min。弃固定液,加入0.2%茜素红染色液(pH 8.9)于37℃条件下孵育1 h,三蒸水漂洗3遍,清洗干净背景即可。照相记录图片结果,用Image-Pro Plus 6.0软件量化分析。③基因表达分析:培养细胞经不同磁场处理3 d后,弃细胞培养液,PBS液漂洗2次。加入Trizol 750 μl裂解细胞并收集裂解液,加入氯仿200 μl混匀后室温放置5 min,4℃ 12 000×g离心20 min。取上清,加入对半体积异丙醇,混匀后室温放置30 min,4℃ 10 000×g离心20 min。弃上清,加入DEPC水配制的75%乙醇1 ml洗涤沉淀,4℃ 10 000×g离心10 min。弃上清,加入无RNA酶双蒸水30 μl重悬沉淀,-80℃保存备用;逆转录制备cDNA,按照TaKaRa Prime ScriptTMReagent Kit说明书合成cDNA,-20℃保存备用;PCR扩增cDNA。按照SYBR Premix Ex TaqTMⅡ说明书添加PCR反应体系,进行40个循环扩增目的基因,RT-PCR数据处理采用2-ΔΔCt法,合成引物序列见表1。

表1 RT-PCR引物序列

2 结果
2.1对细胞增殖的影响 各组处理3 d后行MTT分析,结果表明脉冲组和脉冲群组均可显著刺激细胞增殖(P<0.01),见图1。

图1 3组大鼠成骨细胞MTT检测结果比较
2.2对ALP活性的影响 处理3 d后,脉冲群组ALP活性高于脉冲组及对照组(P<0.05);处理6、9 d后脉冲组和脉冲群组ALP活性均高于对照组(P<0.01);处理12 d后脉冲组和脉冲群组ALP活性略高于对照组,但差异无统计学意义(P>0.05)。见图2。
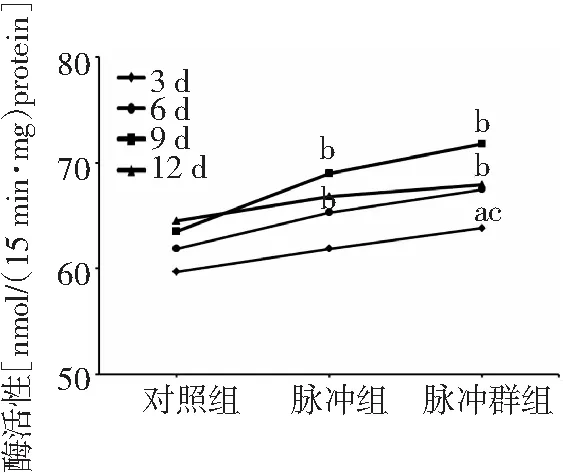
图2 3组大鼠成骨细胞碱性磷酸酶活性检测结果比较
2.3对钙化结节的影响 茜素红染色结果显示,脉冲群组和脉冲组钙化结节数量多于对照组,钙化结节面积大于对照组,差异有统计学意义(P<0.01)。见图3、表2。

图3 3组大鼠成骨细胞钙化结节茜素红染色结果
2.4对基因表达的影响 各组处理3 d后用RT-PCR法检测骨形成相关因子基因表达情况。脉冲群组和脉冲组ALP、BMP-2、RUNX-2和OSX基因表达水平均显著高于对照组(P<0.01)。见图4。
3 讨论
近年来,PEMFs在骨科疾病中的应用引起了国内外学者的广泛关注,其具有易操作、安全性高的特点[6]。研究表明,PEMFs不但可以预防和治疗骨质疏松症,而且对于缓解骨折后肿胀、骨痛、骨性关节炎等均有很好的疗效[7-9]。PGEMFs是在PEMFs基础上,改变了波形输出,将原先单纯的方波输出切换为脉冲群加方波的形式输出,为促进骨形成、预防和治疗骨质疏松症及促进骨折愈合提供了更为广阔的研究思路。PEMFs对ROBs增殖与矿化作用已被诸多文献报道[10-11],本文旨在研究PGEMFs是否有同样的作用。
MTT检测结果显示,PEMFs和PGEMFs分别干预ROBs 3 d后,均明显促进了ROBs的增殖。且从图1可以看出,脉冲群组的OD值高于脉冲组,虽然二者间差异无统计学意义,但也能说明PGEMFs对于ROBs增殖有明显作用。
ALP活性是成骨性分化的早期指标,电磁场干预会增加ALP活性[12]。本研究在PEMFs和PGEMFs分别干预ROBs 3、6、9、12 d后行ALP活性检测,结果显示干预3 d后脉冲群组ALP活性与对照组比较差异即有统计学意义,体现了PGEMFs促进骨形成作用起效较早;干预6、9 d后脉冲组和脉冲群组ALP活性与对照组比较差异均有统计学意义,且脉冲群组ALP活性始终高于脉冲组,说明PGEMFs作用效果强。而干预12 d后脉冲组和脉冲群组ALP活性略高于对照组,但差异无统计学意义。
钙化结节染色能够显示ROBs成熟矿化的情况,钙化结节数量越多,说明新骨形成的能力越强。本研究结果显示,脉冲群组和脉冲组钙化结节数量多于对照组,钙化结节面积大于对照组,差异有统计学意义。说明脉冲群组和脉冲组均可促进ROBs钙盐的沉积,有很好的新骨形成能力。脉冲群组与脉冲组相比,前者钙化结节数量略多,钙化结节面积略大,但差异无统计学意义,也可一定程度说明PGEMFs促进新骨形成的能力较强。
ALP、BMP-2、RUNX-2和OSX均是骨形成调节因子,新骨形成过程离不开这些因子的参与,可直观反映骨形成活跃程度[13-14]。本研究图4结果显示,PEMFs和PGEMFs干预均可显著增强ALP、BMP-2、RUNX-2和OSX骨形成相关因子的基因表达,差异有统计学意义。说明磁场干预可刺激骨形成相关因子的基因表达升高,从而起到正向调节作用,再一次证明磁场具有促进骨形成的作用。脉冲群组与脉冲组ALP、BMP-2、RUNX-2和OSX基因表达差异虽然无统计学意义,但是脉冲群组ALP、BMP-2、RUNX-2和OSX基因表达均高于脉冲组,说明PGEMFs正向调节能力更强,存在潜在优势。
综上所述,PGEMFs可通过促进ROBs细胞增殖、提高ALP活性、增加钙盐沉积量及调节骨形成相关因子的基因表达,从而增加ROBs的成熟矿化,具有很强的促进骨形成能力。然而,PGEMFs是否也会增加大鼠峰值骨量、抑制或治疗去势大鼠的骨丢失及加速骨折愈合等作用尚有待课题组进一步研究。

