纳米中空氧化锡载非洛地平推拉式双层渗透泵片的制备
胥智铭,高宇,吴超
(1.锦州医科大学;2.锦州医科大学附属第一医院,辽宁 锦州 121000;3.抚顺市中心医院,辽宁 抚顺 113000)
高血压是心血管疾病最主要危险因素,其发病率逐年升高且发病年龄呈现年轻化的趋势,已成为全球不可轻视的重大公共卫生问题[1-2]。非洛地平(felodipine,FDP)是一种二氢吡啶类钙离子通道拮抗剂,其降压作用平稳,对各期高血压疗效明显,不良反应少,目前在临床上被重点关注。但非洛地平属于BCSⅡ类药物,即水溶性差,渗透性高。口服非洛地平难以被机体吸收,生物利用度低[3-4]。开发新型药物递送系统既提高非洛地平的水溶性和溶出速度同时调控药物释放速率维持长期稳定血药浓度,对于提高非洛地平的安全性、有效性以及患者的顺应性,使其在临床上发挥更大的作用至关重要。近年来,纳米材料解决难溶性药物溶出速率而增加机体对药物口服吸收备受青睐[5-6]。但纳米材料仅成功地解决了难溶性药物溶出速率的问题,未能改善药物吸收后不可控的释放引起的血药浓度的峰谷现象。而渗透泵技术[3-4,7-8]298-305,823-829是以渗透压差为驱动力,释药速率符合零级释药动力学特征,且释药行为不受环境(pH值、食物及胃肠道蠕动)等因素影响。本研究中利用纳米材料中空氧化锡作为药物载体,然后制备推拉式双层渗透泵片,提高非洛地平的口服生物利用度。
1 仪器与材料
KSXL-1002马弗炉(杭州卓驰仪器有限公司),JEM-1010透射电子显微镜(日本电子株式会社),BT-Zeta100型纳米粒度分析仪(丹东百特仪器有限公司),IRAffinity-1红外光谱仪,HS-DSC-101差示扫描量热仪(上海和晟仪器科技有限公司),ZEISS LSM 700激光共聚焦显微镜(上海莱瑟光谱仪器分析技术有限公司),TDP型单冲压片机(上海第一制药机械厂),RC806D溶出试验仪(天津市天大天发科技有限公司),UV-9100型紫外分光光度计(北京普析通用仪器有限责任公司),LC-2030 高效液相色谱仪(日本岛津公司)。
非洛地平(武汉远成共创科技有限公司,批号:140220),二氯化锡、氯化锌、十二烷基硫酸钠、醋酸纤维素(分析纯,国药集团化学试剂有限公司),甲醇(色谱纯,天津光复精细化工有限公司),溴化钾(分析纯,天津市科密欧化学试剂有限公司)、聚环氧乙烷(分析纯,阿拉丁试剂(上海)有限公司),非洛地平缓释片(合肥立方制药股份有限公司,批号:191006)、Hoechst 33342,罗丹明鬼笔环肽,异硫氰酸荧光素(FITC)(北京鼎国昌盛生物科技有限公司)、其余制剂均为市售分析纯。
2 实验方法
2.1 HMSn-FDP的制备
2.1.1 HMSn的制备[9-11]
取0.35 g SnCl2·2H2O、0.14 g ZnCl2、0.04 g NaOH和40 mL去离子水置于锥形瓶,搅拌2 h至混合均匀,将2 nmol/L NaOH溶液20 mL缓慢滴加至混合溶液,搅拌1 h,离心,沉淀物经水洗、醇洗3次后干燥。干燥产物在650 ℃空气氛围下煅烧5 h后得到白色产物,在室温条件下将白色产物加入20%氢氟酸溶液中搅拌分散30 min后离心,白色产物经水洗3次后干燥,最后收集干燥产物,即得中空二氧化锡纳米粒(HMSn)。
2.1.2 载药
采用吸附法进行载药。取800 mg FDP溶于1 mL二氯甲烷中,加入100 mg HMSn超声至分散均匀后搅拌过夜。离心,得到沉淀物干燥,即得HMSn-FDP。精密称取5.0 mg HMSn-FDP置于10 mL容量瓶,加甲醇溶解并稀释至刻度。静置1 h,离心,取上清液为供试品,在237 nm下测定吸光度并计算载药量。载药量=测得FDP的量/HMSn-FDP的量×100%
2.2 表征
2.2.1 TEM HMSn的形态结构通过JEM-1010透射电子显微镜观察,检测电压为200 kV。
2.2.2 DSC FDP在HMSn-FDP中存在状态通过差示扫描量热法在氮气氛围下检测,温度范围为(50~300)℃,扫描速率10 ℃/min,绘制DSC曲线。
2.2.3 FTIR对FDP、HMSn-FDP及HMSn和FDP的物理混合物通过红外光谱仪进行检测
扫描波数为(400~4000)cm-1,KBr为空白。
2.3 HMSn肠道分布实验
首先采用 FITC对HMSn进行标记得到FITC-HMSn。取220 g雄性SD大鼠,实验前禁食12 h,将FITC-HMSn经口服给药(10 mg/kg),2 h后处死,取十二指肠、空肠和回肠各1 cm段,经4%多聚甲醛固定4 h,转移至15%、20%、30%蔗糖水溶液进行脱水处理。取适量OCT包埋剂浸没组织处理后进行冷冻切片,取8 μm组织切片置于载玻片上。经PBS洗3次后,室温下4%多聚甲醛固定。然后PBS洗3次,在4 ℃下,用0.1% 的Triton X-100 孵育10 min。在37 ℃下1%白蛋白封闭液封闭30 min后染色。采用Hochst 33342和罗丹明鬼笔环肽染色对切片染色。染色结束PBS洗3次后封片,荧光共聚焦显微镜下观察各组切片。
2.4 HMSn-FDP体外溶出实验
按照《中华人民共和国药典》2020版释放度测定法第二法,考察HMSn-FDP在规定条件下的溶出速率和程度。溶出介质为1.0% SDS水溶液,温度为37.0 ℃,转速为100 rpm。精密称量相当于5.0 mg FDP 的HMSn-FDP分散于500 mL溶出介质。投药后按预定时间 5、10、15、20、30、45、60、120 min取样4 mL,经0.45 μm微孔滤膜滤过为供试品,取样后补充等量空白释放介质。供试品在237 nm下测定吸光度并计算FDP累计溶出度。
2.5 HMSn-FDP渗透泵片的制备[3-4,12]298-305,823-829
2.5.1 渗透泵片芯制备
采用粉末直接压片法制备渗透泵片芯,片芯包括药物层和助推层两部分,处方见表1。分别称取处方量药物层和助推层的原辅料,过80目筛,以等量递加法混合均匀;采用双层压片技术压制片径为6 mm的渗透泵片芯。

表1 HMSn-FDP渗透泵片处方
2.5.2 包衣与打孔
取处方量醋酸纤维素溶于丙酮,加入处方量PEG水溶液,持续搅拌4 h混合均匀即得包衣液。将制备渗透泵片芯置于包衣锅内进行包衣,转速为35 rpm,温度为50 ℃,待包衣增重至合格后,转移至40 ℃烘箱内干燥24 h。取出干燥后的包衣片,采用打孔针在药物层和助推层的中央各打一释药小孔,孔径为0.8 mm。
2.6 HMSn-FDP渗透泵片的体外释放度考察
按照《中华人民共和国药典》2020版释放度测定法第二法,比较HMSn-FDP渗透泵片和市售FDP缓释片在规定条件下的体外释放度。溶出介质为1000 mL的0.1% SDS水溶液,温度为37 ℃,转速为100 rpm。于0.5、1、1.5、2、4、6、8、10、12、24 h取样5 mL,取样后立即补充的等量新鲜介质,样品0.45 μm 微孔滤膜滤过,取续滤液,在 237 nm下测定吸光度并计算FDP的累积释放度。
2.7 HMSn-FDP渗透泵片的体内药物动力学实验
将12只体重为2.5 kg的健康家兔随机分为两组,禁食12 h。家兔经口服给予HMSn-FDP渗透泵片或FDP缓释片,剂量为10 毫克/只。给药后分别于0.5、1、1.5、2、4、6、8、10、12、24 h经耳缘静脉取血3 mL,置于含有肝素的EP管中,离心,取上层血浆。取1 mL 血浆样品置于10 mL 离心管中,加入20 μL尼群地平内标溶液(1 ppm),4 mL 乙酸乙酯和300 μL NaOH水溶液(1 M),涡旋10 min,离心,取上清液,40 ℃挥干,使用50 μL流动相复溶,涡旋5 min,离心,上清液经0.45 μm微孔滤膜滤过,取续滤液为供试品溶液,经HPLC测定血浆中FDP的浓度并绘制血药浓度-时间曲线和计算相关体内药动学参数。
3 结果与讨论
3.1 HMSn-FDP的制备
HMSn-FDP的合成流程图如图1所示。本研究采用自模板法利用共沉淀反应合成具有立方笼式结构的ZnSn(OH)6,然后利用酸蚀、煅烧的技术获得具有中空立方笼式结构SnO2纳米粒(HMSn)。最后采用吸附法将FDP负载到HMSn的中空结构中获得HMSn-FDP。经UV测定HMSn-FDP载药量为(31.73±2.26)%。
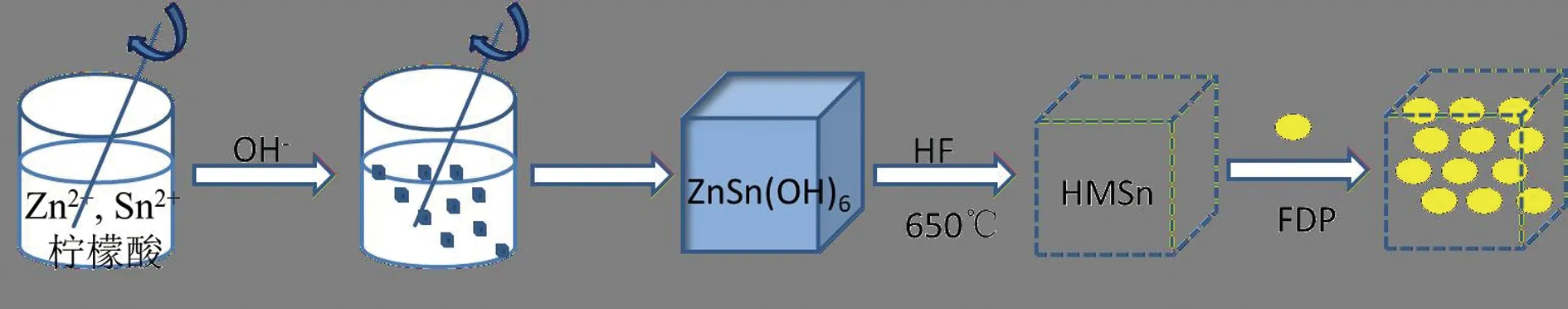
图1 HMSn-FDP制备流程示意图
3.2 表征
通过TEM对HMSn的形貌结构进行表征,结果如图2A所示。HMSn是呈单分散状态的内部中空的立方体式核壳结构,粒径约为230 nm。HMSn的壳层表面晰地可见高度有序的介孔结构,核心的中空结构可为药物贮库。负载于中空结构中的难溶性药物FDP因纳米空间限制效应可导致药物的溶解度和溶出速率显著增加。通过DSC对药物FDP在HMSn中的晶型状态进行表征,结果如图2B所示。HMSn的DSC曲线未见任何吸热峰,FDP、 HMSn和原料药FDP的物理混合物(PM)的DSC曲线中均在145 ℃出现的吸热熔融峰表明FDP处于高度的结晶状态,而HMSn-FDP的DSC曲线中FDP吸热熔融峰的消失表明药物负载于HMSn中的FDP的晶型发生了改变,可能是形成无定型物质。无定型的固态药物的自由能低,其溶出速率高于稳定的晶态物质。通过FT-IR鉴定药物FDP 和 HMSn 之间是否发生化学反应,结果如图4所示。HMSn-FDP与HMSn和原料药FDP的物理混合物(PM)与FDP的红外光谱图无明显差异,未见新峰及任何峰的迁移,表明HMSn与FDP 未发生化学反应,FDP是以物理吸附的形式负载于HMSn的中空结构。
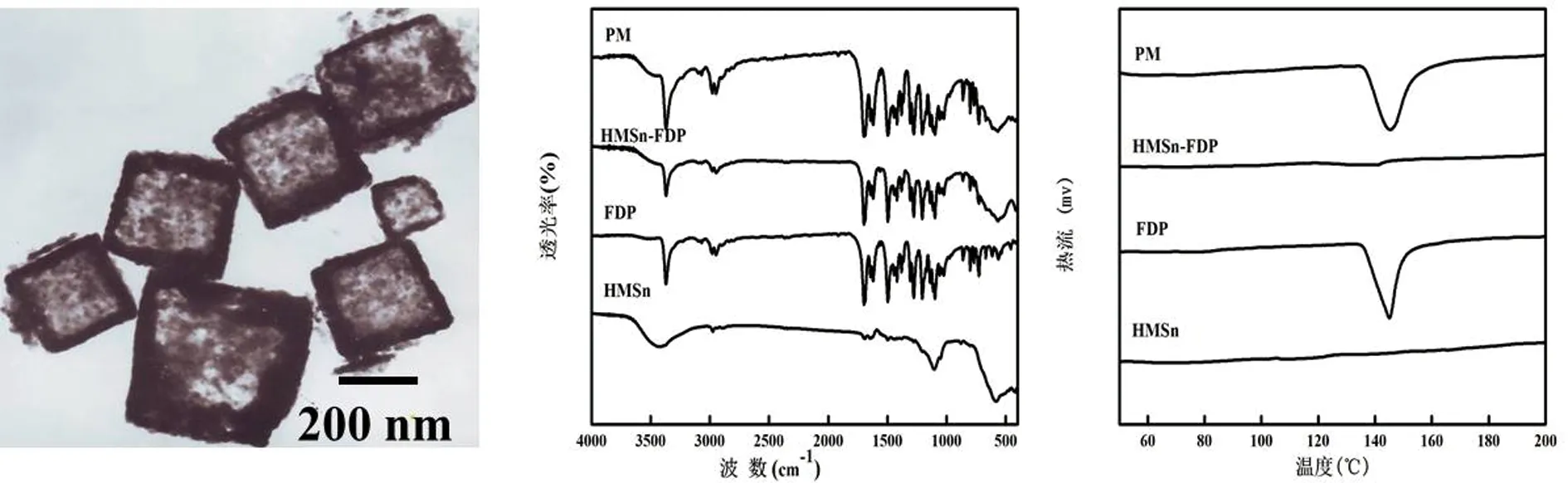
A B C
3.3 HMSn肠道分布
通过共聚焦显微镜CLSM观察FITC-HMSn在大鼠小肠中的分布情况,结果如图3所示。大鼠小肠各个节段(十二指肠、空肠和回肠)的肠上皮细胞的细胞质中可见大量的呈现绿色荧光的FITC-HMSn。HMSn经口服后能够快速被肠道摄取,更有利于促进FDP的吸收,提高FDP的生物利用度。
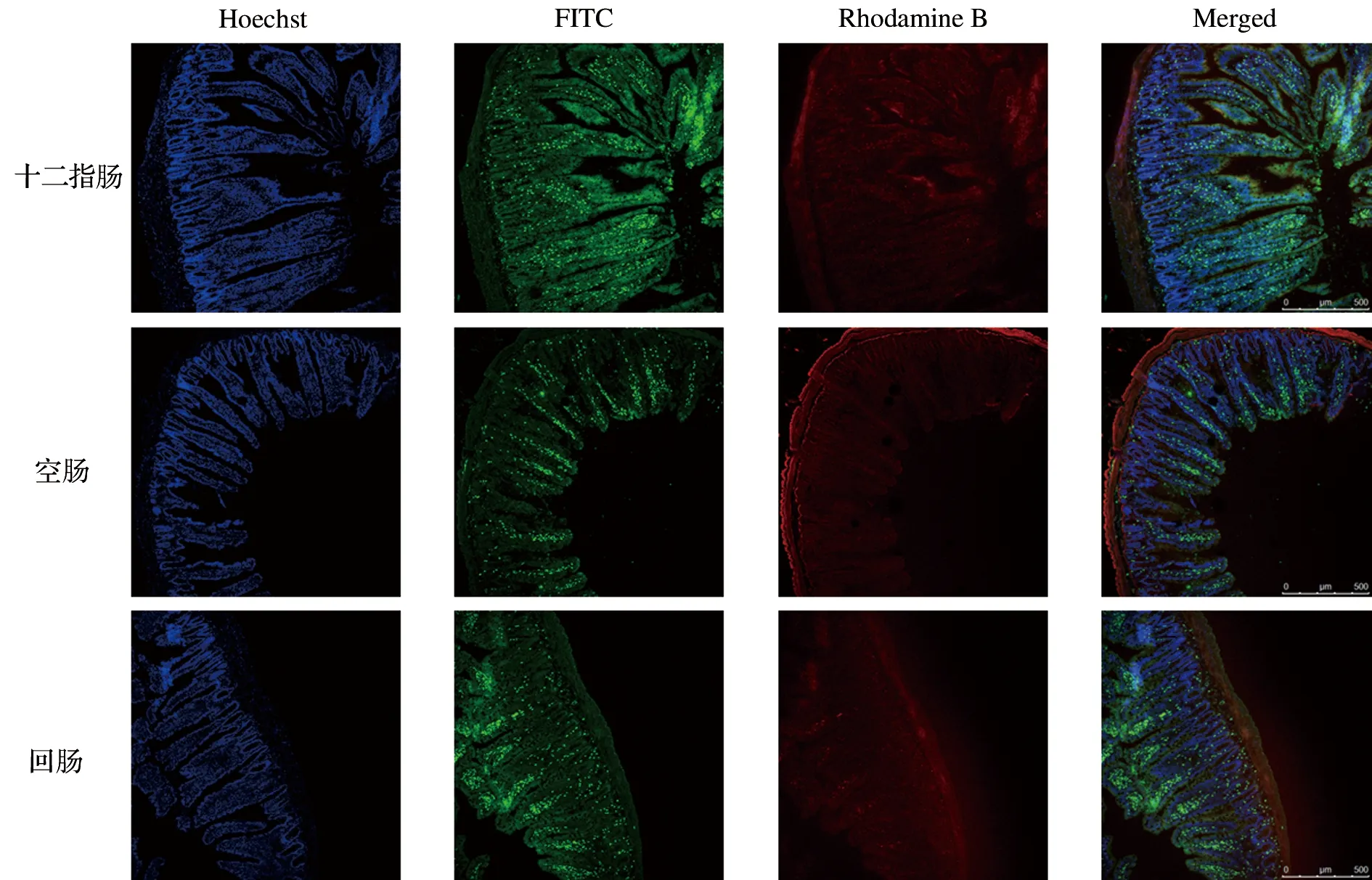
图3 FITC-HMSn在大鼠小肠各个节段中的激光共聚焦图像
3.4 HMSn-FDP和HMSn-FDP双层渗透泵片剂的体外溶出度
通过体外溶出度实验考察HMSn改善FDP溶出速率和程度,结果如图4A所示。FDP原料药在60 min的溶出度仅为(24.53±2.13)%,而HMSn-FDP则高达(92.06±3.57)%,表明HMSn能显著提高FDP的溶出速率。对比市售缓释片与HMSn-FDP双层渗透泵片在1% SDS水溶液中的体外释放度,结果如图4B所示。市售缓释片中FDP在6 h基本完全释药,而HMSn-FDP双层渗透泵片在12 h内几乎维持恒定的释药速率。将二者的累积释放度进行零级动力学释药方程、一级动力学释药方程、Higuchi 释药方程数据拟合,市售缓释片的释放行为更符合一级模型(R22= 0.9638),HMSn-FDP双层渗透泵片的释放方式符合零级模型(R12=0.9964)。

A B C
3.5 HMSn-FDP双层渗透泵片的体内药动学参数测定
HMSn-FDP双层渗透泵片和市售缓释片在家兔体内血药浓度-时间曲线结果如图4C所示,家兔口服HMSn-FDP双层渗透泵片和市售缓释片相关药代动力学参数结果如表2所示。与市售缓释片相比,HMSn-FDP双层渗透泵片的Tmax延长约2倍,Cmax仅为市售缓释片的(72.96±0.61)%,AUC0-∞明显升高,经计算HMSn-FDP双层渗透泵片的口服生物利用度提高了(121.32±0.52)%。

表2 家兔口服HMSn-FDP双层渗透泵片和市售缓释片相关药代动力学参数
4 结 论
本研究采用纳米材料HMSn作为FDP的药物载体,HMSn可显著提高难溶性药物FDP的溶解度和溶出速度,并且HMSn经口服后能够快速被肠道摄取,促进FDP经口服的吸收。渗透泵技术有效调控FDP的释放速率,使血药浓度在较长时间维持在治疗窗范围内,避免血药浓度的峰谷现象,提高难溶性药物FDP的生物利用度并减少不良反应。综上所述,纳米材料联合控释技术构建高生物利用度新型递送系统是提高BCS II类药物的生物利用度一种有效制剂手段。

