密花香薷侵入对高寒草甸土壤特性和细菌多样性的影响
肖云星,王亚男,马丹炜,周汐婕,吴雨要,谢雨思,周吴昊
(四川师范大学生命科学学院,四川 成都 610101)
【研究意义】青藏高原拥有欧亚大陆最大的草地,牧草品质优良,是我国最重要的放牧基地之一[1]。高寒草甸是青藏高原最重要的草地类型,占草地总面积的66%以上[2]。近几十年来,气候变化[3]、冻土退化[4]、鼠害[5]、过度放牧[6]和资源过度开发[7]等诸多不利因素综合作用,导致青藏高原高寒草甸严重退化,放牧生态系统可持续发展遭受严重威胁。杂草入侵是对草场质量最直接的威胁,同时也是多种不利因素导致草地退化的具体体现。【前人研究进展】冉启凡[8]研究表明,瑞香狼毒(Stellerachamaejasme)的入侵使高寒草甸生态系统碳贮量显著增加;马建国等[9]发现,甘肃棘豆(Oxytropiskansuensis)、瑞香狼毒、披针叶黄华(Thermopsislanceolata)等高原有毒植物的入侵使土壤全碳、全氮和微生物生物量碳含量显著增加,对多种细菌丰度有显著影响,严重威胁了植物群落的多样性和生产力。因此,遏制杂草入侵就成为了治理草地退化的重要一环。【本研究切入点】杂草入侵通常会影响生态系统的各个方面,而最主要变化通常发生在土壤中[10]。土壤为植物生长发育提供了所需的营养元素[11],根际是土壤-植物-微生物三者相互作用的微环境,根际微生物是植物与土壤、植物与植物之间的重要连接部分,对土壤中复杂成分的分解、小分子的形成、植物营养吸收[12]、抗逆性[13]等均具有重要作用。在某一特定环境中,植物通过根际分泌物影响土壤微生物群落多样性,而微生物群落又会反过来影响土壤酶活性、土壤养分以及土壤肥力[14-15],从而制约了植物群落的种类组成和多样性[11]。在青藏高原的高寒草甸中,优势物种根际土壤的表征与其适应高寒脆弱生境、对养分的有效吸收效率和对土壤养分的转化等方面直接相关[16],马源等[17]研究表明,退化高寒草甸的优势物种根际存在着有效养分富集和微生物活化的现象,从而调控了根际的养分循环。密花香薷(ElsholtziadensaBenth.)为唇形科(Labiatae)香薷属(Elsholtzia)一年生芳香草本植物,具有结实率高、土壤中宿存种子多、萌发早、密度大、生长快等特点[18],在高寒草甸中具有显著的竞争优势,也是青藏高原农田生态系统危害较为严重的恶性杂草[19]。然而,目前对密花香薷是如何通过改变土壤环境在入侵中取得竞争优势知之甚少。因此,提出假设:密花香薷能够通过调节其根际微生物种类组成和群落结构以改变土壤营养状况,使自身更加适应高寒草甸脆弱生境从而获得种间竞争优势。【拟解决的关键问题】为了验证这一假设,本研究应用16S rDNA 的V3~V4 区片段高通量测序技术与土壤化学分析法,分析了四川省阿坝藏族羌族自治州红原县阿西乡高寒草甸的密花香薷根际土和非根际土的细菌多样性、土壤成分和土壤酶活性的差异,旨在探讨密花香薷在高寒草甸植物群落形成竞争优势的原因,为高寒草甸退化治理提供理论依据。
1 材料与方法
1.1 样地设置及样品采集
1.1.1 样地设置 研究区位于四川省阿坝藏族羌族自治州红原县阿西乡(102°55.944′ E, 33°41.023′ N)高寒草甸,海拔3470 m。该区属高原寒温带湿润季风气候,年平均气温-3 ℃;年降水量648.5 mm,年降雨量656.8 mm,年均相对湿度69%;常年无夏,无绝对无霜期。2019年7月,在研究区1块50 m×50 m的平坦草甸上,选择对照斑块(无密花香薷生长)和密花香薷侵入斑块采集植被数据和土壤样品。
1.1.2 植物种类调查和生物量的测定 分别在对照斑块和密花香薷侵入斑块中随机设置1 m×1 m的样方3个,记录每个样方中的植物组成后,将植物地上部分齐地表剪掉,80 ℃烘干至恒重,测定生物量。
1.1.3 根际土和非根际土的采集 将密花香薷植株从土壤中挖出,轻轻抖去与根系结合疏松的土壤,采用抖落法[20]采集根际土壤,共取得30个植株的根际土;非根际土的取样方法是在每株密花香薷0.5~2.0 m范围内的4个方向各随机取1个样,取样深度0~20 cm;捡出非根际土和根际土中的杂物,分别混匀后,按照四分法分装到无菌自封塑料袋中带回实验室,一部分自然晾干,以测定酶活和养分;另一部分过筛除去杂物后分别置于4和-80 ℃冰箱备用,以测定微生物多样性。
1.2 土壤养分测定
有机质(soil organic matter, SOM)、全磷(total phosphorus, TP)和速效磷(available phosphorus, AP)均运用SpectraMax M2酶标仪(Molecular Devices,美国)采用比色法进行测定。其中,有机质含量测定参考辜忠春[21]及GB 7857-87国家标准[22]稍加改进,采用重铬酸钾容量法在585 nm波长下测定吸光值;全磷和速效磷的含量测定采用氢氧化钠碱熔-钼锑抗比色法(GB7852-87)[23]稍加改进,分别在700和882 nm波长下测定吸光值。
全钾和速效钾的测定均使用Z-2000赛曼原子吸收分光光度计测定。全钾(total potassium, TK)的测定参考国家标准[24]稍作修改,速效钾(Availablepotassium, AK)的测定采用乙酸铵浸提-火焰光度计法(GB 7856-87)。
全氮(total nitrogen, TN)和速效氮(Available nitrogen, AN)的含量测定分别参考黎冬容[25]和郑福丽等[26]的方法,用全自动凯氏定氮仪(FOSS,KJELTECTM 2300)测定。
1.3 土壤酶活性测定
脲酶、蔗糖酶和纤维素酶的活性测定参考关松荫[27]的方法略有改进,脲酶采用苯酚钠比色法,以24 h后100 g土壤中NH3-N的毫克数表示;蔗糖酶和纤维素酶均采用3,5-二硝基水杨酸比色法,蔗糖酶以24 h后1 g干土中葡萄糖的毫克数表示,纤维素酶以24 h后1 g干土中葡萄糖的微克数表示;酸性磷酸酶活性使用索莱宝土壤酸性磷酸酶(S-ACP)活性检测试剂盒测定,以37 ℃下每克土壤每天释放1 nmol酚为一个酶活单位;多酚氧化酶活性测定参考郑洪元[28]的邻苯三酚比色法测定,以每小时100 g干土中生成紫色没食子素毫克数表示。每处理重复3次,并设无基质对照和无土对照。以上吸光值的测定均使用SpectraMax M2酶标仪(Molecular Devices,美国)测定。
1.4 细菌宏基因组测定
采用DNA 抽提试剂盒[DNeasyPowerSoil Kit(100)]提取土样样品的基因组DNA,利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,使用无菌水稀释样品至1 ng/μl。以稀释后的基因组DNA 为模板,使用带Barcode 的特异引物,Takara Ex Taq 高保真酶(Takara 公司,日本)对细菌16S DNA 的V3~V4 区域进行PCR 扩增。引物序列为前端引物343 F(5′- TACGGRAGGCAGCAG -3′)和后端引物798 R(5′- AGGGTATCTAATCCT-3′);电泳检测PCR 产物后,经磁珠纯化作为模板进行二轮PCR 扩增,对第二轮PCR 产物再次电泳检测并用磁珠纯化后进行Qubit 定量。根据PCR 产物浓度进行等量混样,并利用Illumina 平台Miseq高通量测序技术进行土壤细菌16S rDNA 高通量测序分析。
1.5 统计与分析
所有数据利用SPSS 20.0做单因素方差分析(one-way ANOVA)和多重比较。生物信息分析使用Vsearch(version 2.4.2) 软件,对质控得到的优质序列valid tags 按照97%的相似度进行OTU 分类,并选取每个OTU 中丰度最大的序列作为该OTU 的代表序列,以Chao1 指数(S)的大小来估计土壤微生物物种总数。
采用基于皮尔森相关系数的神经网络分析对群落参数、土壤特性和土壤细菌之间进行相关性分析,先通过SPSS 20.0对数据进行分析,再采用PPT对结果进行可视化处理。
2 结果与分析
2.1 密花香薷对植物群落组成和多样性的影响
密花香薷侵入对高寒草甸的群落覆盖度和植物多样性影响不大(表1),但导致群落生物量显著下降;在密花香薷侵入斑块中,无豆科植物生长,由此推测,密花香薷对豆科植物具有一定排斥效应。

表1 密花香薷侵入对青藏高原高寒草甸群落特征和植物多样性的影响(平均值±标准差, n=3)Table 1 Effects of Elsholtzia densa Benth. on alpine meadow community biomass and plant diversityin Qinghai-Tibet Plateau(mean±SD, n=3)
2.2 密花香薷根际与非根际土壤养分状况的差异
整体来看,密花香薷根际土营养状况优于非根际土壤(表2)。与非根际土相比,密花香薷根际土中速效磷、全钾、全氮、速效氮呈极显著增高(P≤0.01),有机质和全磷有显著增高(P≤0.05),速效钾呈极显著降低(P≤0.05)。其中,涨幅最大的是速效磷,为非根际土的6.88倍,其次是总氮(2.36倍)、有机质(1.66倍)和速效氮(1.48倍)。
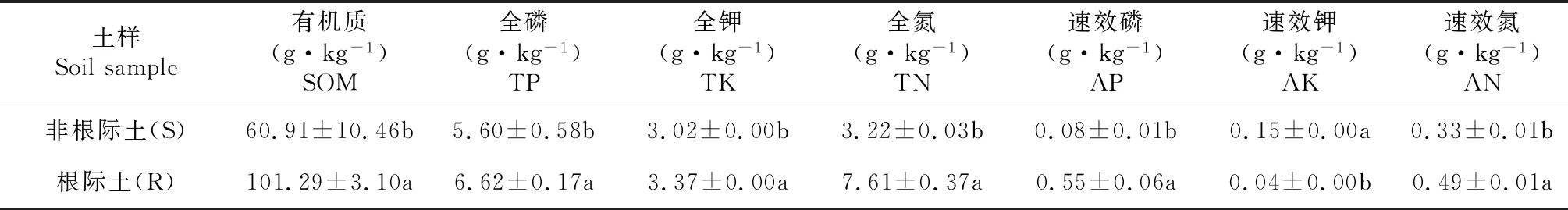
表2 青藏高原高寒草甸密花香薷根际土和非根际土的养分特征(平均值±标准差,n=3)Table 2 Nutrient characteristic of rhizosphere soil and non-rhizosphere soil of E.densa Benth. in Alpine meadow in Qinghai-Tibet Plateau (mean ± SD, n = 3)
2.3 密花香薷根际与非根际土壤酶活性差异
从表3可见,与非根际土相比,密花香薷根际土壤酶活性整体升高。其中以脲酶、纤维素酶和多酚氧化酶的变化最为明显,达到极显著水平(P≤0.01),其次是蔗糖酶活性,达到显著水平(P≤0.05),而酸性磷酸酶活性无显著差异。

表3 青藏高原高寒草甸密花香薷根际土和非根际土的土壤酶活性(平均值±标准差,n=3)Table 3 Soil enzyme activities in rhizosphere soil and non-rhizosphere soil of Elsholtzia densa Benth. in alpine meadow in Qinghai-Tibet Plateau (mean±SD, n=3)
2.4 密花香薷根际土与非根际土细菌群落的差异
Alpha 多样性反映了生物环境内物种的多样性程度。Simpson 指数越高表明群落物种数量分布越不均匀,优势种的地位越突出;Chao1 指数越高,表明细菌群丰度越高;Shannon-Winner 指数代表物种丰富度和物种均匀度[29]。非根际土和根际土的OTU 数目分别为2114和2242(表4),两个样本的测序深度分别为96.79 %和96.32 %,理论上测序数据基本已覆盖样本中的全部序列。对两个样本中的OTU 多样性分析发现,二者的平均Shannon-Winner 指数均大于9。与非根际土相比,根际土中OTU 的Shannon-Winner 指数和Chao1 指数较高,而Simpson 指数无显著变化。

表4 青藏高原高寒草甸密花香薷根际土和非根际土细菌 Alpha 多样性Table 4 Alpha diversity of bacteria of rhizosphere soil and non-rhizosphere soil of Elsholtzia densa Benth. in alpine meadows in Qinghai-Tibet Plateau
宏基因组分析共检测出细菌33门,非根际土和根际土分别为27个菌门和30个菌门,未能定义的菌门占0.23 %~0.25 %(图1)。非根际土中,放线菌门(Actinobacteria)是优势类群,所占比例为50.68 %,其次为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes),六类菌门共占比例达到97.25 %;与非根际土相比,根际土壤细菌群落结构发生变化,所占比例最高的是变形菌门(44.98 %),其次为放线菌门、拟杆菌门、厚壁菌门、芽单胞菌门、酸杆菌门和硝化螺旋菌门,七类菌门共占比例达到了99.06 %。
2.5 植物群落、土壤细菌群落与土壤特性之间的相关性分析
从图2可见,群落总盖度、土壤酸性磷酸酶与其余参数之间无显著相关性(P>0.05)。高寒草甸的群落生物量和物种多样性与土壤特性的变化密切相关。其中,生物量、物种丰富度、Shannon-Winner指数和Pielou-J 指数与土壤酶活性呈现负相关,Simpson指数则与土壤酶活性呈正相关(蔗糖酶除外);除有机质含量外,土壤成分均与Simpson指数密切相关,其中,速效钾与Simpson指数呈显著负相关,其余土壤成分均与其呈显著正相关;群落的生物量、物种丰富度、Shannon-Winner指数和Pielou-J 指数与速效钾呈显著正相关,而与全磷、全钾、全氮、速效磷、速效氮的含量显著的负相关。
土壤细菌种类和多样性的变化与土壤酶活性和土壤养分含量的变化密切相关。其中,土壤脲酶、蔗糖酶、纤维素酶和多酚氧化酶的活性与变形菌门、拟杆菌门和绿弯菌门与呈正相关,而与硝化螺旋菌门、梭杆菌门、肠杆菌门、迷踪菌门、软壁菌门、Latescibacteria、Dependentiae、放线菌门和厚壁菌门呈显著负相关;土壤有机质、全磷、速效磷、全氮、速效氮和全钾均与变形菌门、拟杆菌门和绿弯菌门呈显著正相关,而与硝化螺旋菌门、梭杆菌门、肠杆菌门、迷踪菌门、软壁菌门、Latescibacteria、Dependentiae、放线菌门和厚壁菌门呈显著负相关;速效钾与细菌种类的相关性与其他土壤成分相反;土壤细菌群落的Chao1 指数、Shannon-Winner指数和Observed species与脲酶、蔗糖酶、纤维素酶和多酚氧化酶呈显著正相关,与有机质、全磷、速效磷、全氮、速效氮和全钾等土壤成分含量呈显著正相关,而与速效钾呈显著负相关。
3 讨 论
植物-微生物-土壤的相互作用是植物群落演替、成功入侵、生物多样性格局和生态系统功能的关键所在[30]。土壤酶主要来源于土壤微生物的活动、植物根系分泌物和动植物残体腐解过程中释放的酶,在土壤物质循环和能量转化过程中起着重要作用[31]。其中,氧化还原酶有利于能量流动、土壤腐殖质组分的合成及土壤的形成过程,而水解酶则将大分子物质水解为易被植物吸收的小分子物质,有利于土壤中的C、N循环[32];同样,土壤微生物群落也是养分循环和能量转化的主要驱动力[33]。植物活根能分泌胞外酶并刺激土壤微生物活动[32],通过养分吸收和释放根系分泌物来调节土壤养分含量的分布[17]。在本研究中,与非根际土相比,密花香薷根际土的蔗糖酶、纤维素酶、脲酶等水解酶活性以及氧化还原酶中的多酚氧化酶活性明显增高。同时,根际土的细菌群落结构发生改变,细菌物种丰度和多样性明显增高。表明密花香薷的活根可能通过其分泌物吸引并刺激微生物活动,并向土壤中分泌胞外酶,二者叠加使土壤酶活性升高,加速土壤中大分子物质向小分子物质转化,促进了土壤的物质转化和能量转化,导致土壤养分在其根际富集,研究结果证实,除了速效钾明显低于非根际土外,密花香薷根际土的有机质、全磷、全钾、全氮、速效磷、速效氮的含量均显著高于非根际土,且与土壤酶活性变化之间存在着显著的正相关关系,表明密花香薷可能具有富集土壤养分和土壤微生物的能力,马源等[17]的研究表明,祁连山东缘高寒草甸中,土壤养分和土壤微生物量在优势物种根际存在富集和活化的现象,这与本研究的结果相似。Baldwin等[34]发现,土壤含水量、植物物种以及分泌物种类等因素可能会通过影响土壤中非交换性钾的释放从而影响钾元素的变化。刘洪升等[35]的研究表明,植物根系从土壤不断吸收钾时,会在其根际形成一个钾的亏缺区,即根际区比非根际区土壤速效钾含量低。本研究结果中,密花香薷根际土的全钾显著高于非根际土,而速效钾却显著低于非根际土,推测其原因可能是退化高寒草甸水分亏缺或密花香薷根系分泌物土壤中非交换性钾的释放,密花香薷对钾的吸收能力较强,故在根际形成了速效钾的亏缺区,但这一推断尚待进一步评估密花香薷对钾的吸收能力后才能证实。
本研究结果表明,密花香薷根际土与非根际土的细菌群落结构具有一定的差异。在非根际土中占优势的放线菌门在根际土中地位下降,在细菌群落中所占比例由50.68 %下降到31.80 %,其优势地位由变形菌门取而代之。变形菌门能产生次生代谢物如抗生素抑制病原微生物的生长,与C、N、S 等元素的循环、难降解有机物的还原密切相关[36-37],参与生态系统中的磷富集过程[38]。放线菌和假单胞菌能分泌磷酸酶,降解土壤中的磷脂类和核酸类含磷化合物[39-40]。密花香薷根际土全磷和速效磷的含量显著高于非根际土,尤其是速效磷增幅最为明显(为非根际土的6.88倍),虽然根际土的酸性磷酸酶与非根际土差异不明显,但根际土中变形菌门所占比例相对非根际土大幅度升高,由21.92 %升至44.98 %,由此推测,密花香薷根系分泌物吸引对磷具有富集作用的微生物,使磷在根际富集,促进了土壤的物质转化和能量流动,有效改善了土壤养分状况,并增加了密花香薷抵御病原微生物的能力,从而促进了植株的生长发育,因此在种间竞争占据优势地位。
密花香薷改变了青藏高原高寒草甸的植物种类组成,在密花香薷侵入斑块中,豆科植物被排斥,群落总生物量显著下降。推测其原因可能与密花香薷对土壤养分的富集导致豆科植物养分不足有关,但这一推断尚待深入分析密花香薷扩张程度不同的植被斑块特征后才能确证。
4 结 论
密花香薷通过根系活动,吸引并刺激细菌活动而改变土壤细菌群落结构和多样性,导致土壤酶活性升高,土壤养分在其根际富集并活化,有效改善根际土壤营养状况,并借助土壤多酚氧化酶活性的升高增强自身抵抗病原微生物的能力,进而在种间竞争中取得优势地位。

