两种石蜡包埋肾活检组织转制电镜样品的方法比较
沈丽君,李铎,方周溪,陈朝生
1.温州医科大学 检验医学院 生命科学学院,浙江 温州 325035;2.温州医科大学附属第一医院 肾内科,浙江 温州 325015
电镜检查在肾脏病的诊断中起着十分重要,有20%~30%的肾脏病患者需要依赖电镜得以确诊[1-3]。 然而由于标本量不足或者取材不满意等原因,在常规电镜标本(组织经戊二醛和锇酸双重固定后,经脱水、树脂包埋等步骤制作的标本)不可用的情况下,需要用4%中性甲醛固定、石蜡包埋的组织转制电镜标本用于诊断。石蜡包埋标本转制电镜样品的方法有多种[4-6],需要在日常工作中根据所在实验室的实际情况(如标本类型、包埋剂种类、脱水剂种类等)选择合适的实验方案。目前各电镜室常用的方法是将石蜡标本脱蜡后再水化,后经戊二醛和锇酸双固定后,再脱水包埋成块。在结合多年的临床实验经验和文献报道[7]的基础上,我们改进了一种以EPON 812为包埋介质的适合肾穿刺活检标本石蜡块转制电镜样品的快速方法(以下简称快速脱蜡固定法),经与传统水化后再转制电镜样品的方法(以下简称水化法)对比研究,发现快速脱蜡固定法能够得到比水化法更高质量的电镜图像,同时有效缩短样品制备时间,现报告如下。
1 材料和方法
1.1 材料
1.1.1 组织标本:选取2018年5月至2019年9月温州医科大学附属第一医院肾内科确诊的石蜡包埋块标本共20例,其中IgA肾病6例、冷球蛋白血症肾小球肾炎1例、狼疮性肾炎5例、糖尿病肾病5例和肾淀粉样变性病3例,所有患者均经肾脏穿刺病理诊断确诊。本研究经温州医科大学附属第一医院伦理委员会审批通过。
1.1.2 试剂配置:①含1%四氧化锇的二甲苯溶液配置:1 g四氧化锇(OSO4,TED PELLA,18456)溶于100 mL二甲苯溶液中;②包埋剂配置:选取PELCO®Eponate12试剂盒(TED PELLA,18010),参考Luft法的配方比例[8],分别量取Resin 25.7 mL、DDSA 9.3 mL、MNA 16.5 mL,充分混匀后,加入0.8 mL DMP-30并再次混匀;③2%醋酸铀水溶液配置:1 g醋酸铀粉末溶于50 mL双蒸水;④1%枸橼酸铅水溶液配置:0.1 g枸橼酸铅粉末(TED PELLA,96049)溶于5 mL双蒸水,充分混匀后,滴加1 mol/L NaOH溶液至颗粒全部溶解且p H值约为12,加双蒸水定容至10 m L,并用0.22 μm微孔滤器过滤,密封备用;⑤硅胶定向包埋板(北京中镜科仪技术有限公司);⑥被覆芳华膜的200目铜载网(北京中镜科仪技术有限公司)。
1.2 方法
1.2.1 石蜡标本取材方法:经4%中性甲醛固定、石蜡包埋的肾穿刺标本块在体视显微镜下,对照HE染色结果,在蜡块上肾小球相应位置用剃须刀片小心切下两段1 mm长组织块(见图1)。一段用改进的快速脱蜡固定法处理,另一段采用经脱蜡-水化法处理后再转制电镜样品[9],并将两种转制方法所得的结果与同一样品的常规电镜的结果进行比较。
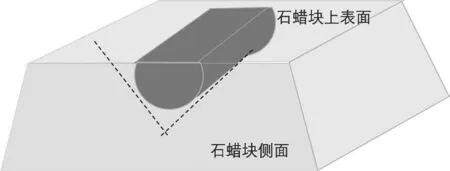
图1 肾穿组织石蜡包埋标本组织取材示意图
1.2.2 常规电镜[10-11]步骤:1~2 mm长新鲜组织置于含2.5%戊二醛的0.1 mol/L等渗PB缓冲溶液中,4 ℃固定4 h以上。用0.1 mol/L PB缓冲液漂洗3次,并用1% OsO4水溶液4 ℃后固定1 h,随后用蒸馏水漂洗3次,每次5 min,紧接着用50%、70%、80%、90%、100%(2次)丙酮对组织块进行梯度脱水,每步 10 min。随后将组织转至丙酮:包埋剂(体积比为1:1)的溶液中37 ℃过渡1 h,接着用丙酮:包埋剂(体积比为1:4)的溶液37 ℃过夜渗透。次日,用纯包埋剂浸泡组织,放置45 ℃恒温干燥箱1h,使包埋剂充分渗透入组织内部。并用硅胶定向包埋板进行定向包埋,包埋操作完成后置于45 ℃恒温干燥箱3 h,后转入65 ℃干燥箱过夜聚合。待样品充分聚合后,对组织块进行半薄切片,直至样品中切到肾小球组织,随后对该样品进行修块,对肾小球部位进行超薄切片,超薄切片厚度为70 nm,用被覆芳华膜的200目铜网捞片。超薄切片经2%醋酸铀和1%枸橼酸铅双染色后,用日立H7500透射电镜进行观察,并用GATAN公司的数字化CCD成像设备对数据进行拍照采集。
1.2.3 快速脱蜡固定法:将所取的石蜡组织块置于50 μL 1%四氧化锇二甲苯溶液中,65 ℃恒温干燥箱放置10 min;随后,用牙签将组织块挑至100 μL 纯二甲苯中,37 ℃恒温干燥箱放置15 min,并重复此纯二甲苯脱蜡步骤3次,进一步充分脱蜡。将充分脱蜡后的组织用牙签挑至二甲苯:包埋剂比例为1:1的过渡液中,37 ℃恒温干燥箱放置1 h。随后转至纯包埋剂中,45 ℃恒温干燥箱放置1 h。并用硅胶定向包埋板进行定向包埋,包埋操作完成后置于45 ℃恒温干燥箱3 h,后转65 ℃干燥箱过夜聚合。自样品取材至包埋完成,共耗时18 h。待样品充分聚合后,同常规电镜标本一样,对样品进行切片、染色、观察和图像数据采集。
1.2.4 水化法:将所取石蜡组织块放入500 μL二甲苯中,60 ℃恒温干燥箱放置30 min,并重复该操作1次。随后将组织块置于新的100 μL二甲苯溶液 中,37 ℃恒温干燥箱放置15 min,并重复该操作4次。将脱蜡处理完成后的组织置于500 μL二甲苯:乙醇(比例为1:1)溶液中,37 ℃恒温干燥箱中放置5 min。随即分别用100%、95%、80%、70%、50%、30%乙醇依次进行梯度水化,每步水化时间各5 min。
水化完成后,将组织块置于0.1 mol/L PB缓冲液中,室温放置10 min,随后换新的0.1 mol/L PB缓冲液,并重复这一操作3次,将乙醇充分漂洗干净,并用含2.5%戊二醛的0.1 mol/L PB缓冲液固定组织4 h以上。戊二醛固定后的标本,后续操作流程同常规电镜操作。
1.3 图像处理与评价指标 本研究所用的电镜数字成像设备为ORIUSTMCCD camera(美国Gatan公司),图像处理软件为ImageJ 1.52。每一例标本用不同制样方法所得的图像数据间进行横向比较,主要从以下三方面进行对比:①肉眼判断电子致密沉积物(electron-dense deposits,ED)结构清晰度以及沉积部位;②比较特征性超微结构保存的完整性,如狼疮性肾炎患者肾小球毛细血管内皮细胞基质中的管网状包涵体(tubuloreticular inclusions,Ti)和淀粉样变肾病患者系膜基质上的纤维丝;③用ImageJ测量基底膜平均厚度,并统计分析不同石蜡转制电镜样品方法基底膜厚度的改变情况。每例患者常规电镜所得标本的基底膜平均厚度与同一患者石蜡转制标本的平均基底膜厚度的差值,除以该患者常规电镜基底膜平均厚度用以反映石蜡转制电镜样品后平均基底膜厚度的改变情况。
基底膜平均厚度测量方法:每个样品的肾小球部位随机选取15~20个毛细血管,每个毛细血管随机选5个位置(应均匀分布在毛细血管上,并避开ED的位置)测量基底膜厚度,并取其平均值作为被测毛细血管的平均基底膜厚度。将15~20个毛细血管测量的平均值作为该样本的基底膜平均厚度。
1.4 统计学处理方法 采用SPSS20.0软件进行统计学分析。计量资料以M(P25,P75)表示。由于2种石蜡转制法组内均有个别数据缺失(仅见肾髓质组织),同时考虑数据略有偏态,因此对3组相关数据采用Friedman秩和检验进行分析。针对组间多项两两比较,SPSS软件通过Bonferroni校正法调整显著性值。P<0.05为差异有统计学意义。
2 结果
2.1 两种石蜡转制方法保存肾小球特征超微结构的比较 几种常见肾脏病类型的超微结构显示,快速脱蜡固定法和水化法对组织超微结构的保存远不如TEM组,表现在部分血管内皮细胞的胞质成分丢失以及足突形态改变,但在ED的保存方面,两种石蜡转制方法与常规电镜法相差不大(见图2A)。此外,为了更好地评价这两种石蜡转制电镜样品方法在临床上的应用价值,我们比较了两种转制方法在特殊超微结构保存方面与常规电镜法的差异,结果显示这两种方法在Ti的结构保存方面稍显欠缺(见图2B);此外水化法处理的样品淀粉样纤维丝结构有不同程度的流失,快速脱蜡固定法对纤维丝的保存效果更接近常规电镜法的效果(见图2C)。由于肾小球毛细血管基底膜厚度及形态的改变是某些种类肾病的诊断依据,如薄基底膜肾病,但在实际应用中我们发现石蜡转制电镜的标本都出现了不同程度的基底膜厚度变薄的情况(见图2D)。
2.2 两种石蜡转制方法对基底膜厚度的影响比较 测量每个样品的平均基底膜厚度,用Friedman检验对3组数据进行比较,3组间差异有统计学意义 (P<0.001);快速脱蜡固定法和水化法与常规电镜法比,基底膜厚度均显著减少(P=0.043和P<0.001);快速脱蜡固定法与水化法比,基底膜厚度差异无统计学意义(P=0.210)。见表1。
3 讨论
肾活检病理诊断过程中,电镜诊断是非常重要的一个环节,但是有时由于取材失误、标本不满意(未取到肾小球结构)等原因,需要用4%中性甲醛固定-石蜡包埋的标本转制电镜样品[12-13]。本研究中,我们提出了一种经过改进的以EPON 812为包埋介质的快速转制方法,并通过比较研究,以评价该方法在常规电镜标本缺失的情况下在肾脏病临床诊断应用中的价值。
由于电子致密沉积物在肾脏病理诊断中具有非常重要的作用,因此我们首先对比了两种转制法在保存ED结构方面的差异。与常规电镜相比,两种石蜡转制方法均能使ED结构得以较好保存,说明两种转制方法在临床诊断中均有使用价值。考虑到某些种类肾脏病的超微病理诊断除了辨别ED的沉积部位和形态外,还需要借由一些特征性的超微结构加以确诊,例如,部分狼疮性肾炎患者的肾小球毛细血管内皮细胞基质上的管网状包涵体[12],淀粉样变肾病患者节段性系膜基质上直径8~10 nm的纤维丝等[13],因此,我们对狼疮性肾炎患者和淀粉样变肾病患者的上述特征性结构进行了对比。两种转制方法虽然能够保留上述两种特征性结构,但其结构完
整性破坏较大,尤其是水化法转制的标本,淀粉样纤维丝结构有所损失,其原因可能由于水化法处理步骤比较多,脱蜡、水化及脱水3个步骤均涉及到有机溶剂处理,对样品的成分抽提较快速脱蜡固定法更严重。不仅如此,从样品制备时间比较,水化法耗时更久(33 h),而本研究中的快速脱蜡固定法,由于直接在二甲苯中边脱蜡边固定,不需要水化及脱水步骤,大大节约了样品制备时间(18 h),在满足样品诊断需求的前提下,提高工作效率,缩短患者等待报告的时间。此外,通过统计分析发现两种转制方法均存在基底膜变薄的假象,提示这两种转制方法均不适用于需要通过测基底膜厚度进行诊断的肾病类型(如薄基底膜肾病、早期的糖尿病肾病等)[14-15]。
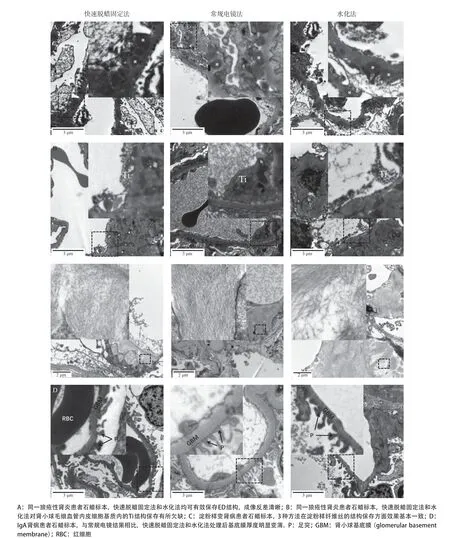
图2 两种石蜡标本转制电镜样品方法与常规电镜结果比较

表1 不同制样方法样品的基底膜厚度比较[每组n=11,M(P 25,P 75),nm]
综上所述,本研究比较了两种石蜡转制电镜样品的方法,其中快速脱蜡固定法无需经过逐级的水化、漂洗、后固定及脱水等繁琐的步骤,可有效缩短制样时间,且锇酸后固定与脱蜡同步进行,使得组织结构得到较好保存,减少人为操作对组织成分的洗脱、抽提作用。因此,在常规肾活检组织电镜标本无法满足检测的情况下,快速脱蜡固定法不失为一种更好的替代方法。

