基于单细胞转录组测序技术的膀胱癌区域免疫特性的研究*
曾燕玉,包梦颖,代 艳,黄 荣,毛星宁,王逸夫,郭冰倩,颜赟坤,张庆云.5,莫曾南△
(1.广西医科大学基因组与个体化医学研究中心,南宁 530021;2.广西生物医药协同创新中心(广西-东盟重大疾病防治协同创新中心),南宁 530021;3.广西基因组与个体化医学研究重点实验室,南宁 530021;4.广西基因组与个体化医学研究协同创新中心,南宁 530021;5.广西医科大学附属肿瘤医院,南宁 530021)
膀胱癌(bladder cancer,BC)是常见的恶性泌尿系统肿瘤,2018 年全球新发病例约549000 例[1]。近年来肿瘤免疫检查点抑制剂的研究进展迅速,为BC 的治疗开启了新的篇章[2]。肿瘤免疫疗法面临的一大挑战是对组织特异性肿瘤免疫应答理解不足,不同解剖部位的免疫环境可能对抗肿瘤免疫效果产生影响[3]。阐明肿瘤免疫微环境组分对提高免疫治疗效果至关重要,目前对BC 及膀胱组织的免疫概况尚缺乏深入的研究。
流式细胞术、免疫组化和免疫荧光等方式常被用于研究免疫细胞,但这些手段往往需要提前设置或挑选已知的标记物组合,导致一些新的细胞类型无法被检出。传统的高通量测序实验获取的数据代表细胞样本整体的特征,忽略了细胞间的差异。单细胞转录组测序(scRNA-seq)技术能够从单个细胞的转录组水平阐释细胞的异质性,为理解肿瘤微环境提供全新的视角,Azizi 等[4]用scRNA-seq 绘制了乳腺癌免疫图谱。本研究采用scRNA-seq 对BC及其配对非恶性组织中的浸润免疫细胞进行分群,比较免疫细胞组成的差异,为研究BC 区域免疫特性提供新的方案。
1 材料与方法
1.1 一般资料
收取2019 年11 月在广西医科大学附属肿瘤医院接受根治性膀胱切除术组织1 例,包括膀胱癌组织(tumor)和非恶性膀胱组织。病例纳入标准:(1)术前影像学或活检病理提示尿路上皮癌;(2)术后病理诊断为BC。排除标准:(1)存在明显感染病灶;(2)患有自身免疫性疾病;(3)两周内曾接受膀胱化疗药物灌注治疗。本研究中患者为男性,术后诊断为原发肌层浸润性BCT3aN0M0期。患者术前未经介入、放疗和化疗等非手术治疗。本研究经广西医科大学医学伦理委员会批准,患者及其家属术前均签署知情同意书。
1.2 试剂
HBSS 和DPBS 均购自WISENT 公司;I 型胶原酶、Ⅱ型胶原酶、胎牛血清(FBS)、青霉素/链霉素双抗溶液和台盼蓝均购自Gibco 公司;DNAse Ⅰ购自Roche 公司;红细胞裂解液购自Biolegend 公司;单细胞油包水制备和转录组文库构建试剂盒(Chromium Single Cell 3’GEM,Library&Gel Bead Kit v3、Chromium Chip B Single Cell Kit 和Chromium i7 Multiplex Kit)均购自10X Genomics公司。
1.3 实验方法
1.3.1 单细胞悬液制备 取膀胱根治术中切除的膀胱癌组织和非恶性膀胱组织存放至预冷的缓冲液(含1%双抗试剂的HBSS溶液)中运输回实验室,用预冷的DPBS 清洗组织,用无菌手术剪刀将组织块剪碎,全程在冰上操作。将每种组织各分为2份,分别转移至含Ⅰ型胶原酶的消化液和含Ⅱ型胶原酶的消化液中,在37 ℃水浴锅中摇匀消化40 min。加入预冷的DPBS 终止消化,用100 μm 的细胞筛进行过滤得到细胞悬液,300 g 离心5 min,弃去上清,加入含1%FBS的DPBS清洗细胞,300 g离心5 min,弃去上清。加入适量的红细胞裂解液冰上裂解5 min,加入含1%FBS的DPBS后使用40 μm的细胞筛进行过滤,300 g离心5 min,离心均在4 ℃条件下进行。使用含1%FBS的DPBS清洗细胞,弃去上清后重悬细胞,取细胞悬液与台盼蓝等比例混合染色,镜检计数,活率>80%的细胞悬液用于后续实验。
1.3.2 油包水制备及文库构建 组装好芯片与底座,配置样本混合液,依次将75 μL 样本混合液,40 μL 震荡30 s 后的Gel beads 和280 μL patitioning oil加至芯片上对应的孔,封上垫片,放入10X Chromiun Chromium Controller仪器大约8.5 min,用移液枪转移100μL制备好的油包水立刻进行逆转录。按照Chromium Single Cell 3ʹReagent Kits v3 用户指南进行后续的cDNA纯化扩增及文库构建。
1.3.3 测序 构建好的文库经过安捷伦2100 质检合格后在Illumina NovaSeq S6000 测序仪上进行测序。
1.4 scRNA-seq数据分析
1.4.1 数据预处理和质控 使用10X Genomics 公司提供的Cell Ranger(3.0.2)软件将原始数据拆分为FASTQ 文件,进行序列拼接,对比到人参考基因组(GRCh38),得到基因表达矩阵。在R 3.5.2(https://www.r-project.org/,2021-04-13)中读取基因表达矩阵,安装R 包Seurat 3.1.1(https://satijalab.org/seurat/,2020-03-10)用于后续分析。对样本分别进行质控,即过滤低丰度基因和低质量细胞。
1.4.2 数据整合和降维聚类 将质控后的数据使用NormalizeData 函数进行标准化,使用FindVariableFeatures 函数选择高变基因。使用FindIntegrationAnchors和IntegrateData函数进行数据整合并消除批次效应,使用ScaleData函数将合并后的数据归一化。数据进一步进行主成分分析(PCA,线性降维),使用FindClusters 函数对细胞进行无偏倚聚类并采用UMAP的方式可视化降维。
1.4.3 细胞注释 使用FindAllMarker 函数找出每个细胞簇相对其余细胞簇差异表达显著的基因,根据细胞簇的基因表达情况,结合参考已发表的10X单细胞转录组测序文献与相关细胞亚群的研究综述对细胞类群进行注释。
1.4.4 差异基因分析 使用FindMarkers函数分析不同组织来源的同个细胞亚群的差异表达基因,使用R包ggplot2绘制火山图,使用GEPIA 2(http://gepia2.cancer-pku.cn/,2021-04-13)在线工具进行差异基因的生存分析。
2 结果
2.1 单细胞转录组测序技术分析BC区域免疫特性的流程
为了描绘BC 区域免疫特性,本研究使用机械联合酶解的方式对组织进行解离,并通过单细胞转录组测序技术对其细胞组分进行检测,见图1;利用单细胞分辨率下的转录组信息解析BC免疫细胞的种类与特征。
2.2 基本测序结果
将膀胱癌组织和非恶性膀胱组织样本分别进行质控,先计算样本中细胞的基因数(nFeature)、转录本数(nCount)、线粒体基因比例(percent.mt)和血红蛋白基因比例(percent.HB),见图2A、图2B;再结合计算结果与组织样本特性设置过滤条件。本研究设置过滤低丰度基因(在少于3 个细胞中表达的基因)和低质量细胞(基因数≤200或者≥5000、线粒体基因比例≥10%和血红蛋白基因比例≥5%的细胞)。将质控后的数据标准化后选择2000个高变基因,进行2个样本的整合并消除批次效应,最终共获得11459个细胞的转录组信息,其中6559 个细胞来源于膀胱癌组织,4900个细胞来源于非恶性膀胱组织。通过无偏倚聚类和UMAP 可视化降维后共分成22个细胞簇,见图2C;热图展示每个细胞簇差异表达显著的基因,见图2D。
2.3 注释免疫细胞与非免疫细胞
本研究共检测出10簇非免疫细胞,11簇免疫细胞和1 簇未定义的混杂细胞(第21 簇)。PTPRC基因编码的CD45蛋白(白细胞共同抗原)在免疫细胞的成熟与分化中起重要作用[5-6],第2、第3、第4、第5、第7、第8、第11、第12、第14、第15、第19 和第21簇细胞表达PTPRC,其中第8 簇细胞仅有少部分细胞表达PTPRC且表达量很低,见图3A、图3B。参考已报道的scRNA-seq研究[7]定义非免疫细胞簇,同时满足以下2个条件:不表达或低表达PTPRC;高表达特定细胞的标记基因。定义出非免疫细胞包括成纤维细胞(fibroblasts)、内皮细胞(endothelial cells)、周细胞(pericytes)和上皮细胞(epithelial cells),见表1 和图3C。免疫细胞包括T 细胞3 簇:CD4+T 细胞(CD4+T cells)、CD8+T细胞(CD8+T cells)和增殖性T 细胞(proliferating T cells);B 细胞2 簇:浆细胞(plasma cells)和B 细胞(B cells);单核-巨噬细胞4 簇:单核细胞(monocytes)、M2 样巨噬细胞(M2-like macrophages)、巨噬细胞(macrophages)和单核样细胞(monocyte-like cells);树突状细胞(dendritic cells);肥大细胞(mast cells)。见表2和图3D。
2.4 BC区域免疫特性
膀胱癌组织中含量最丰富的免疫细胞是CD4+T 细胞,其次是CD8+T 细胞,非恶性膀胱组织中含量最高的是M2 样巨噬细胞,其次是单核细胞。在膀胱癌组织中4 簇单核巨噬细胞占比均降低,而浆细胞明显在膀胱癌组织中富集,见图4A。通过对比UMAP 图中细胞簇的组织来源情况发现膀胱癌组织来源与非恶性膀胱组织来源的浆细胞分布的位置重合度不高,提示不同组织来源的浆细胞可能在基因表达上存在差异,见图4B。进一步差异基因分析显示膀胱癌组织中的浆细胞MT1X、G0S2、CCDC80、IGHG2和LYZ等基因表达量增高,IGHA2、IGLV-57、SELENOP、RNASE1和EGR1等基因表达量下调,见图4C。将表达量增高最显著的MT1X基因做生存分析,结果提示高表达MT1X的BC患者预后较差(LogrankP=0.0015),见图4D。

图1 单细胞转录组测序工作流程及数据分析
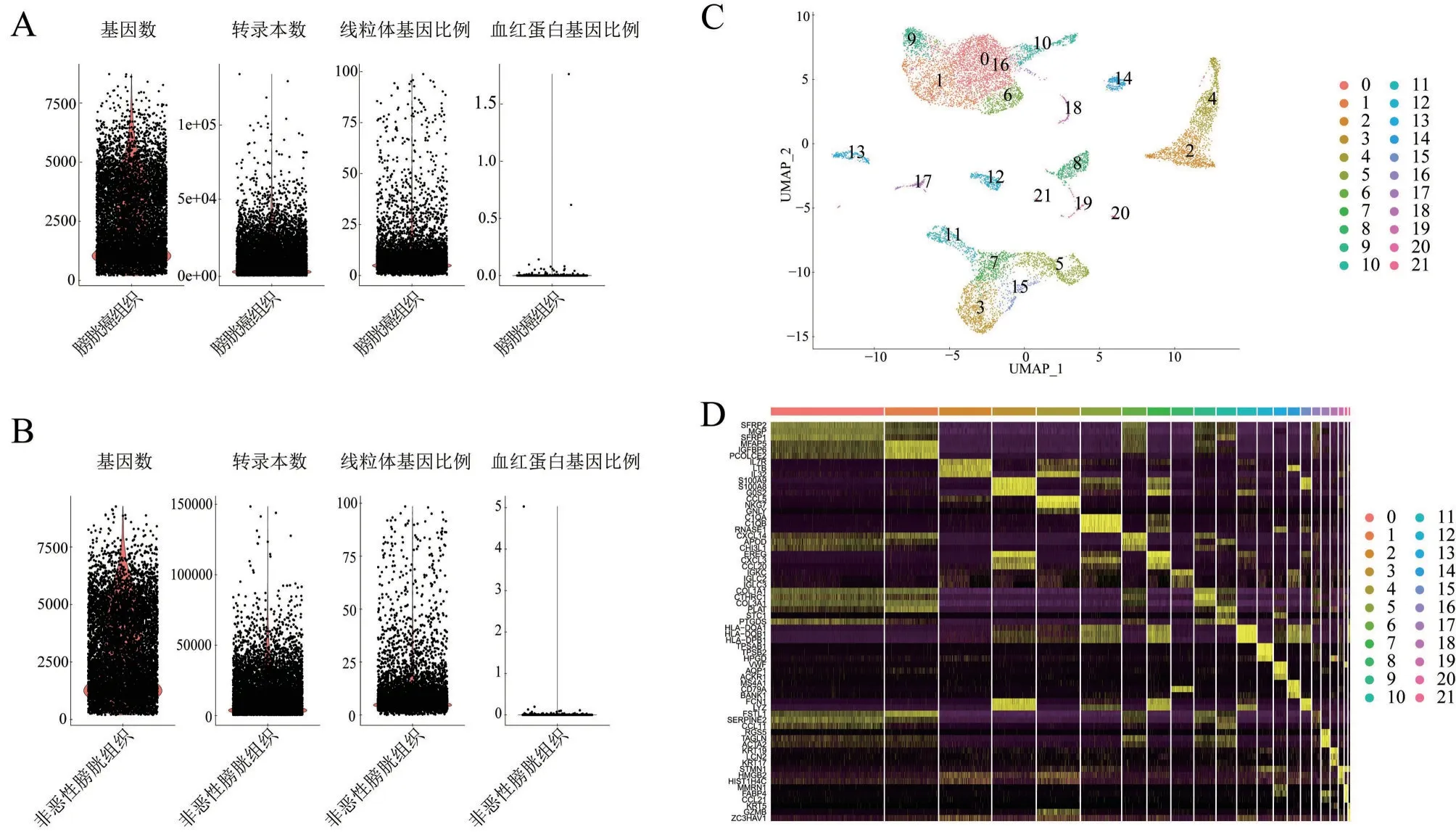
图2 单细胞测序质控及细胞聚类

图3 BC与非恶性膀胱组织中免疫细胞与非免疫细胞的注释

表1 非免疫细胞特征基因

表2 免疫细胞特征基因
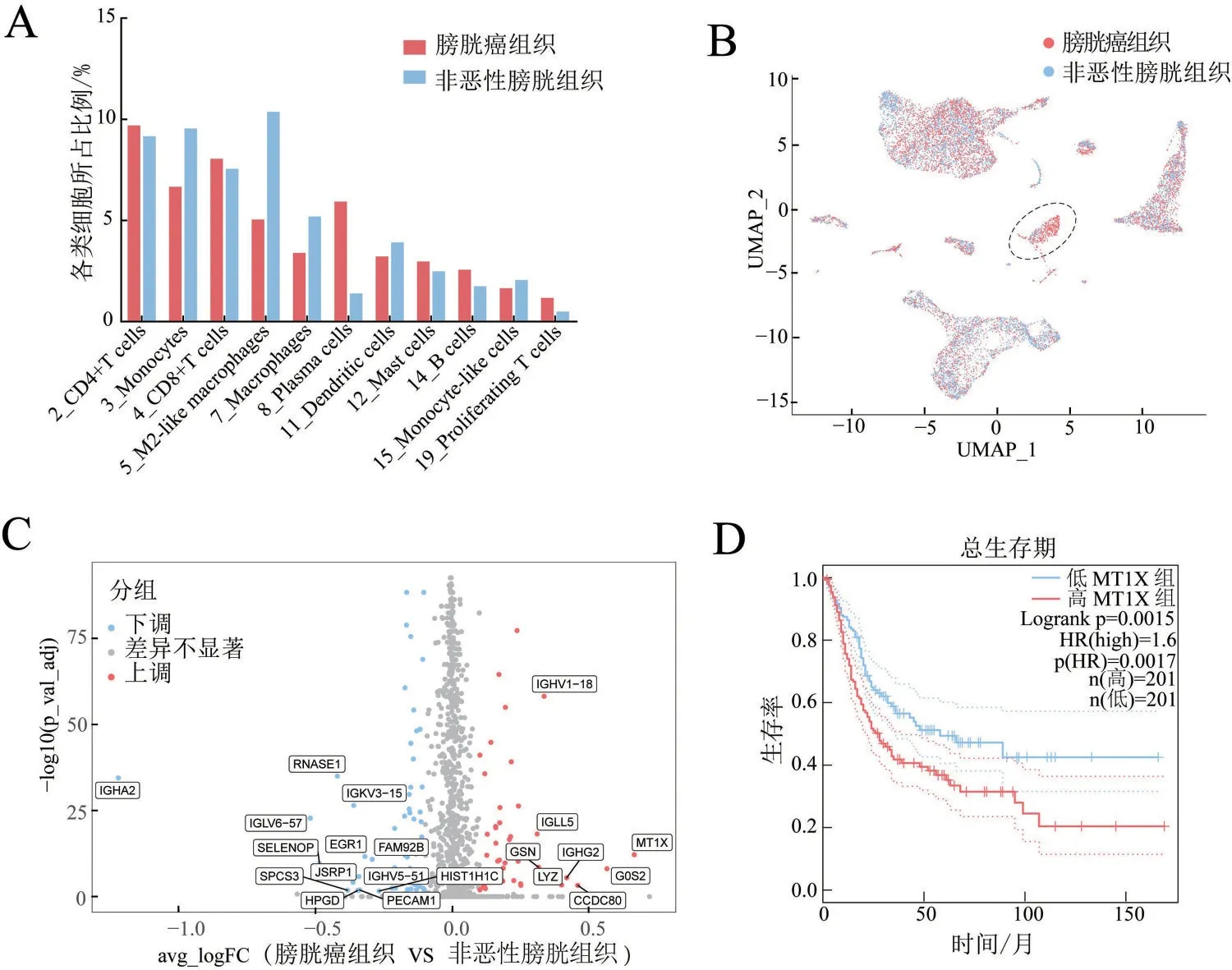
图4 膀胱癌组织与非恶性膀胱组织区域免疫特性
3 讨论
BC 是我国男性发病率居首位的泌尿系统肿瘤[23],治疗方式包括化疗、放疗及膀胱根治术等,患者的生活质量下降[24],免疫检查点抑制剂治疗成为一种新的治疗手段,多种药物已被批准用于BC 的治疗。肿瘤内免疫抑制的环境是影响免疫治疗效果的重要因素[25],对肿瘤微环境成分的探索将有助于更好地选择免疫治疗方案。单细胞转录组测序可以从单个细胞的维度对肿瘤微环境进行检测,辨析细胞的种类与状态,利于发现免疫治疗的靶细胞或筛选可能获益于免疫检查点抑制剂治疗的患者群体。
本研究对膀胱癌微环境中的细胞进行分析,检测出10 个非免疫细胞簇和11 个免疫细胞簇。PTPRC在免疫细胞簇中表达,在非免疫细胞簇中表达量极低或几乎不表达,但浆细胞簇中PTPRC表达量很低。在膀胱癌组织中的免疫细胞类型主要是T细胞,在非恶性膀胱组织中以单核-巨噬细胞为主。浆细胞在膀胱癌组织中富集,并且两种组织中浆细胞的基因表达显示出明显的差异,膀胱癌组织中的浆细胞MT1X表达上调。MT1X编码的金属硫蛋白与维持金属离子稳态有关,并在肿瘤生长、进展、转移和耐药性中发挥关键作用[26]。高表达MT1X的BC 患者预后不良,这些结果提示膀胱癌中的浆细胞可能影响膀胱癌的进展与预后。
综上所述,本研究利用单细胞转录组测序技术成功建立探究BC区域免疫特性的方法,PTPRC的表达情况可以作为scRNA-seq分析中辅助区分免疫细胞与非免疫细胞的参考依据。在正常情况下人体内浆细胞的成熟会伴随表面CD45 表达量的下降,病理情况下如多发性骨髓瘤患者体内会出现CD45阳性和CD45阴性2种浆细胞群[27]。相对以往使用流式细胞术分选出CD45阳性细胞作为免疫细胞群体进行的研究设计,以未经分选的单细胞悬液作为样本具有更高的概率检出CD45阴性或者弱阳性的免疫细胞群,为探究免疫组分提供了更全面的策略。
本研究存在一定的局限性:一、组织是较为复杂的环境,消化酶种类的选择可能一定程度上会造成获取的细胞亚群的偏倚;二、基于转录组信息得到的特征需要进行进一步验证;三、由于样本量的限制,细胞簇的分布特征与差异基因表达情况不具备统计学意义。

