软骨肿瘤异柠檬酸脱氢酶基因突变的研究进展
王睿峰 郭卫
(北京大学人民医院骨肿瘤科,北京 100044)
细胞的恶性转化是基因突变、表观遗传学改变、转录后异常等一系列事件所引起的复杂而多层次的过程。测序技术的飞速发展使肿瘤的遗传概貌得到更全面、更深刻的展现。原发性骨肿瘤大多存在驱动基因变异,根据高度频发或较为特异的驱动基因变异可以对其进行分子分型,从而更精准地指导临床诊疗。
肿瘤细胞在有氧条件下优先采用无氧糖酵解方式获取能量,这种反常的能量代谢方式被称为Warburg 效应。后续研究结果显示,在恶性转化过程中,代谢适应力改变是肿瘤细胞存活并迅速生长的重要条件之一。肿瘤细胞中延胡索酸水化酶(fumarate hydratase,FH)、琥珀酸脱氢酶(succinate dehydrogenase,SDHD)等代谢酶基因突变的发现进一步提示代谢改变可能在肿瘤的发生发展中起重要作用[1]。Sjöblom等[2]对结直肠肿瘤细胞进行体细胞测序时,第一次发现异柠檬酸脱氢酶-1(isocitrate dehydrogenase 1,IDH1)基因存在突变。此后,研究者陆续发现IDH基因在胶质瘤[3]、急性髓细胞白血病[4]中存在较高频率的突变。Amary等[5]首次报道56%的中心型和骨膜型软骨肿瘤中存在IDH1/IDH2变异,此后国内外对IDH突变与软骨肿瘤的发生、预后及治疗之间关系的研究逐渐增多。本文系统回顾软骨肿瘤IDH 基因突变的研究进展并进行综述。
1 IDH的结构与功能
IDH 是一类在三羧酸循环中具有重要作用的代谢酶家族,广泛参与糖代谢、氨基酸代谢和脂类代谢过程[6]。IDH 的主要作用是催化异柠檬酸氧化脱羧生成α-酮戊二酸盐(α-ketoglutarate,α-KG),同时将烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、烟酰胺腺嘌呤二核苷酸磷酸(beta-nicotinamide adenine dinucleotide phosphoric acid,NADP+)还原为还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide adenine dinucleotide,NADH)和还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide adenine dinucleotide phosphate,NADPH)。
IDH 家族中有IDH1、IDH2、IDH3 三种同工酶,IDH1 和IDH2 为NADP+依赖酶,两者蛋白质结构几乎一致,都以同源二聚体形式存在[7]。IDH1编码基因位于染色体2q33.3上,包括12个外显子,编码蛋白质包含414 个氨基酸残基;IDH2 编码基因位于染色体15q26.1上,包括12个外显子,编码蛋白质包含452个氨基酸残基。IDH1 与IDH2 最主要的区别在于两者的亚细胞定位,IDH1 蛋白质存在于细胞质和过氧化物酶体中,而IDH2蛋白质存在于线粒体中。IDH3为NAD+依赖酶,由核基因IDH3A、IDH3B 和IDH3G 编码。IDH3 以异四聚体形式存在,结构中包含2 个具有活性位点的α 亚基,以及β 和γ 两个调节亚基。α、β 和γ 亚基分别包含366、385 和393 个氨基酸残基[8]。IDH3蛋白质存在于线粒体中[9]。IDH1与NADP+、异柠檬酸结合后从开放构型变为有催化活性的闭合构型,将异柠檬酸氧化为草酰琥珀酸盐,并同时将NADP+还原为NADPH。IDH1进一步对结合的草酰琥珀酸盐进行脱羧,形成α-KG和CO2。此时IDH1与α-KG分离,恢复成开放构型等待进行下一次催化。第132 位(R132)、第100位(R100)和第109位(R109)精氨酸残基是IDH1的催化三联体,处于活性位点中心[7]。
2 IDH突变导致肿瘤形成的作用机理
IDH代谢酶家族目前在肿瘤细胞中仅发现IDH1/IDH2 基因突变,尚未发现IDH3 基因存在突变,说明IDH 突变导致肿瘤形成的主要原因可能是突变引起细胞内NADPH 总量改变,从而导致细胞氧化还原能力的改变[10]。IDH1/IDH2 突变通常出现于细胞恶性转化的早期阶段,说明此突变具有促进肿瘤生长的作用[11]。
IDH1/IDH2 体细胞突变存在于浸润性神经胶质瘤[12]和急性髓细胞白血病[13]中,肿瘤细胞中的IDH 突变为体细胞单等位基因突变。IDH1/IDH2 突变极少同时出现在肿瘤细胞中,提示每个基因的突变都能够独立满足肿瘤发生与发展的需求。IDH1上绝大部分的突变发生于第132位的精氨酸活性位点(R132),其中以精氨酸突变为组氨酸(R132H)最为常见。由于R132处于IDH1活性位点中心,这个位置的突变能够改变IDH1 酶的活性。IDH2 上第172 位精氨酸残基(R172)与IDH1第132精氨酸残基同功,是IDH2上主要的突变发生部位,常见突变包括精氨酸突变为色氨酸(R172W)、甘氨酸(R172G)、丝氨酸(R172S)等;IDH2 第140 位精氨酸残基(R140)也能够发生突变,包括精氨酸突变为色氨酸(R140W)、亮氨酸(R140L)和谷氨酰胺(R140Q)等[14]。
部分突变使IDH1/IDH2 与底物形成无催化活性的异二聚体,从而无法正常催化异柠檬酸进行脱羧[15]。而另一部分突变能够赋予IDH1/IDH2 新的催化活性,使其能够在NADPH 氧化为NADP+的过程中利用α-KG 产生2-羟基戊二酸(2-hydroxyglutaric acid,2-HG)[16]。与正常细胞相比,具有IDH1/IDH2突变的神经胶质瘤细胞或急性髓细胞白血病细胞中2-HG 的水平可增高100 倍[16,17]。2-HG 能够抑制包括Ten-eleven 转运蛋白(ten eleven translocation,TET)在内的多个双加氧酶和组蛋白去甲基化酶的活性,导致基因CpG 岛过甲基化和组蛋白修饰改变,进而诱发肿瘤[18]。
IDH2 R172、R140 突变产生2-HG 的能力与突变位点是否存在野生型等位基因无关,IDH2 R172突变产生2-HG 水平高于IDH2 R140 突变。IDH1 突变产生2-HG的能力依赖于野生型IDH1等位基因的存在,杂合型IDH1 R132 突变细胞产生2-HG 的水平较高,与IDH2 R172突变产生2-HG的水平相似。神经胶质瘤、急性髓细胞白血病等肿瘤中IDH2 R172突变率高于IDH2 R140,可能与产生2-HG的能力不同有关[19]。
3 软骨肿瘤中IDH的突变频率
软骨良性肿瘤和软骨恶性肿瘤中均存在一定比例的IDH 突变。Amary 等[5]对145 份软骨肿瘤样本进行DNA 测序,其中81 份(56%)存在IDH1/IDH2 突变,而在同一患者的其他非肿瘤组织中未发现IDH1/IDH2 突变。按部位分类,中央型(54.7%)和骨膜型(75.0%)软骨肿瘤均存在突变;按肿瘤性质分类,低级别软骨肿瘤(内生性软骨瘤/Ⅰ级软骨肉瘤)(53.7%)和高级别软骨肿瘤(Ⅱ、Ⅲ级软骨肉瘤及去分化软骨肉瘤)(58.7%)中均存在IDH1/IDH2 突变;按发生部位分类,发生于手部、足部管状骨的软骨肿瘤突变率最高(89.7%)。而在同时检测的骨肉瘤、脊索瘤、间叶源性软组织肿瘤等样本中均未检测到IDH1/IDH2突变。
Ollier 病和Maffucci 综合征是以多发性内生软骨瘤为特征的罕见非遗传性疾病,其病变样本也普遍存在IDH1/IDH2 突变。Amary 等[20]对40 例Ollier 病或Maffucci 综合征患者的样本进行检测,其中37 例(92.5%)存在IDH1/IDH2 突变。Pansuriya 等[21]共采集43 例Ollier 病和13 例Maffucci 综合征肿瘤样本,以及其他172例孤立性软骨肿瘤样本进行基因检测,研究发现81%的Ollier 病患者、77%的Maffucci 综合征患者以及29%的孤立性软骨肿瘤样本中存在IDH1/IDH2突变。Ollier病和Maffucci综合征患者的体细胞突变成典型的马赛克样[21]。
软骨肉瘤是常见原发恶性骨肿瘤。Arai 等[22]采集13例颅内软骨肉瘤样本,其中6例存在IDH1/IDH2突变;同时检测的10 例颅内脊索瘤样本中均未检测到IDH1/IDH2突变。Meijer等[23]对几种罕见的软骨肉瘤亚型进行基因检测,6 例去分化软骨肉瘤样本中3例存在IDH1/IDH2突变。间叶性软骨肉瘤、透明细胞软骨肉瘤中均不存在IDH1/IDH2 突变。在去分化软骨肉瘤中,IDH 突变同时存在于良性软骨肿瘤部分和高级别非软骨肉瘤部分,而高级别非软骨肉瘤部分还具有肿瘤蛋白p53(tumor protein p53,TP53)突变等其他突变,说明两部分肿瘤起源于同样的前驱细胞,而后分化为不同类型。
此后,多项研究显示近50%的软骨肉瘤中存在IDH1/IDH2 突变[24-28]。对既往研究结果进行统计发现,51.4%的软骨肿瘤中存在IDH1/IDH2 突变,其中最常见的突变类型是IDH1 R132C,其他常见突变包括IDH1 R132G、IDH1 R132H、IDH2 R172G 等。而胶质瘤中70%以上为IDH1 R132H 突变,急性髓细胞白血病中最常见的突变点为IDH2 R140[29,30]。上述研究证实,IDH 突变与软骨肉瘤的发生之间存在关联性。由于骨肉瘤中从未发现IDH1/IDH2 突变,因此考虑IDH 能够作为辨别诊断成软骨型骨肉瘤、骨未分化多形性肉瘤和高级别软骨肉瘤、去分化软骨肉瘤的生物标志物[31](表1)。
4 IDH突变在软骨肿瘤发生中的作用机理
动物实验显示,IDH1 R132 基因替换小鼠出现四肢2-HG 水平较高、胫骨软骨矿化程度减低、内生性软骨瘤样损害等改变[32]。分子学研究显示,IDH1/IDH2 突变能够导致细胞内2-HG 水平明显升高[28,33],从而导致组蛋白修饰改变和基因甲基化水平升高[21],进而调节基因表达。其中DNA 甲基化差异较显著的基因为远端缺失同源盒5(distal-less homeobox 5,DLX 5)基因,其表达水平在突变样本中略有降低[21]。DLX5 是软骨内骨化过程中软骨细胞成熟的正向调节因子,能够促进未成熟的增生软骨细胞向肥大软骨细胞转变[34,35],同时能够诱导runt 相关转录因子2(runt-related transcription factor 2,Runx2)、成骨细胞特异性转录因子(osterix,OSX)的表达,从而促进骨髓间充质干细胞向成骨细胞分化[36,37]。DLX5 基因在IDH1/IDH2 突变组织中表达降低可能是导致肿瘤发生的分子机制之一。
间充质干细胞中IDH1/IDH2 突变能够调节SRY盒转录因子9(SRY-box transcription factor 9,SOX9)、Ⅱ型胶原蛋白α1 链(collagen type Ⅱalpha 1 chain,COL2A1)基因表达,这在促进成软骨分化的同时破坏软骨基质形成。同时,IDH1 R132C 突变能够抑制肝肾骨碱性磷酸酶(alkaline phosphatase,liver/bone/kidney,ALPL)基因表达,从而抑制成骨分化[38,39]。然而,软骨肉瘤细胞中的IDH1/IDH2 突变与H3K4、H3K9、H3K27 组蛋白修饰及DNA 甲基化水平间不存在显著关联性[40]。上述研究提示,IDH 突变可能是良性内生软骨瘤形成早期的重要致病因素,而不是肿瘤细胞恶变、增殖和扩散的必要因素。
5 IDH1/IDH2突变与肿瘤预后
神经胶质瘤和胶质母细胞瘤患者中具有IDH1/IDH2突变个体的预后较好[43,44],而目前IDH1/IDH2突变与软骨肿瘤预后的关系尚不明确。多项研究显示IDH1/IDH2 突变与软骨肿瘤患者预后之间不存在显著关联性[19,21,28],具有不同IDH1/IDH2 突变类型(R132C、R132H、R132G、R132I、R132S、R172S)的软骨肿瘤患者的疾病特异生存率和无转移生存率也不存在显著性差异[40]。
不同亚型的软骨肉瘤的预后差异显著[45]。多项研究提示,IDH 突变可能与软骨肉瘤预后有关。Lugowska等[26]对80例软骨肉瘤样本进行测序,发现存在IDH1/IDH2 突变的27 例患者的5 年生存率显著低于无突变患者(64%vs.93%,P<0.001),其中具有IDH1突变患者的5 年生存率最低。IDH1/IDH2 突变在病理类型较差、年龄较高的个体中较为频发,可能是IDH1/IDH2 突变患者5 年生存率较低的主要原因。Zhu 等[41]的研究显示,IDH 突变与患者总体生存率间不存在显著的关联性,但具有IDH突变的高级别软骨肉瘤患者的无复发生存率和无转移生存率高于不具有突变的高级别软骨肉瘤患者。Nicolle 等[46]认为IDH 突变、14q32 区域基因表达缺失和有丝分裂能力提高这三个因素的共同出现能够提示软骨肉瘤的预后较差。
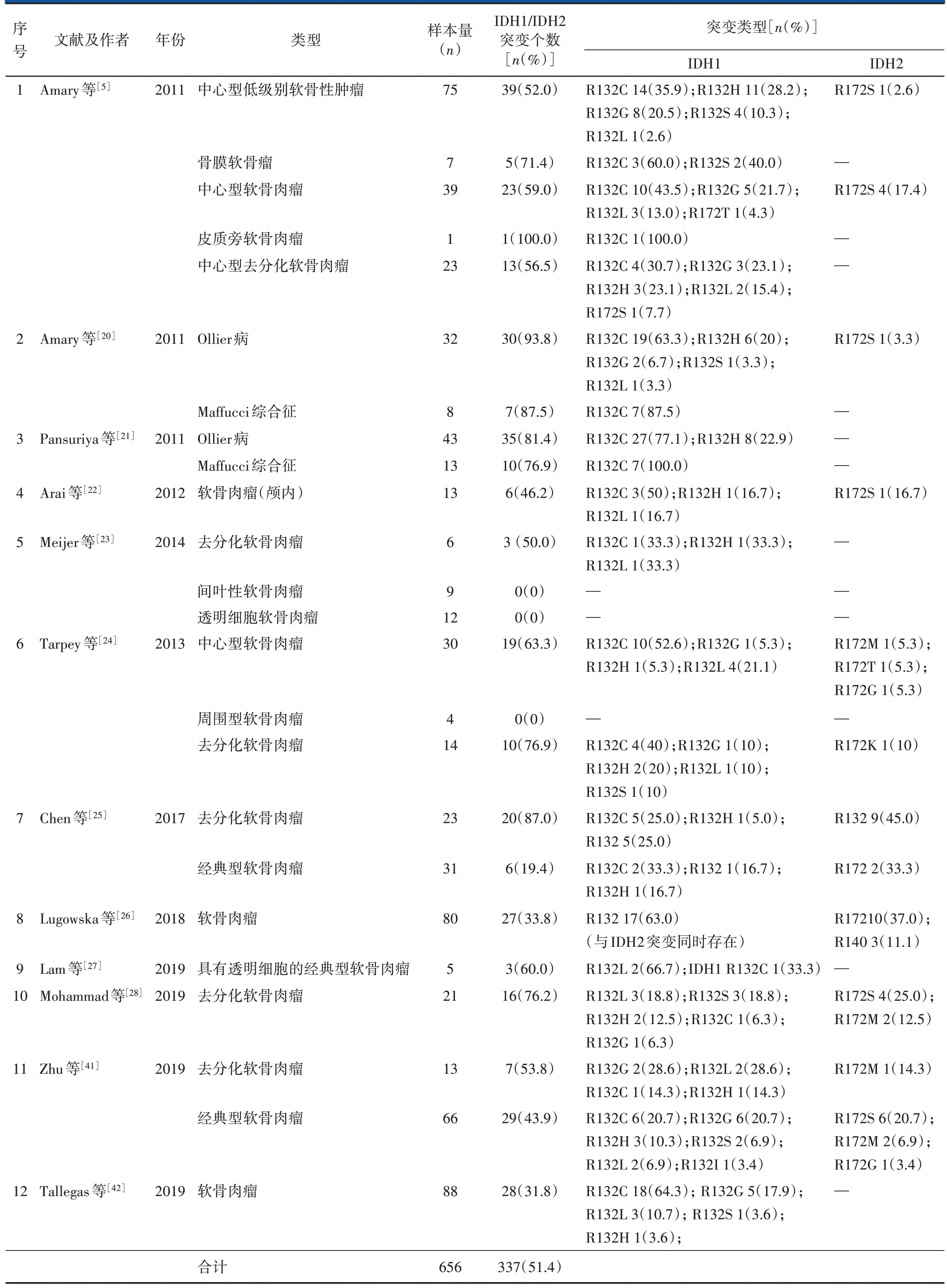
表1 既往报道中不同病理类型的软骨肿瘤的IDH1/2突变数及突变类型
6 IDH1/IDH2突变与软骨肿瘤靶向治疗
软骨肉瘤组织血供较少,对化疗和放疗不敏感,目前手术切除可取得较好的治疗效果。然而,经典型软骨肉瘤的术后复发率和转移率仍然较高,复发或转移病例的治疗方法有限,患者预后较差[47],去分化软骨肉瘤这类恶性程度较高的亚型的预后相对更差,中位生存时间约11 个月[48]。临床上需要探索更有效的治疗方法,以提高软骨肉瘤患者的预后。
软骨肉瘤中IDH 突变率较高,使IDH 突变靶向治疗成为可能,而目前对IDH 突变靶向治疗的效果尚存争论。AGI-5198 是IDH1 突变特异性抑制剂,Suijker 等[33]认为AGI-5198 能够降低具有IDH1 突变的软骨肉瘤细胞中2-HG 的水平,但无法影响肿瘤发生。Li 等[49]的研究显示AGI-5198 能够降低突变软骨肉瘤细胞中2-HG 的水平,同时也能够抑制肿瘤细胞的增殖和转移,并诱导细胞凋亡。Nakagawa等[47]研究发现,新型IDH1抑制剂DS-1001b能够降低突变细胞的2-HG 水平,同时能够对组蛋白3 第9 位赖氨酸三甲基化(Histone H3 lysine 9 trimethylation,H3K9me3)进行去甲基反应,从而上调SOX9、细胞周期蛋白依赖性激酶抑制因子1C(cyclin-dependent kinase inhibitor 1C,CDKN1C)等基因的水平,进而抑制软骨肉瘤细胞的增殖。目前,IDH2 突变抑制剂AG-221(NCT02273739)正在进行Ⅰ/Ⅱ期临床试验,IDH突变抑 制 剂 AG-881(NCT02481154)和 AG-120(NCT02073994)也正在进行Ⅰ期临床试验[50]。

