去甲氧柔红霉素联合阿糖胞苷巩固治疗急性髓系白血病的临床疗效
丁行成,夏琴,谢健,赵震宇,宋霞
(1.宜宾市第一人民医院血液科,四川 宜宾 644000;2.海南医学院附属海南医院血液科,海口 570311;3.滕州市荆河社区卫生服务中心,山东 滕州 277500)
急性髓系白血病(acute myelogenous leukemia,AML)是血液系统恶性肿瘤,表现为发热、疼痛及出血等症状[1]。临床常以诱导和巩固化疗为主,诱导化疗主要以蒽环抗生素联合阿糖胞苷为主,而蒽环抗生素以柔红霉素和去甲氧柔红霉素为常用药物,其中柔红霉素是第一代抗肿瘤药物,可改善临床症状,但耐药性高,且不良反应多,可产生氧自由基,损害心肌,导致心功能不全、心律失常等,严重者可导致患者死亡,不利于患者预后[2]。去甲氧柔红霉素是蒽环类药物柔红霉素的衍生物,属于新型抗肿瘤药物,其亲和力和脂溶性较柔红霉素高,药物更容易通过细胞膜,并可抑制核酸合成,促进DNA裂解和细胞凋亡,且可破坏细胞DNA的单链效应,无耐药性、不良反应较少[3]。近年来,去甲氧柔红霉素逐渐被临床广泛应用于AML的治疗。本研究主要探讨去甲氧柔红霉素联合阿糖胞苷巩固治疗AML的临床疗效,以期为临床治疗提供参考。
1 资料与方法
1.1一般资料 回顾性分析2017年12月至2019年12月宜宾市第一人民医院收治的100例AML患者的临床资料。纳入标准:①符合《血液病诊断及疗效标准(第3版)》[4]中AML的诊断标准;②年龄57~80岁;③预计生存期>3个月;④临床资料完整。排除标准:①脏器功能不全者;②凝血功能异常者;③合并其他恶性肿瘤者;④对所研究药物过敏者。上述患者按照治疗方法不同分为对照组和观察组,各50例。其中,对照组男34例、女16例,年龄57~80岁,平均(68.2±5.2)岁;疾病分型[5]:M0型5例,M1型10例,M2型23例,M4型3例,M5型9例。观察组男30例、女20例,年龄57~79岁,平均(67.5±5.1)岁;疾病分型:M0型4例,M1型11例,M2型22例,M4型5例,M5型8例。两组患者的性别、年龄等一般资料比较差异无统计学意义(P>0.05)。本研究经宜宾市第一人民医院医学伦理委员会批准,患者均签署了知情同意书。
1.2治疗方法 对照组给予柔红霉素联合阿糖胞苷巩固治疗,患者入院后第1~3天静脉注射柔红霉素(杭州瀚晖制药有限公司生产,批号:20150722)60 mg/(m2·d),每支加10 mL 0.9% NaCl注射液溶解,每日1次;第1~7天静脉滴注阿糖胞苷(郑州辅仁药业集团熙德隆肿瘤药品有限公司生产,批号:20171013)150 mg/(m2·d)+0.9% NaCl注射液200 mL,每日1次。观察组给予去甲氧柔红霉素联合阿糖胞苷巩固治疗,患者入院后第1~3天静脉注射去甲氧柔红霉素[辉瑞制药(无锡)有限公司生产,批号:20170925]10 mg/(m2·d),每日1次;阿糖胞苷用法用量同对照组,7 d 为1个疗程,共治疗2个疗程。
1.3观察指标及疗效判断标准 ①临床疗效评价:疗效判断标准参照田怀平等[6]的白血病疗效评定标准,完全缓解:无症状和体征,骨髓象中原始细胞≤5%;部分缓解:骨髓原始细胞>5%~20%;未缓解:血象及症状无改变。总缓解率=(完全缓解例数+部分缓解例数)/总例数×100%。②血清学指标:抽取患者清晨空腹静脉血5 mL,注入装有枸橼酸钠的真空抗凝试管中混匀,离心半径10 cm、3 000 r/min离心10 min分离血浆,采用酶联免疫吸附法检测血清可溶性细胞间黏附分子-1(soluble intercellular adhesion molecule-1,sICAM-1)、可溶性血管细胞黏附分子-1(soluble vascular cell adhesion molecule-1,sVCAM-1)、及血管内皮功能指标[铁蛋白(ferritin,FER)、促红细胞生成素(erythropoietin,EPO)、肝细胞生长因子(hepatocyte growth factor,HGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)]水平。③外周血淋巴细胞亚群水平:抽取患者清晨空腹静脉血5 mL,注入装有枸橼酸钠的真空抗凝试管中混匀,离心半径为 10 cm、2 000 r/min离心10 min分离血浆,采用深圳迈瑞BC-20细胞计数仪测定外周血CD3+、CD4+、CD8+水平。④采用卡氏功能状态评分量表(Karnofsky performance status,KPS)评估患者生存质量,满分为100分,评分越高说明生存质量越好。⑤观察并记录两组患者白细胞下降、骨髓移植、恶心呕吐等不良反应的发生率。
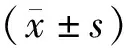
2 结 果
2.1两组患者临床疗效比较 观察组的总缓解率高于对照组[86.00%(43/50)比54.00%(27/50)](χ2=12.191,P<0.001),观察组的临床疗效优于对照组(Z=14.185,P<0.001)。见表1。

表1 两组AML患者的临床疗效比较 (例)
2.2两组患者血清sICAM-1、sVCAM-1水平比较 治疗前后血清sICAM-1、sVCAM-1水平的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组间血清sICAM-1、sVCAM-1水平的主效应差异有统计学意义(P<0.01);血清sICAM-1、sVCAM-1水平的组间与时点间存在交互作用(P<0.01),治疗后两组的血清sICAM-1、sVCAM-1水平均呈降低趋势,且观察组低于对照组。见表2。
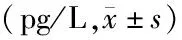
表2 两组AML患者的血清sICAM-1、sVCAM-1水平比较
2.3两组患者血管内皮功能指标比较 治疗前后血清FER、EPO、HGF及VEGF水平的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组间血清FER、EPO、HGF及VEGF水平的主效应差异有统计学意义(P<0.01);血清FER、EPO、HGF及VEGF水平的组间与时点间存在交互作用(P<0.01),治疗后两组的血清FER、EPO、HGF及VEGF水平均呈降低趋势,且观察组低于对照组。见表3。
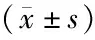
表3 两组AML患者的血管内皮功能指标比较
2.4两组患者外周血淋巴细胞亚群水平比较 治疗前后外周血CD3+、CD4+、CD8+、CD4+/CD8+水平的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组间外周血CD3+、CD4+、CD8+、CD4+/CD8+水平的主效应差异有统计学意义(P<0.01);外周血CD3+、CD4+、CD8+、CD4+/CD8+水平的组间与时点间存在交互作用(P<0.01),两组治疗前后外周血CD3+、CD4+、CD8+、CD4+/CD8+水平的变化幅度不同,观察组的外周血CD3+、CD4+、CD4+/CD8+水平高于对照组,CD8+水平低于对照组。见表4。
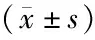
表4 两组AML患者的外周血淋巴细胞亚群水平比较
2.5两组患者KPS评分比较 治疗前后KPS评分的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组间KPS评分的主效应差异有统计学意义(P<0.01);KPS评分的组间与时点间存在交互作用(P<0.01),治疗后两组KPS评分均升高,且观察组高于对照组。见表5。
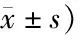
表5 两组AML患者的KPS评分比较 (分,
2.6两组患者不良反应发生率比较 对照组患者出现白细胞下降17例、骨髓移植11例、恶心呕吐4例,总不良反应发生率为64.00%(32/50);观察组患者出现白细胞下降9例、骨髓移植4例、恶心呕吐2例,总不良反应发生率为30.00%(15/50)。观察组的总不良反应发生率低于对照组(χ2=11.602,P<0.001)。
3 讨 论
AML与免疫紊乱、细胞增殖失控和凋亡受阻有关,由于AML患者生理功能衰退,耐受不良,无法进行造血干细胞移植,化疗成为主要的治疗方法。而不同化疗药物对肿瘤的缓解率和不良反应不同,故寻找安全有效的化疗药物成为临床研究的重点[7]。
阿糖胞苷是一种嘧啶类抗代谢药物,进入人体后可抑制DNA聚合酶活性,阻止DNA的生产和合成,从而影响细胞增殖。但阿糖胞苷对细胞增殖高度敏感,对RNA合成能力弱,易发生不良反应[8]。柔红霉素通过破坏DNA链来阻止DNA合成和白细胞增殖,但其耐药性和不良反应大[9];而去甲氧柔红霉素是新型抗肿瘤药物,可避免柔红霉素不足。去甲氧柔红霉素主要通过影响拓扑异构酶的活性,抑制核酸合成,促进DNA裂解和细胞凋亡。同时也可破坏细胞DNA的单链效应,且不诱导P糖蛋白的表达,因此很难产生耐药性[10-12]。本研究结果显示,观察组的总缓解率高于对照组,与魏姗姗等[13]的结果相似,说明去甲氧柔红霉素联合阿糖胞苷可提高AML临床疗效,其机制可能为去甲氧柔红霉素亲和力较高,抗肿瘤活性较强、半衰期较长,更易进入细胞和血脑屏障,且可与阿糖胞苷协同作用,提高肿瘤缓解率。
研究证实,血清sICAM-1、sVCAM-1水平与AML的发生发展密切相关,并参与白血病的免疫发病机制[14]。血清sICAM-1、sVCAM-1是与白细胞聚集和淋巴细胞功能有关的细胞分子,不仅能被T淋巴细胞激活,还能抑制T淋巴细胞介导的毒性反应[15]。而本研究结果显示,治疗后观察组患者的血清sICAM-1、sVCAM-1水平均低于对照组,提示去甲氧柔红霉素联合阿糖胞苷可降低疾病损害程度,缓解临床症状,考虑其作用机制与抗肿瘤应激反应有关。由于炎症因子刺激白细胞和内皮细胞引起sICAM-1、sVCAM-1上调,从而抑制细胞毒反应,影响肿瘤转移。EPO作为红细胞生长刺激因子,可反映贫血和缺氧症状。FER能反映机体的铁储存状况,对贫血、营养不良有诊断价值。HGF是HLH(helix-loop-helix)蛋白家族的一种,其异常变化提示骨髓造血微循环的改变。VEGF是血管生成的主要刺激因子,参与并诱导肿瘤中的新生血管生成[16-17]。同时研究显示,去甲氧柔红霉素联合阿糖胞苷可降低初发AML患者血清FER、EPO、HGF及VEGF水平[18]。本研究结果显示,治疗后观察组患者的血清FER、EPO、HGF及VEGF水平均低于对照组,说明去甲氧柔红霉素联合阿糖胞苷可抑制肿瘤新血管生成,改善营养不良和缺氧症状,考虑其原因可能与去甲氧柔红霉素容易通过细胞膜并增加细胞及骨髓细胞中的药物浓度及抑制核酸合成等有关。
细胞亚群在免疫系统中起调节作用,可发挥免疫调节和细胞免疫的作用,患者处于免疫抑制状态,而导致CD3+、CD4+水平降低。本研究中,治疗后观察组外周血CD3+、CD4+、CD4+/CD8+水平高于对照组,提示去甲氧柔红霉素联合阿糖胞苷可提高患者免疫功能,有利于促进患者预后。同时骨髓异常导致原始和未成熟细胞的增殖和分化及骨髓等造血组织的积累,从而抑制造血功能。本研究结果还显示,观察组总不良反应发生率低于对照组,与滕志和雷秦[19]的研究结果相似,说明去甲氧柔红霉素联合阿糖胞苷可降低不良反应发生率,分析其可能的原因是柔红霉素无耐药性,且蒽环类药物对心肌细胞的损伤导致心脏出现轻微反应。经治疗后均有所改善,阿糖胞苷与蒽环素联合可以产生协同效应,提高药物安全性。但在临床上需要注意的是,蒽环类药物可通过产生脂质过氧化作用抑制线粒体呼吸,导致细胞内钙的释放和心肌损伤[20-21]。本研究存在样本量较少的局限,下一步将扩大样本量并进行随访,以提供充足论证。
综上所述,甲氧柔红霉素联合阿糖胞苷巩固治疗可缓解AML患者临床症状,提高疫功能,改善生存质量,且疗效显著、安全性较高。

