山西省部分地区猪圆环病毒2 型基因遗传变异分析
高 宇,孟玉凯,王 晨,石玉节,张 甜,岳伟东,朱东阳,马海利
(山西农业大学动物医学学院,山西太谷030801)
自1991 年加拿大报道首例PCV2 引起的断奶仔猪多系统衰竭综合征(PMWS)以来,猪圆环病毒病已成为影响世界养猪业的重要传染病之一,给养猪业造成了巨大的经济损失[1-4]。猪圆环病毒(PCV)属于圆环病毒科圆环病毒属,是至今发现的最小动物病毒。根据基因序列的不同,PCV 分为PCV1、PCV2、PCV3 和PCV4[5-6]。其中,PCV2 可损伤猪的免疫系统,被认为是引起断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)等多种病症的病原体,给养殖业带来巨大的损失[7]。
目前,对于PCV2 的预防措施主要是免疫接种,市场上主要有PCV 2a,PCV 2b 和PCV 2d 等3 种疫苗基因型,但是PCV2 基因型较多,国内外均有免疫失败的案例报道,因此,对于山西地区的PCV2 遗传变异分析很有必要。PCV2 基因为单股环状DNA分子,全长1767bp 左右,有13 个开放阅读框(ORF)。目前对ORF1、ORF2 与ORF3 的功能研究较为清楚,其他开放阅读框的功能尚不明确[8]。ORF1 基因高度保守,编码与病毒复制相关的Rep 蛋白和Rep'蛋白[9-10];ORF 2 基因变异程度较高,位于基因组反义链上,基因长为702 bp 或705 bp,编码PCV2 唯一的结构蛋白Cap 蛋白,Cap 蛋白与免疫和病毒的感染密切相关,可以诱导机体产生针对PCV2 的特异性中和抗体[11-12];ORF3 基因长为315 bp,位于ORF1内,按相反方向进行转录,编码104 个氨基酸的凋亡蛋白,在诱导感染细胞凋亡方面有着重要作用[13-14]。
为了解山西省PCV2 的流行情况及PCV2 病毒株的遗传差异情况,2019 年收集山西省部分地区PCV2 疑似感染病料用PCV2 基因鉴定引物进行PCR 扩增和凝胶电泳,对于鉴定阳性样品进行全基因扩增及测序,并将拼接好的PCV2 序列与GenBank 中公布的PCV2 基因序列进行比对分析,构建基因进化树,为山西省猪圆环病毒病2 型防控疫苗的基因型选择及疫苗研发提供一定的参考依据。
1 材料和方法
1.1 样品来源
疑似PCV2 感染肺脏组织收集自山西省阳泉、柳林、平遥、泽州和高平5 个地方的屠宰厂,每个地方收集3 份,共15 份。
1.2 主要试剂
DNA 提取试剂盒购买自天根生化科技(北京)有限公司;DL 2000 DNA Marker、2×TaqMaster-Mix购买自北京康为世纪生物科技有限公司。
1.3 引物
PCV2 特异鉴定引物和PCV2 全基因扩增引物分别源自参考文献[15]和[16](表1),由生工生物工程(上海)股份有限公司合成。

表1 引物序列
1.4 病毒基因组DNA 的提取
取猪肺脏组织2 g 左右于研钵中,加液氮研磨粉碎后移至2 mL EP 管中,加入500 μL PBS 溶液,按照DNA 提取试剂盒说明书提取病毒基因组DNA,置-20 ℃冰箱保存,备用。
1.5 疑似PCV2 鉴定
以提取的病毒基因组DNA 为模板,用PCV2鉴定引物进行PCR 扩增,反应体系为20 μL,反应参数为:预变性94 ℃4 min;94 ℃1 min,55 ℃1 min,72 ℃1 min,共30 个循环;72 ℃终末延伸7 min,4 ℃暂时保存。核酸凝胶电泳检测扩增产物片段大小是否与预期一致。
1.6 PCV2 全基因扩增与测序
以鉴定PCV2 阳性样品的基因组DNA 为模板,用PCV2 全基因扩增的4 对引物分别进行PCR扩增,反应体系为40 μL,反应参数为:预变性94 ℃5 min;94 ℃1 min,57 ℃1 min,72 ℃1 min,共35 个循环;72 ℃终末延伸10 min,4 ℃暂时保存。PCR 扩增产物进行核酸凝胶电泳。将PCV2 阳性样品中同时扩增出4 条清晰明亮目的条带PCR 产物送上海英俊生物科技有限公司进行序列测定。
1.7 序列比对分析
利用DNAStar-SeqMan 拼接PCV2 全基因组序列,用DNAStar-MegAlign 和MEGA-X 比对分析扩增序列与GenBank 上已发布的PCV2 疫苗毒株、各基因型标准参考毒株、国内外不同国家和地区毒株(表2)的核苷酸同源性、遗传进化(树);并对ORF2基因推导的Cap 蛋白氨基酸同源性和突变位点进行分析。
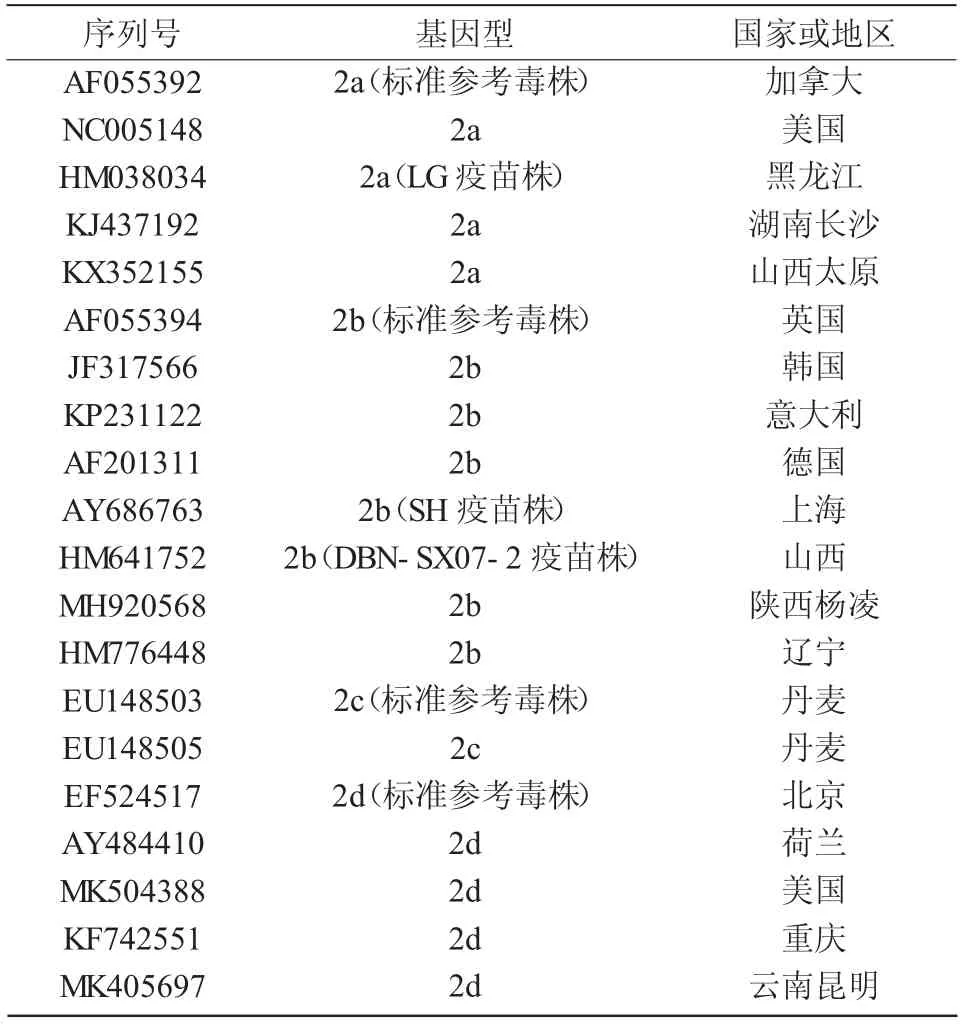
表2 PCV2 参考序列
2 结果与分析
2.1 疑似PCV2 鉴定
用PCV2 鉴定引物PCV2 F 和PCV2 R 对山西阳泉、柳林、平遥、泽州和高平的15 份疑似PCV2猪肺脏组织进行PCR 扩增和凝胶电泳,有12 份病料扩增出预期目的片段(图1),鉴定为PCV2 阳性样品。

2.2 PCV2 全基因的PCR 扩增
用4 对PCV2 全基因扩增引物分别对阳泉、柳林、平遥、泽州和高平12 份PCV2 阳性样品进行PCR 扩增和凝胶电泳,共有6 份阳性样品同时扩增出4 个预期的目的片段(图2)。
2.3 测序基因的拼接与命名
将同时获得4 个目的片段的PCR 扩增产物进行测序,用DNAStar-SeqMan 拼接基因,获得6 株PCV2 全基因序列,分别命名为SXYQ-1、SXLL-2、SXZZ-3、SXZZ-4、SXGP-5、SXPY-6。其中SXYQ-1、SXLL-2、SXZZ-3、SXZZ-4 有1767 个核苷酸,SXGP-5、SXPY-6 有1 768 个核苷酸。
2.4 全基因遗传进化分析
应用DNAStar-MegAlign 对6 株PCV2 全基因进行遗传进化分析和比较。6 株之间核苷酸同源性为96.6%~99.9%。与GenBank 上已发布的国内外疫苗株同源性为95.4%~98.7%,与国内、国外其他毒株同源性分别为95.4%~99.8%和94.6%~99.8%。与山西太原毒株(KX352155)同源性为95.5%~95.8%。
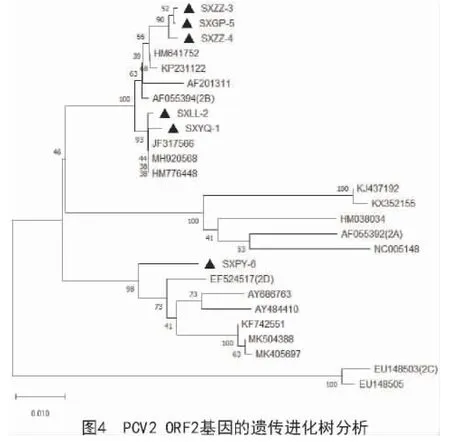
应用MEGA-X 对6 株PCV2 全基因进行进化树分析可知(图3),6 株PCV2 处在2 个不同的进化分支上,SXYQ-1、SXLL-2、SXZZ-3、SXZZ-4、SXGP-5处在同一分支上,属于PCV 2b 型;SXPY-6 处于另一分支上,属于PCV 2d 型。

2.5 ORF2 基因遗传进化分析
应用DNAStar-MegAlign 软件对6 株PCV2ORF2基因进行遗传进化分析和比较。6 个ORF2 基因序列长度均为702bp。6 株之间核苷酸的同源性为94.8%~99.9%,与GenBank 上已发布的国内外疫苗株同源性为92.3%~99.0%,与国内、国外其他毒株同源性分别为91.5%~99.9%和91.8%~99.9%。与山西太原毒株(KX352155)同源性最低,为91.5%~92.8%。
应用MEGA-X 对6 株PCV2 ORF2 基因进行进化树分析(图4),6 株处在2 个不同进化分支上。SXYQ-1、SXLL-2、SXZZ-3、SXZZ-4、SXGP-5 处 在同一分支上,属于PCV 2b 型;SXPY-6 处于另一分支上,属于PCV 2d 型。
2.6 ORF2 基因推导Cap 蛋白氨基酸分析
应用DNAStar-MegAlign 分析6 株PCV2 的ORF2 基因推导的Cap 蛋白氨基酸序列(图5)。6 株PCV2 的Cap 蛋白均为233 个氨基酸,其氨基酸同源性为94.0%~100%;与参考毒株Cap 蛋白氨基酸同源性为88.0%~100%,与国内外疫苗株同源性为90.6%~100%。Cap 蛋白氨基酸主要变异位点分析表明,氨基酸主要变异区域为57—90、121—135、190—210,在8、47、169、232、234 等处存在一些散在的变异位点。在86—90 位SXPY-6 有PCV 2d 特有的Cap 蛋白氨基酸序列SNPLT,属于PCV2d 型;其余5 株在86—91 位有PCV 2b 特有的Cap 蛋白氨基酸序列SNPRS,属于PCV 2b 型。

3 结论与讨论
近年来,PCV2 在欧洲、美洲等一些国家和地区持续不断存在,国内有关PCV2 的报道不断增加,PCV2 引起的圆环病毒病给养猪业造成了巨大的经济损失[8,17]。
通过对不同地区的PCV2 毒株的序列分析、比对,可以了解PCV2 的遗传与进化,对疫苗的研发和选用具有重要意义。本研究从山西省部分地区疑似PCV2 病料中扩增测序获得6 株PCV2 完整序列,其中,2 株核苷酸为1 768 bp、4 株核苷酸为1 767 bp,与GenBank 上已发布的国内外PCV2 株同源性为94.6%~99.8%,表明山西省内流行的PCV2毒株与目前国内外流行的毒株序列同源性很高;6 株PCV2 的ORF2 基因序列与GenBank 上已发布的国内外毒株进行序列比对同源性为91.5%~99.9%,表明PCV2 的ORF2 基因比全基因组变异程度较高;综合PCV2 全基因和ORF2 基因同源比对结果,表明山西省内PCV2 基因存在一定程度的变异。另外,本研究还发现,按Cap 蛋白氨基酸在86—89 位的特定序列分型,与全基因和ORF2 基因分型相一致,和李文良[18]对于PCV2 各个基因型Cap蛋白在86—89 位有特定序列的结果相一致。
本研究得到的6 株序列按全基因或者ORF2基因分型,5 株属于PCV 2b 型、1 株属于PCV 2d型,可以初步判断山西省目前流行的圆环病毒2 型以PCV 2b 型为主。本研究只选择了山西晋中、晋南和晋北5 个地方的样品,测得的基因序列数目有限,对于PCV2 在山西省的流行情况,需要进一步加大对PCV2 基因型变异的监测力度,以便为PCV2 疫苗基因型选择、疫苗研发和山西省PCV2防控提供依据。

