油莎豆CebZIP1 基因的克隆及表达分析
李 腾,孙 岩,陈 莹,刘宝玲,薛金爱,李润植
(山西农业大学分子农业与生物能源研究所,山西太谷030801)
油莎豆(Cyperus esculentus)又称虎坚果、铁荸荠等,属莎草科莎草属多年生C4 草本植物[1]。油莎豆原产于非洲及地中海沿岸的干旱和半干旱地区,目前,在我国的东北、华北及长江流域等地均有种植,其具有生长速度快、生物量大、对环境友好等优点[2]。油莎豆全身是宝,其地上茎叶部分可作为优质牧草,也可作为造纸及编织业的基础原材料;地下块茎富含膳食纤维、油脂、蛋白质和淀粉等,除供食用外,还可加工成生物柴油、润滑油等;地下须根也具有重要的药用价值[3]。在生产中,油莎豆对土壤条件的要求并不严格,甚至可以在四荒地、盐碱地、滩涂地等一些边际土地上生长,具有很强的抗旱、耐贫瘠、耐盐碱等能力,所以,也是植物抗逆性研究的理想材料[4]。
转录因子是一类能够特异性识别基因启动子区的顺式作用元件,进而抑制或激活目的基因转录表达的蛋白质,参与植物(非)生物胁迫响应和生长发育[5]。碱性亮氨酸拉链(basic leucine zipper,bZIP)转录因子是真核生物中分布最广泛、结构最保守的一类基因家族,因其共有的bZIP 保守结构域而被命名。bZIP 结构域一般由60~80 个保守氨基酸残基组成,包括1 个C 端的碱性结构域(BR)和1 个N 端的亮氨酸拉链区(LZ),其中,碱性区参与细胞核定位和特异性识别DNA 序列;而亮氨酸拉链区因其特有的氨基酸序列,可使bZIP 蛋白在与DNA结合前发生二聚化,形成同源或异源二聚体[6]。bZIP转录因子能识别的顺式作用元件主要是以ACGT为中心的核心序列片段,如A-Box(TACGTA),C-Box(CACGTC)和G-Box(GACGTC)等[7]。研究发现,bZIP 转录因子广泛参与调控种子贮藏、植物的光信号传导、病害防御、生物和非生物胁迫应答以及ABA 响应敏感性等各种反应[8]。如拟南芥AtbZIP1、AtbZIP24、AtbZIP17 等蛋白都可通过调控盐胁迫调控基因表达,从而提高植株对盐胁迫的耐受性,而AtbZIP9 参与调控叶片、维管等器官的发育[9-10];水稻OsbZIP12、OsbZIP23 和OsbZIP72 可增强水稻的非生物胁迫抗性[11],而OsbZIP52 则是干旱和冷胁迫的负调控因子,OsbZIP16基因上游核心顺式作用元件参与ABA 信号传导,基因过表达植株表现出显著的抗旱性[12-13]。此外,大豆多个GmbZIPs转录因子均能使植物表现出明显的抗盐性和抗旱性[14]。
“十一五”期间,科技部将油莎豆列为“农林生物质工程”的国家科技重大项目,开展油莎豆的高效培育技术研发[15]。目前关于油莎豆bZIP 转录因子的调控网络和作用机制尚不清楚。本研究基于油莎豆转录组数据,挖掘盐胁迫下bZIP家族中的差异表达基因,命名为CebZIP1。在油莎豆中对该基因进行克隆和生物信息学分析,以及不同组织和逆境胁迫下的表达模式分析,探究其潜在的生物学功能,以期为油莎豆的抗逆生物学研究提供一定的参考。
1 材料和方法
1.1 试验材料
油莎豆块茎采自湖南长沙,种植于山西农业大学农学院试验田内。
收集成熟期的根、叶、块茎等用于组织特异性表达分析。
选择饱满无虫眼的油莎豆块茎,清洗干净,播于装有自来水的90 mm 规格的培养皿中(水不浸没块茎,按需向培养皿中加水),每个培养皿放10 颗油莎豆块茎,置于光照培养箱中;将长势较好且一致的油莎豆植株快速清洗干净,进行胁迫试验,每个胁迫3 次重复。其中,盐胁迫是将根部浸泡于0.3 mol/L 氯化钠中处理0、6、12、24 h;干旱胁迫是将根部浸泡于100 g/kg 聚乙二醇6000 中处理0、6、12、24 h;低温胁迫是挑选整株材料于4 ℃低温处理0、6、12、24 h(根部浸泡于自来水中)。分别取每个处理节点的4 株油莎豆的混合叶片为试验材料,迅速清洗干净,经液氮速冻后,于-80 ℃冰箱进行保存。
1.2 CebZIP1 基因的克隆及生物信息学分析
从山西农业大学分子农业与生物能源课题组前期获得的盐胁迫下油莎豆转录组数据库中筛选到1 个存在明显差异表达的bZIP 基因,将其命名为CebZIP1,利用Primer 6.0 设计特异性引物(表1)。以油莎豆叶片cDNA 为模板,按照2×TSINGKE Master Mix(北京擎科生物公司)的体系和程序进行PCR 扩增,将所得PCR 产物经琼脂糖凝胶电泳后使用SanPrep 柱式DNA 胶回收试剂盒(上海生工生物工程股份有限公司)回收,测量回收产物浓度,连接到pMD19-T 载体中,转化大肠杆菌DH5α,涂板挑取单克隆,菌检为阳性后送至上海生工生物工程股份有限公司测序。
1.3 CebZIP1 基因的生物信息学分析
用ORF finder(https://www.ncbi.nlm.nih.gov/orff inder/)进行开放读码框的查阅以及编码氨基酸的预测;用在线软件ProParam(https://web.expasy.org/protparam/)预测CebZIP1 蛋白分子质量和理论等电点;用在线软件ProtScale(http://web.expasy.org/pro tscale/)对CebZIP1 蛋白的疏水区进行预测;在WOLFPSORT(https://wolfpsort.hgc.jp/)网站进行CebZIP1的亚细胞定位分析。用MEME(http://meme-suite.org/tools/meme)进行蛋白结构域预测(采用默认设置);采用SMART 软件预测蛋白序列的保守结构域;用ProtScan 分析CebZIP1 蛋白的二级结构。用PRALINE program 网站(http://www.ibi.vu.nl/programs/pral inewww/)对不同物种的bZIP 蛋白进行多序列比对;用MEGA 7.0 软件构建各物种bZIP 蛋白的系统发育树,抽样次数(Bootstrap)设置为1 000 次。
1.4 CebZIP1 的实时荧光定量PCR 分析
使用植物RNA 提取试剂盒(北京全式金生物公司)提取油莎豆根、叶、块茎的总RNA 和胁迫处理下叶片总RNA,使用ABM 反转录试剂盒进行反转录为cDNA。以油莎豆Ce18s rRNA为内参基因,按照2×SYBR qPCR Mix(大连宝生物生物公司)的反应体系,使用BioRad CFX96 Touch Real-Time PCR仪进行RT-qPCR 基因差异表达分析,采用2-ΔΔCT法计算相对表达量,设置3 个生物学重复。
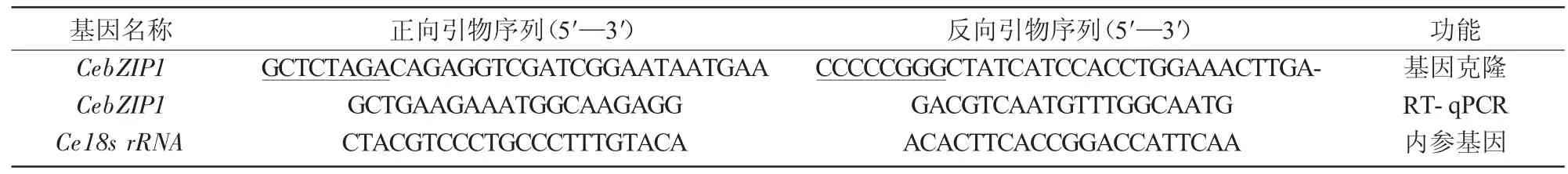
表1 引物序列
2 结果与分析
2.1 油莎豆CebZIP1 基因的克隆和生物信息学分析


从盐胁迫的转录组数据中获得1 个差异表达的bZIP基因,名命名CebZIP1基因,经克隆、测序,该基因cDNA 全长948 bp(图1),与前期测得的转录组数据保持一致。生物信息学分析表明,CebZIP1基因编码315 个氨基酸;带负电荷的残基总数(Asp+Glu)为40 个,带正电荷的残基总数(Arg+Lys)为27 个,理论等电点(pI)为5.02(呈酸性);蛋白分子质量约为34.13 ku,分子式为C1457H2308N430O487S15,总原子数为4 697;不稳定指数为49.01(属于不稳定蛋白),脂肪指数为68.48,总平均亲水性系数值为-0.621(为亲水性蛋白);预测其定位于细胞核内。由此表明,CebZIP1 是一个存在于细胞内的亲水性不稳定酸性蛋白。CebZIP1 含有一个典型的bZIP蛋白BRLZ(Basic region leucine zipper)的结构域,位于第144—208 位氨基酸之间(图1)。利用ProtScan分析该蛋白的二级结构可知,二级结构以α- 螺旋和无规则卷曲为主,分别占36.52%和58.41%(图2)。
2.2 油莎豆CebZIP1 转录因子同源比对及系统发育分析
为了进一步分析油莎豆CebZIP1基因的功能,对其编码氨基酸进行了在线Blast 分析,结果如图3所示,CebZIP1 与素心兰(Cymbidium ensifolium,QEO19199.1)、铁皮石斛(Dendrobium catenatum,XP_020676154.1)、短花药野生稻(Oryza brachyantha,XP_015688883.1)、高粱(Sorghum bicolor,XP_02131 5645.1)和二穗短柄草(Brachypodium distachyon,XP_003570405.1)的bZIP家族成员的氨基酸一致性较高。从第166—195、197—216 位和第222—246 位氨基酸之间可以看出氨基酸序列高度保守。
利用MEGA 7.0 软件建立洋薊(Cynara cardunculusvar,XP_024993134.1)、拟南芥(Arabidopsis thaliana,NP_173381.1)、大豆(Glycine max,XP_006 604633.1)、哥伦比亚锦葵(Herrania umbratica,XP_021289339.1)、茶树(Camellia sinensis,XP_02806 3387.1)、蓖麻(Ricinus communis,XP_002533547.1)、葡萄(Vitis vinifera,XP_002533547.1)、莴苣(Lactuca sativa,XP_023737393.1)、阿比西尼亚红蕉(Ensete ventricosum,RZS14488.1)、油棕(Elaeis guineensis,XP_029118633.1)、凤蝶(Phoenix dactylifera,XP_0087 81732.1)、凤梨(Ananas comosus,XP_020109470.1)、弯叶画眉草(Eragrostis curvula,TVU32801.1)、玉米(Zea mays,XP_008681056.1)、谷子(Setaria italica,XP_004951741.1)、黍(Panicum miliaceum,RLM804 22.1)等22 种植物bZIP 蛋白序列的系统发育树,结果表明,油莎豆的bZIP 蛋白单独聚在一支,很明显地与其他植物的bZIP 蛋白区分出来,但与禾本科植物的遗传距离最近(图4)。


2.3 CebZIP1 基因的表达模式分析
通过RT-qPCR 检测油莎豆CebZIP1基因在各个器官及盐、干旱低温胁迫下的相对表达量可知(图5、6),正常情况下不同组织CebZIP1基因的表达量从高到低依次为叶、根和块茎;叶中CebZIP1基因表达量显著高于根和块茎中的表达量(P<0.05);在非生物胁迫处理下,叶片中CebZIP1基因的表达量在24 h 内呈现先升后降的趋势,并在12 h时的表达量显著高于其他时间。此外,干旱胁迫下CebZIP1基因的表达变化量高于盐、低温胁迫,尤其在干旱处理6~12 h 急剧上升。表明CebZIP1基因可能参与调控油莎豆非生物胁迫响应。


3 结论与讨论
bZIP 转录因子广泛存在真核生物的基因组中,在调控动植物生长、发育以及病虫害、病原菌、涝害、低温、高盐等生物和非生物胁迫过程中发挥着重要功能[10]。在模式植物拟南芥[16]、葡萄、大豆[17]、玉米[18]和谷子[19]中已经开展了多年研究。对于无参考基因组的油莎豆而言,本研究通过对前期盐胁迫下转录组数据挖掘含有bZIP 结构域的差异表达基因,命名为CebZIP1。系统进化树分析表明,关于油莎豆bZIP 转录因子的研究非常薄弱,甚至在整个莎草科中都没有与其近缘的bZIP 蛋白,这与莎草科植物在生产上的利用价值较少有很大的关系。一般来讲,莎草科植物大多都具有耐贫瘠的特点,通过挖掘与其耐性相关的转录因子,可为作物抗逆改良提供更多优异的基因元件。同时本研究结果还表明,油莎豆的bZIP 蛋白与禾本科植物的bZIP 蛋白的亲缘关系较近,这也与传统的分类结果相一致。
本研究发现,油莎豆CebZIP1基因在盐和干旱胁迫下表达上调,这与毛雪飞等[10]研究的金银花bZIP基因在干旱和盐胁迫下的表达量结果一致,小麦TabZIP3基因的表达水平受盐和干旱等显著诱导,拟南芥中过表达TabZIP3基因提高了转基因拟南芥对盐胁迫的耐受性[20]。揭示油莎豆CebZIP1转录因子同植物bZIP基因一样,受非生物胁迫因素的诱导,进而调控下游靶基因的表达水平、增强油莎豆抵御逆境的能力[21],特别是CebZIP1在胁迫处理后6 h 时表达量已经明显提高,说明CebZIP1基因能够迅速响应非生物胁迫。
本研究利用前期的盐胁迫下油莎豆转录组数据,通过检索首次挖掘了含有bZIP 结构域、且存在差异表达的CebZIP1基因,cDNA 长度为948 bp,编码315 个氨基酸,为定位于细胞核的酸性亲水性蛋白。基因表达模式显示,CebZIP1基因在油莎豆的根、块茎和叶中均有表达,在叶和根中表达量显著高于块茎,且在叶中表达量最高;CebZIP1基因受盐、干旱和低温胁迫诱导表达,且快速响应干旱胁迫。说明CebZIP1基因参与非生物胁迫响应,研究结果可为进一步研究bZIP转录因子家族基因在油莎豆响应非生物胁迫中的作用提供理论依据。

