早期梅毒合并HIV感染的MSM人群Treg细胞的研究
汪晓丹,张 明,李 娟,翁文佳,高艳青
(首都医科大学附属北京佑安医院皮肤科,北京 100069;*通讯作者,E-mail:gaoyanqing@ccmu.edu.cn)
梅毒以细胞免疫为主,而HIV可以破坏机体的细胞免疫。人们推测两种疾病或许有较广泛的相互作用,如早期的一些研究显示,梅毒会导致CD4计数下降、HIV载量升高[1],进而推测,合并梅毒可能会加快HIV感染进展为AIDS;处于免疫缺陷状态时,梅毒可能会迅速由一期进展为三期,甚至出现所谓的“恶性梅毒”[2-5]。查阅文献,发现二者免疫方面相互作用的研究较少。所以本研究以男男性接触者(men who have sex with men,MSM)为研究对象,从调节性T细胞(regulatory T cells,Treg)入手,初步探索梅毒合并HIV感染相互作用的特点。
1 材料与方法
1.1 研究对象
研究对象均来自2009-2014年首都医科大学附属北京佑安医院性病艾滋病诊疗中心随访的MSM队列人群。其中早期梅毒组患者26例(包括一期、二期梅毒、早期潜伏梅毒,且不伴HIV感染),HIV组18例[均为HIV感染者(外周血CD4≥350个/μl,感染HIV时间>6个月)],合并感染组18例[早期梅毒合并HIV患者(外周血CD4≥350个/μl,感染HIV时间>6个月)],健康组20例(MSM队列中性别和年龄相匹配的未暴露于HIV和梅毒的健康者)。收集病例过程中不包括年龄小于18岁、合并有活动性肺结核的患者。所有梅毒患者均未进行驱梅治疗,所有HIV感染者均未进行高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART)治疗。所有入选者一般情况见表1。

表1 四组患者的基线资料
1.2 方法
1.2.1 Ficoll-Hypaque密度离心法分离PBMC 健康对照组采集新鲜血。取新鲜采集的EDTA抗凝全血离心去除血浆后,用PBS稀释一倍,加至淋巴细胞分离液上层,2 500 r/min,离心25 min,取中间白膜层(即单核细胞和淋巴细胞富集层),PBS洗涤2遍,得到外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。早期梅毒组、HIV感染组、合并感染组均为2009-2014年随访期间冻存PBMC,于42 ℃恒温水浴锅,快速晃动冻存管,使冻存的细胞在1 min内解冻,获得较高细胞存活率。
1.2.2 荧光抗体染色 利用荧光抗体染色,CD4-APC,CD25-PE,FoxP3-FITC CD8a APC。选择CD4+CD25+FoxP3+来界定Treg细胞。
1.2.3 流式细胞仪检测Treg细胞百分比 采用FACSCalibur型流式细胞仪,分析早期梅毒组、HIV感染组、早期梅毒合并HIV感染组及健康组外周血中Treg细胞百分比。
1.2.4 仪器及试剂 TGL-16G台式离心机(北京六一仪器厂);恒温水浴锅(北京中兴伟业仪器有限公司);FACSCalibur型流式细胞仪(美国BD公司)。CD4-APC,CD25-PE,FoxP3-FITC CD8a APC(美国eBioscience公司)。
1.3 数据统计分析

2 结果
2.1 四组间Treg细胞的比较
采用流式细胞技术分析了HIV感染组和早期梅毒组Treg细胞所占PBMC百分比明显高于健康组(0.80%±0.10%,0.74%±0.07%vs0.32%±0.05%,均P<0.05);合并感染组Treg细胞所占PBMC百分比明显高于健康组(1.01%±0.09%vs0.32%±0.05%,P<0.001,见图1);其余各组间差异无统计学意义。
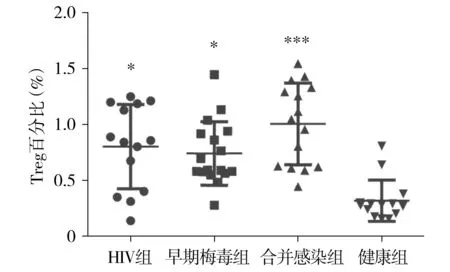
与健康组比较,* P <0.05,* * * P <0.001图1 Treg细胞占PBMC百分比在四组人群中的比较Figure 1 Comparison of Treg percentage in PBMC between four groups
2.2 不同分期单纯梅毒与合并感染Treg细胞的比较
我们将单纯梅毒与合并感染组患者按照不同临床分期进行分组,由一期进展为二期梅毒时,单纯梅毒组和合并感染组Treg细胞比率均呈上升趋势,而合并感染者Treg比率上升更快(见图2)。

图2 不同分期单纯梅毒与合并感染组Treg细胞的比较Figure 2 Comparison of Treg percentage between different syphilis staging
3 讨论
调节性T细胞是CD4+T细胞的一个亚群,具有广泛的免疫抑制活性。越来越多针对人体和动物模型的研究显示Treg细胞可以抑制多种慢性感染的免疫反应,包括结核分枝杆菌[6]、幽门螺杆菌[7]、乙肝病毒感染[8]、HIV感染[9]以及恶性疟原虫[10]等。
我们的研究结果显示,梅毒患者外周血调节性T细胞比正常对照组显著升高,这与裘宇容等[11]报道一致。梅毒螺旋体侵入机体后,机体随即启动一系列细胞及体液免疫,但梅毒螺旋体依然能够逃避这些免疫并形成持久的感染。其免疫逃避机制除了免疫原性较弱[12],膜蛋白抗原变异[13]及抗体介导的调理作用受损[14]之外,一个重要的原因是梅毒螺旋体可能触发机体免疫抑制系统,造成感染的持续和播散[15]。最近一项研究发现梅毒螺旋体的抗原TpF1可促进二期梅毒患者外周血Treg水平升高[15]。升高的Treg可下调早期梅毒的各项免疫因子,这或许就是梅毒患者经久不愈的原因。
已证实调节性T细胞能抑制机体CD4+和CD8+T细胞的特异性抗HIV-1免疫反应[16,17]。许多证据表明:外周血Treg的数目和比例与病程慢性化有直接关系。对于丙肝及乙肝患者,Treg可通过下调抗原特异性T细胞的反应而导致感染的持续[18,19]。但在HIV感染中,Treg细胞的功能还未完全阐明。我们发现HIV感染组Treg比率明显高于健康组,这与Andersson等[20]研究结论一致。
我们的前期研究发现,血清固定更容易在HIV合并早期梅毒患者中发生。而其他多项研究[21,22]提示CD4+CD25+Foxp3+调节性T细胞在梅毒血清固定患者的比例明显高于正常人。我们的研究发现合并感染组Treg明显高于其他组,进一步分析不同梅毒分期Treg细胞的变化发现,在梅毒由一期进展至二期过程中,合并感染组Treg上升速率高于单纯梅毒组,提示合并感染组的细胞抑制更为明显。由于患者外周血中CD4+CD25+Foxp3+调节性T细胞比例异常增高,细胞免疫功能受到抑制,机体虽经过常规抗生素治疗,但仍有少量梅毒螺旋体存在,持续刺激机体产生抗体,导致血清固定的发生,因此,推测CD4+CD25+Foxp3+调节性T细胞在梅毒合并HIV患者血清固定的发生中可能起着一定的作用。

