疏肝解郁法联合针刺对糖尿病合并抑郁大鼠血糖、胰岛素受体及ERK1/2、CaMK 信号通路表达的影响
房 丹
(联勤保障部队第九八三医院和平院区内四科,天津 300020)
糖尿病是由胰岛素分泌缺陷或胰岛素抵抗引起的慢性代谢性疾病,其主要特征是慢性高血糖[1]。抑郁症是糖尿病的主要并发症之一,随着生活节奏的加快和社会压力的增加,糖尿病并发抑郁症的发生率逐年增高[2]。据相关统计发现,超过3 成糖尿病患者伴有不同程度的抑郁症状[3]。糖尿病合并抑郁症作为一种内分泌和神经系统复合疾病,严重影响患者生活质量,且致残和自杀风险高,常规西医治疗一般采取控制䧜和抗抑郁等对症治疗,对改善相关症状有明显的作用,但存在病情易复发、不良反应大等不足[4]。目前对于糖尿病并发抑郁症的作用机制尚未完全明确,研究能够有效治疗糖尿病合并抑郁症的方法意义重大。
1 实验材料
SPF级雄性大鼠48只,5周龄,体质量 160~200 g,由省实验动物中心提供。干净、清洁环境下,每只大鼠置于隔离单元内笼中饲养,含直径14 cm 转轮;温度22~26 ℃,相对湿度55%~65%,隔音通风且避光,无外界干扰情况下自由摄食、饮水及转轮活动,光暗同步下饲养1 周。链脲佐菌素STZ、β-actin 抗体(Sigma-Aldrich 中国公司);血糖、胰岛素和糖化血红蛋白试剂盒(北京卓尔恒信科技有限公司);高脂高糖乳剂:10%胆固醇、20%猪油、30%蔗糖、2%胆酸钠、38%普通标准饲料;ERK1/2 抗体、CaM 抗体、CaMK Ⅱ抗体(美国Abacm 公司);PⅤDF 膜(美国Milipore 公司);蛋白分析试剂盒(美国Bio-Rad 公司);RT-PCR 引物(深圳市瑞赛生物技术有限公司);TRIZOL 试剂、一步法RT-PCR 试剂盒(上海一基实业有限公司);柠檬酸缓冲液、M-MuLⅤ逆转录酶(北京百奥莱博科技有限公司);琼脂糖(美国Amresco公司)。血糖仪(上海玉研科学仪器有限公司);Catalyst One® 全自动生化分析仪(美国IDEXX 公司);MyCycler PCR 扩增仪、Mini-PROTEAN 小型垂直电泳槽、PowerPac Basic 基础电泳仪、iQ5 实时荧光定量PCR 仪(美国Bio-Rad 公司);SpectroArt 200 紫外分光光度仪(美国WEALTEC 公司);DK-8B 电热恒温水浴箱(上海中庸检验设备有限公司);SpectraMax i3x 多功能酶标仪[美谷分子仪器(上海)有限公司];H1650R 台式高速冷冻离心机(湘仪离心机仪器有限公司);华佗牌一次性针灸针(苏州医疗用品厂有限公司)。疏肝解郁方:柴胡6 g,陈皮6 g,川芎6 g,党参8 g,白术8 g,茯苓8 g,香附5 g,白芍5 g,甘草3 g。药材由医院中药房提供,冷水浸泡2 h 后两煎,分别取滤液后合并,水浴蒸发制备成浓缩药物,含生药0.35 g/mL。
2 方法
2.1 模型制备与分组 所有大鼠普通饲养1 周,监测血糖,确保其在正常范围内。随机选取8 只作为空白组(A 组),给予标准饲料饲养;其余40 只则为造模组,给予高糖高脂饲料饲养。4 周后对大鼠进行称重,采集血液检测空腹血糖(FBG)、胰岛素(FINS)及相关血生化指标,计算胰岛素抵抗指数(HOMA-IR),确认是否形成胰岛素抵抗。造模组所有大鼠禁食12 h后,腹腔内注射STZ 溶液,注射剂量以35 mg/kg为标准。STZ 溶液必须现用现配,注射前将STZ溶解于0.1 mol/L、pH 值4.5 无菌柠檬酸缓冲液中,配制成12 mg/mL 的STZ 溶液。A 组大鼠以同样标准注射等剂量柠檬酸缓冲液。72 h后采集血液及测量血糖,取3 次测量平均值作为最终结果,FBG ≥16.7 mmol/L则认为糖尿病大鼠造模成功。糖尿病造模成功大鼠均继续给予慢性孤养和不可预见性中等刺激,具体包括4 ℃冰水浴5 min、45 ℃热水浴5 min、束缚15 min、噪音8 h、昼夜颠倒24 h、倾笼45°24 h、夹尾1 min 等,每天随机选取一种刺激,同种刺激不连续出现,形成不可预测的温和刺激,共刺激4 周,以旷场实验进行行为学检测,以大鼠水平运动格数和垂直竖立次数下降与造模前有统计学差异作为造模成功的判定标准,差异性越大,抑郁程度越高。
2.2 治疗方法 造模组40例大鼠随机分为5 组,分别为模型组(B组)、阳性对照组(C组)、针刺组(D组)、疏肝解郁方组(E组)和疏肝解郁方联合针刺组(F组)。C 组给予临床等效剂量二甲双胍(0.18 g/kg)加百忧解(1.8 mg/kg)灌胃治疗;D 组统一于每天早上10 点进行针刺治疗,取穴:百会(顶骨正中)、后三里(膝关节后外侧,腓骨小头下约5 mm)、三阴交(后肢内踝尖上10 mm),百会穴斜刺2~3 mm,后三里、三阴交直刺2~3 mm,每日1 次;E 组给予疏肝解郁方临床等效剂量3.5 g/kg 标准灌胃;F 组治疗方法为针刺加疏肝解郁方,方法同D 组与E 组。A 组与B 组给予等剂量生理盐水灌胃。治疗7 d 后观察结果。
2.3 观察及检测方法 1)血糖:麻醉后腹主动脉取血,促凝管收集,3 000 r/min 离心分离10 min,取上清液-80 ℃保存待检,使用全自动生化分析仪检测FBG、糖化血红蛋白(HbA1c)及FINS,计算HOMA-IR,所有操作均严格执行试剂盒所示要求。2)RT-PCR法检测胰岛素受体(IR)、胰岛素底物-1(IRS-1)mRNA 表达:取肝组织50 mg,Trizol 一步法取肺脏组织总RNA,蛋白核酸分析仪检测RNA 浓度,M-MuLⅤ逆转录酶逆转录成cDNA,PCR 扩增检测IR、IRS-1 mRNA 表达,反应条件:95 ℃、30 s,94 ℃、5 min,55 ℃、30 s,70 ℃、1 min,35 个循环;引物序列如下:IR 上游5’-GCTGGACTGTGGTGGATA-3’,IR 下游5’-GTCAGA CTCAAAAGGTGGG-3’,长度419 bp;IRS-1 上 游5’-CCTGGAGTATTATGAGAACGA-3’,IRS-1 下 游5’-TTGGAGCAACTGGATGAA-3’,长度609 bp;取5 μL 扩增产物于1.5%琼脂糖凝胶电泳,凝胶成像系统灰度扫描。3)Western-bloting 法检测大鼠海马组织CaM、CaMK Ⅱ、ERK1/2 含量:大鼠末次治疗后断头,取新鲜海马组织,1.5 mL LFP 管中生理盐水冲洗,充分剪碎后2 500 r/min 离心10 min,去上清;加4 ℃裂解液1 mL,剪碎混匀后低温超声匀浆,14 000 r/min,离心5 min 后取上清液;5 μL 上清液加入3 μL 考马斯亮蓝、95 μL 去离子水,测量595 nm 处OD 值,并根据OD 值调整蛋白浓度;待检测蛋白样品上样量:50 μg/孔;电泳条件:12%浓缩胶,90 Ⅴ,30 min;10%分离胶,120 Ⅴ,120 min;NC 膜转印,转膜条件:300 mA 恒流,90 min;完全浸没于5%的的脱脂奶粉TBST 溶液中,摇床2 h,TBS 漂洗5 min,3 次;一抗孵育,4 ℃过夜;二抗孵育,37 ℃1 h;扫描分析结果,曝光时间2 min,CCD 自动获取图像,以1:1 000 稀释的小鼠抗大鼠β-actin 单克隆抗体作为内参,各蛋白相对表达量以条带与相应蛋白β-actin 灰度值的比值半定量表示。
2.4 统计学方法 采用SPSS 22.0 软件进行分析,计量资料以均值±标准差()表示,采用方差分析。
3 结果
3.1 各组大鼠FBG、HbA1c、HOMA-IR 水平比较 见表1。
表1 各组大鼠FBG、HbA1c、HOMA-IR 水平比较(,n =8)
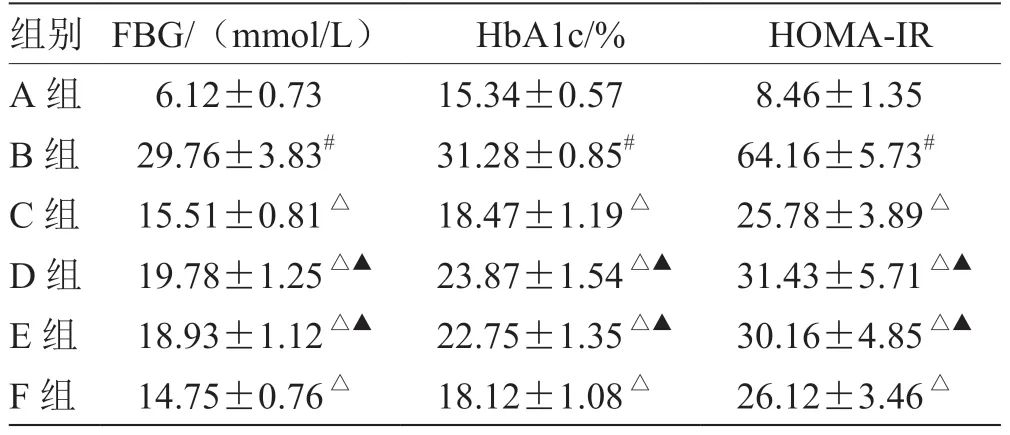
表1 各组大鼠FBG、HbA1c、HOMA-IR 水平比较(,n =8)
注:与A 组比较,# P <0.05;与B 组比较,△P <0.05;与F 组比较,▲P <0.05
3.2 各组大鼠肝组织IR、IRS-1 mRNA 表达比较 见表2。
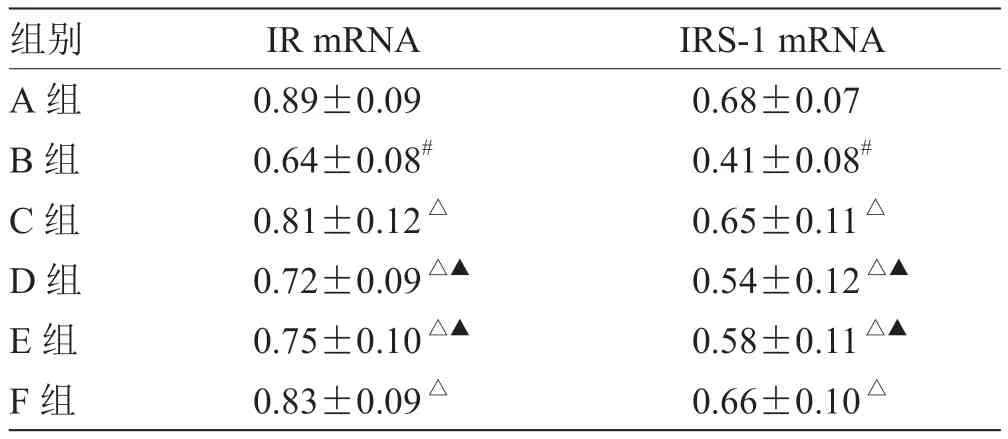
表2 各组大鼠肝组织IR、IRS-1 mRNA 表达比较(n =8)
3.3 各组大鼠海马组织CaM、CaMKⅡ平均灰度值及ERK1/2 平均光密度值比较 见表3。
表3 各组大鼠海马组织CaM、CaMK Ⅱ平均灰度值及ERK1/2平均光密度值比较(,n =8)
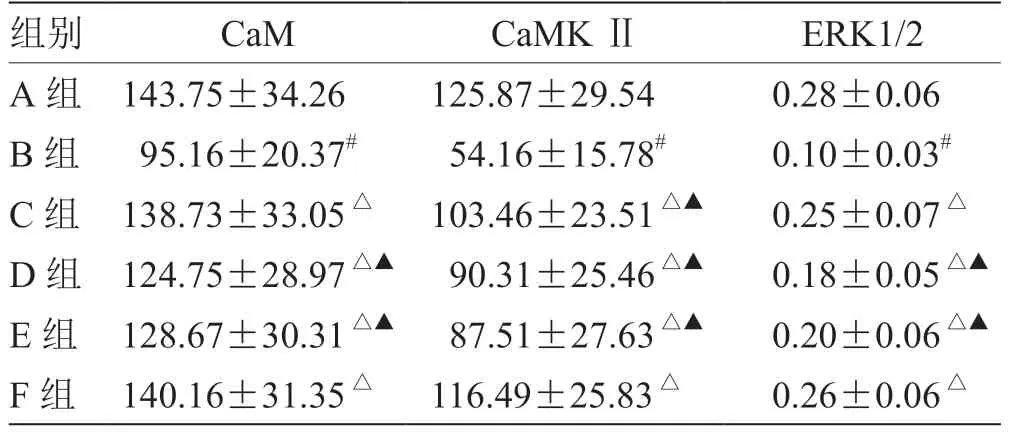
表3 各组大鼠海马组织CaM、CaMK Ⅱ平均灰度值及ERK1/2平均光密度值比较(,n =8)
注:与A 组比较,# P <0.05;与B 组比较,△P <0.05;与F 组比较,▲P <0.05
4 讨论
糖尿病作为一种慢性代谢性疾病,可累及多器官、组织,其中对中枢神经系统的影响越来越受到重视[5]。长期血糖控制不良会影响其他物质代谢,并影响中枢神经系统的结构与功能[6],导致抑郁的发生。抑郁是糖尿病患者常见并发症,糖尿病合并抑郁症患者具有高血糖、高血红蛋白、胰岛素抵抗等特征[7],且上述特征会相互影响,恶化病情。临床研究显示,FBG 和HbA1c 与糖尿病患者抑郁发病率关系密切[8]。胰岛素抵抗会影响脑组织葡萄糖利用效果,下调神经元兴奋性,导致传输速度减缓,在糖尿病并发抑郁症的发病中发挥着重要作用[9],改善FBG、HbA1c、HOMA-IR水平是糖尿病合并抑郁患者治疗的重要步骤。本次研究显示,糖尿病合并抑郁大鼠模型经疏肝解郁法联合针刺治疗后,FBG、HbA1c、HOMA-IR 水平显著降低(P<0.05),与阳性对照组效果相当,表明疏肝解郁法联合针刺可有效控制大鼠的高血糖,改善胰岛素抵抗状态。
现代医学认为,下丘脑-垂体-肾上腺轴功能活动亢进,皮质酮(CorT)、促肾上腺皮质激素等水平提高是糖尿病合并抑郁的主要病理生理改变[10]。CorT长期保持高水平会刺激FINS 分泌,加重糖尿病病情。肝脏是葡萄糖产生和利用的主要器官,也是FINS 作用的靶器官[11],FINS 能和靶细胞表面IR 结合,进而导致一系列的磷酸化活级联反应,产生FINS的生物效应。任意FINS 信号传导环节受损均可导致胰岛素抵抗的发生[12],因此,研究胰岛素受体对糖尿病合并抑郁大鼠的疗效意义重大,本次研究中主要对大鼠肝组织IR、IRS-1 mRNA 表达变化进行研究。本研究结果显示,大鼠经治疗后IR、IRS-1 mRNA 表达显著升高(P<0.05),其中F 组和C 组改善效果最为明显,表明疏肝解郁法联合针刺能够提高肝组织 IR、IRS-1 的基因表达,改善FINS 信号传导。
海马组织是参与学习记忆、调控情绪的重要部位[13],也是糖尿病合并抑郁症发生的重要靶点。“海马神经元损伤减少”假说是抑郁发病的重要机制之一,海马神经元损伤及可塑性失调是导致抑郁发生的重要因素[14]。环磷腺苷效应元件结合蛋白(CREB)是调节中枢神经系统功能的关键分子之一[15]。随着分子生物学的发展,抑郁症的发病机制逐渐由细胞外单胺递质途径转向细胞内信号转导机制。研究显示,CREB的表达与神经元可塑性直接相关,而CREB 的表达受到多种信号通路的影响[16],CaMK 信号通路是其中重要途径之一。CaM 是钙离子重要的受体蛋白,直接参与神经元的修复,其与钙离子结合后形成的复合物能够激活CaMK Ⅱ。CaMK Ⅱ在海马区内高度表达,对传递信息、调节神经可塑性具有重要作用[17]。丝裂原活化蛋白激酶(MARK)通路能调节神经元的增长、凋亡及突触可塑性,ERK1/2 是其中与抑郁症关系最为密切的信号通路[18]。本次研究显示,B 组海马组织CaM、CaMKⅡ、ERK1/2表达显著低于A组(P<0.05),表明糖尿病合并抑郁症会损伤大鼠海马神经元,提示下调ERK1/2、CaMK 通路可能是抑郁症的发病机制之一。C 组和F 组CaM、CaMK Ⅱ、ERK1/2 表达显著升高(P<0.05),且与D、E 组有显著差异(P<0.05),提示疏肝解郁法联合针刺能够影响CaMK、ERK1/2 信号通路,调节海马神经元再生,发挥抗抑郁作用。
从上述研究发现,疏肝解郁法联合针刺效果显著,与阳性药物一致,表明中医在糖尿病合并抑郁的治疗中具有独到的优势。在中医理论中,糖尿病属于“消渴”的范畴,历代医家认为其发生与发展与情志关系密切。抑郁症属于“郁证”的范畴,消渴迁延难愈,情志内伤,则肝气不舒、郁结于内,郁久化热,热灼伤津,耗伤阴津,加重消渴之症。消渴与郁证共存,二者相互影响,加重疾病的进展。本研究中采用疏肝解郁法联合针刺治疗糖尿病合并抑郁。肝气郁结是该病早期显著特点,故采用疏肝解郁之法,方中柴胡疏肝解郁为君药,臣以川芎行气活血止痛,香附理气疏肝,二者合用,助君药解肝经之郁滞;陈皮理气行滞,党参补中益气、止渴生津,白术、茯苓健脾益气、燥湿利水,白芍养血柔肝,为佐药;甘草调和诸药,为使药。诸药同用,共奏疏肝行气,活血止痛之功。郁证病位在脑,与心肝脾密切相关,本次研究中针刺选择百会、后三里、三阴交。从心论治,醒脑开窍,心主神,百会位于头部巅顶,乃诸脉汇聚之处,针刺可调神通督;从肝论治,调节疏泄状态,三阴交乃肝脾肾汇集之处,针刺可调肝、运脾、健肾;从脾论治,运脾化湿,调畅气机,后三里可调节脾土。
综上所述,疏肝解郁法联合针刺治疗糖尿病合并抑郁大鼠的机制可能与改善血糖异常,提高肝组织IR、IRS-1 的基因表达从而改善胰岛素的信号传导,激活ERK1/2、CaMK 信号通路调节大鼠海马神经元再生有关。

