蜂王浆对雌性未孕大鼠乳腺组织的影响
刘一冰陈恒徐浩周桂华蔺哲广吉挺∗
(1. 扬州大学动物科学与技术学院,江苏扬州 225009; 2. 广西蜜博士蜂业有限责任公司,南宁 530000)
蜂王浆(Royal Jelly,RJ)是青年工蜂头部上颚腺和咽下腺共同分泌的乳白色或淡黄色的浆状天然产物,因其特有的化学组分及丰富的生物学活性而被广泛应用于保健品、医药、日化等领域[1]。RJ具有抗菌[2]、抗炎[3]、抗氧化[4]、抗肿瘤[5]、抗衰老[6]、降血压[7]、增强免疫力[8]等生物学活性,并在癌症[5]、高血压[7]、高胆固醇血症[9]、阿尔茨海默症[10]和帕金森[11]等疾病的治疗和预防中得到了广泛的研究。
近年来,RJ 对生殖系统、繁殖性能、激素水平等的影响引起了众多学者的关注。Suzuki 等[12]研究表明,RJ 中含有的脂肪酸类物质10-羟基-2-癸烯酸(10-HDA)、10-羟基-反式-2-癸烯酸(10-H2DA)、反式-2-癸烯酸(2-DEA)及甾醇24-亚甲基胆固醇(24-MET)在未成年大鼠中表现出雌激素活性,但相比己烯雌酚或植物雌激素弱。在动物实验中,连续灌服45 d 蜂王浆主蛋白(major royal jelly proteins,MRJPs)可加速雌性未成年大鼠青春期的开始,促进卵泡发育[13]。另外,RJ 中的 57 × 103蛋白可诱导蜜蜂幼虫发育为蜂王,增加蜜蜂的体型和卵巢发育,缩短蜜蜂的发育时间[14]。在果蝇的研究中也发现,补充MRJPs 可以延长其寿命、增强繁殖能力和采食量[15]。因此,RJ 可能通过改变激素分泌或通过其中的激素样化合物来发挥生殖功能[13]。
目前,RJ 关于生殖、激素成分的研究大多集中于卵巢、子宫、睾丸等生殖器官[12-13,16-17]。然而,RJ对与生殖、激素、内分泌系统息息相关的乳腺组织的影响及机制尚不清楚。在其它雌激素样化合物的研究中发现,乙烯基雌二醇能改变雌性啮齿类动物的乳腺发育[18]。E2 能促进青春期前女性的乳腺生长,增加生物标志物基质金属蛋白酶-3 的mRNA水平[19]。此外,Boberg 等[20]的研究表明,围产期暴露于植物E2 中的成年女性发生乳腺增生的患病率增加。因此,探究RJ 对乳腺组织及生殖激素水平的影响尤为重要。
本研究评估了RJ 对雌性未孕青年大鼠生长指标、乳头直径变化、血清激素水平、乳腺组织学形态变化的影响,以确定RJ 是否会促进乳腺发育或促使乳腺过度发育(增生),了解RJ 对乳腺组织的剂量反应关系,为RJ 的安全生产和制定正确食用方法提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
50 只清洁级雌性未孕Wistar 大鼠,7 周龄,体重为(200 ± 20) g,购自扬州大学比较医学中心【SCXK(苏)2017-0007】。以上动物均饲养于扬州大学比较医学中心实验室【SYXK(苏)2017-0044】。本实验已通过扬州大学实验动物福利伦理委员会批准(201911-001)。饲养环境:温度 22 ~ 25℃,湿度40% ~60%,光照周期明暗均为12 h。实验期间动物自由采食、饮水,在实验前及之后的每周进行称重。
1.1.2 主要试剂与仪器
苏木素染液套装(武汉谷歌生物科技有限公司,G1005),大鼠E2、P 和PRL 酶联免疫吸附测定法(ELISA)检测试剂盒(上海酶联生物科技有限公司,ml002871、ml002894、ml002881)。
病理切片机(上海徕卡仪器有限公司,RM2016);组织摊片机(浙江省金华市科迪仪器设备有限公司,KD-P);正置光学显微镜(尼康,Nikon Eclipse E100,日本);酶标仪(Rayto,RT-6100)。
1.2 方法
1.2.1 蜂王浆用量
RJ 生产于江苏省扬州大学实验蜂场【生产许可证编号:SC12632100300076】,-20℃条件下储存。根据体表面积(body surface area,BSA)标准化方法得出,大鼠RJ 摄食量为100 mg/kg 时可与人类传统上消耗的RJ(1 g/kg,体重)相关[21-22]。因此,本研究将RJ 的剂量梯度设置为100 mg/kg(低剂量)、200 mg/kg(中等剂量)、400 mg/kg(高剂量)和800 mg/kg(超高剂量)。
1.2.2 动物分组
适应性饲养1 周后,将50 只7 周龄雌性未孕Wistar 大鼠随机分为5 组,每组10 只。正常对照组(CK 组) 大鼠,每天灌服 2 mL 蒸馏水;RJ100、RJ200、RJ400、RJ800 组大鼠每天灌服 2 mL RJ,剂量分别为100、200、400、800 mg/kg。所用 RJ 事先用无菌水稀释成不同倍数,现备现用。实验为期35 d,结束后,大鼠禁食过夜。采样当天用2%戊巴比妥钠45 mg/kg 腹腔注射麻醉大鼠后开始采样工作。
1.2.3 乳头直径及生长指标测定
(1)体重测定(灌服前):实验开始当天进行第1 次称重,记录初始体重。之后每周称重1 次,总计6 次。
(2)乳头直径测定:大鼠麻醉后,用酒精棉球将第2 对乳头周围被毛浸湿,使乳头裸露,再用精密游标卡尺测量第2 对乳头直径,左右乳头各测量3 次,读数记录后取平均值。
(3)器官指数:大鼠肝、子宫、卵巢组织的分离在采血处死后进行,用PBS 溶液洗去表面残留血液后称取湿重,计算相应的器官指数,器官指数(%)=器官湿重/大鼠体重。
1.2.4 血清激素水平测定
乳头直径测量完毕,进行腹主动脉采血,血液收集到促凝管中静置1 ~2 h 后离心(4000 rpm,10 min),取上层血清至1.5 mL 离心管内,酶联免疫吸附测定法测定血清E2、P、PRL 水平。
1.2.5 乳腺组织学观察
采集第2 对乳头及周围乳腺组织于4%多聚甲醛组织固定液中固定,制作石蜡切片,HE 染色,显微镜下观察乳腺组织形态,拍照测量乳腺导管直径,结合病理检查结果对乳腺组织进行综合评价。
1.3 统计学分析
实验数据处理使用软件IBM SPSS Statistics 25完成,采用ANOVA 中的LSD 多重比较进行分析,所有数据均为平均值± 标准误差(±s¯x),P< 0.05表示为差异具有显著性。乳腺组织切片在软件MShot Image Analysis System 中进行测量分析。
2 结果
2.1 蜂王浆对大鼠乳头直径的影响
从图1 可以看出,与 CK 组相比,RJ200 和RJ800 组的乳头直径显著增宽。RJ100 和 RJ400 组的乳头直径明显低于RJ200 组,且与CK 组无明显差异。
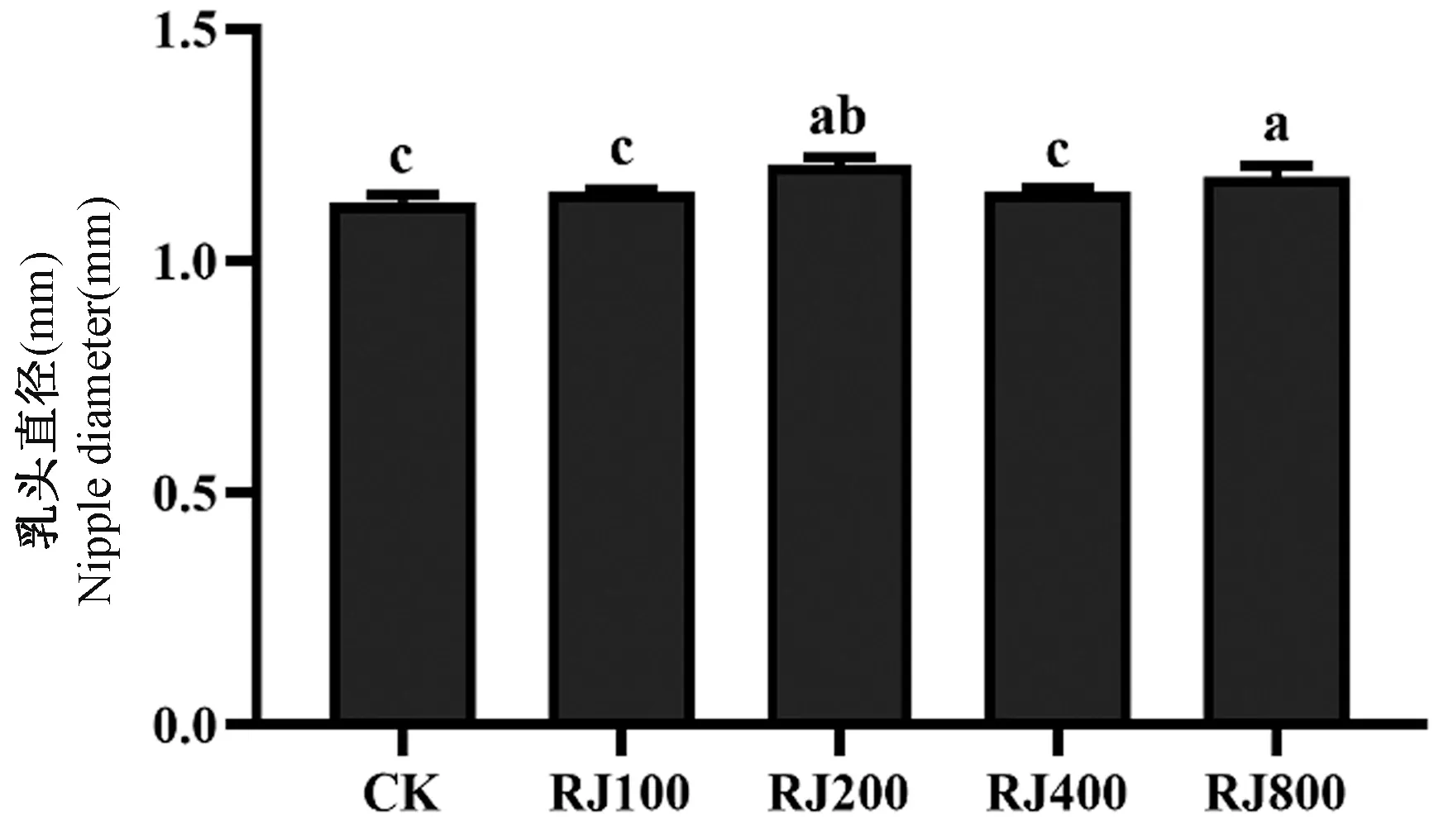
注:CK:正常对照组;RJ100、RJ200、RJ400、RJ800 组:每只大鼠每天灌服 2 mL RJ 100、200、400、800 mg/kg。与 CK 组相比,aP < 0.05;与RJ100 组相比,bP < 0.05;与 RJ200 组相比,cP < 0.05。(下图/表同)。图1 蜂王浆对大鼠乳头直径的影响Note. CK. Normal control group. RJ100, RJ200, RJ400 and RJ800 groups. Each rat was given 2 mL of RJ100, 200, 400,800 mg/kg every day. Compared with the CK group, aP <0.05. Compared with the RJ100 group, bP < 0. 05. Compared with the RJ200 group, cP < 0. 05. (The same in the following figures and tables)Figure 1 Effect of royal jelly on nipple diameter of rats
2.2 蜂王浆对大鼠体重及器官指数的影响
由表1 知,第 1 次称重时 RJ100 和 RJ800 组大鼠体重相对较高,但经过1 周的饲养,各组大鼠间体重无差异。实验进行到第3 周时,与CK 组比RJ100组大鼠体重显著升高,之后的第4、5 周各组间无差异。实验第 35 天称重发现,与 CK 组比高剂量RJ400 组和超高剂量RJ800 组大鼠体重显著降低。
对大鼠卵巢、子宫、肝称重后计算器官指数,结果如图2 所示。与CK 组相比,各组大鼠卵巢指数、子宫指数、肝指数差异均不显著,表明灌服蜂王浆不会影响大鼠卵巢、子宫和肝的重量。
2.3 蜂王浆对大鼠血清E2、P、PRL 的影响
RJ 对大鼠血清 E2 水平影响如图3A 所示。与 CK 组比,RJ200 和 RJ400 组血清 E2 水平显著升高,且 RJ200 组显著高于 RJ400 组。RJ100 组血清E2 水平显著低于 RJ200 和 RJ400 组,且与CK 组几乎相同。CK 组、RJ100 和 RJ800 组之间无明显差异。
图3B 为RJ 对大鼠血清P 水平的影响,从图中可以发现 RJ200、RJ400 和 RJ800 组血清 P 水平显著低于 CK 组,尤以 RJ200 和 RJ400 组最为明显。RJ100 组与 CK 组血清 P 水平显著高于 RJ200 和RJ400,且两组间血清P 水平几乎相同。
与CK 组相比,RJ200 和RJ400 组大鼠血清PRL水平显著升高。其中,CK 组、RJ100 和 RJ800 组血清PRL 水平显著低于 RJ200 和 RJ400 组。另外RJ100、RJ800 组血清PRL 水平与CK 组无明显差异(图3C)。
由上述结果可以看出,RJ100 组大鼠血清E2、P 和PRL 水平均与CK 组保持一致,而RJ200组大鼠三种血清激素水平均与CK 组激素水平差异具有显著性。其中,与 CK 组相比,RJ200 组E2 和 PRL 显著升高,P 水平显著减低。RJ400 组P 和 PRL 水平与 RJ200 组保持一致,但 RJ400 组E2 水平显著低于 RJ200 组。RJ800 组 E2 和 PRL水平与RJ100 组保持一致,而 P 水平显著低于RJ100 组。
2.4 蜂王浆对大鼠乳腺组织及乳腺导管直径的影响
大鼠乳腺组织由乳腺小叶、腺泡、导管和结缔组织等组成,乳腺组织切片病理检查结果显示:CK组(图4a、b)乳腺组织可见个别导管结构和少量腺泡结构,上皮为排列整齐的单层立方上皮,未见明显增生和导管扩张,乳腺组织处于静息状态;RJ100 组(图4c、d)乳腺组织中导管较 CK 组增多,但导管结构完整,无明显增生和扩张;与CK 组和 RJ100 组相比,RJ200(图4e、f)、RJ400(图4g、h)、RJ800(图4i、j)组可见到数量较多的导管结构,乳腺小叶数量增多,部分小叶内腺泡分界不清(无扩张)。另外在这三组中还发现乳头管上皮增厚、总导管轻微扩张的现象,尤以RJ800 组较为明显。

表1 蜂王浆对大鼠体重的影响Table 1 Effects of royal jelly on body weight of rats
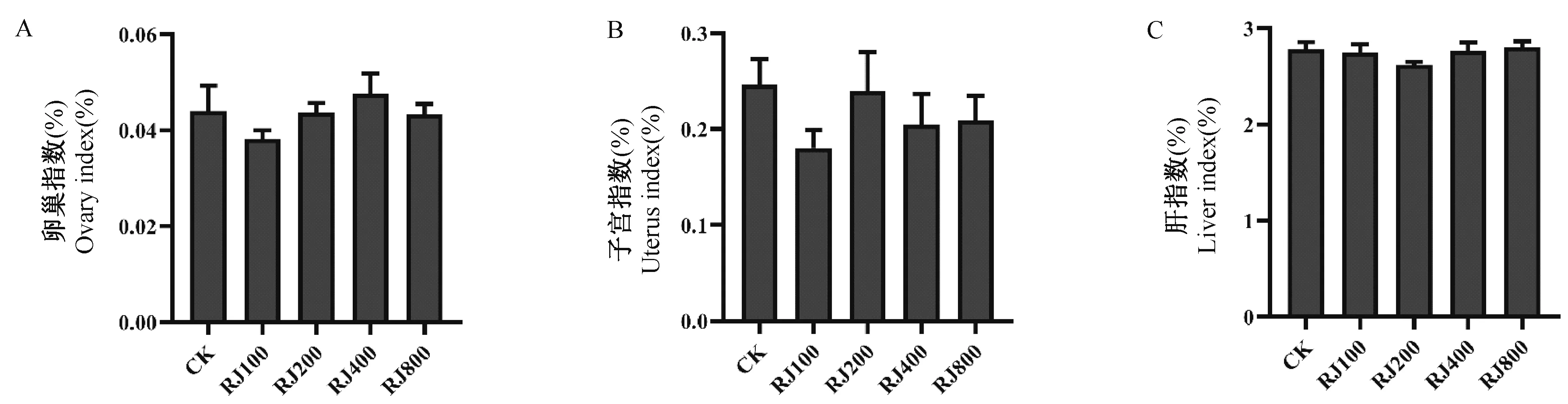
图2 蜂王浆对大鼠器官指数的影响Figure 2 Effect of royal jelly on organ index of rats
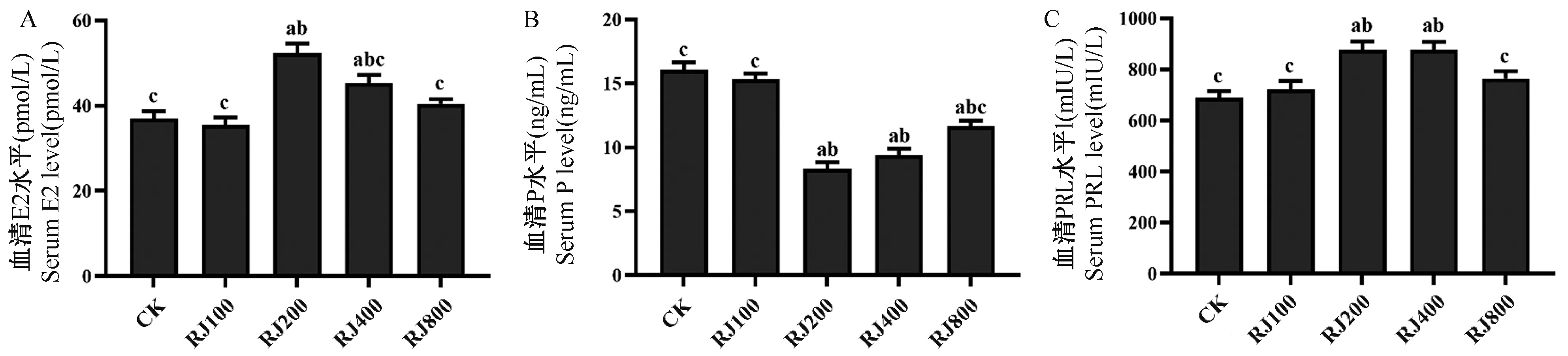
图3 蜂王浆对大鼠血清激素的影响Figure 3 Effect of royal jelly on serum hormones of rats

图4 大鼠乳腺组织切片Figure 4 Mammary gland sections of ovariectomized virgin rats
由各组大鼠乳腺导管直径结果知,与CK 组相比,RJ100、RJ200、RJ400 和 RJ800 组大鼠导管直径显著增大,其中RJ100 组显著低于RJ200、RJ400 和RJ800 组,且后3 组之间无显著性差异(图5)。

图5 蜂王浆对大鼠乳腺导管直径的影响Figure 5 Effect of royal jelly on the diameter of mammary duct in rats
3 讨论
3.1 蜂王浆对雌性未孕大鼠生长指标的影响
灌服RJ 35 d 后,各组大鼠的体重都随着生长而增加,CK、RJ100、RJ200、RJ400、RJ800 组大鼠体重分别比实验第 1 天增加了 8.27%、5.02%、3.93%、3.99%、2.16%。有研究表明,RJ 能促进小鼠褐色脂肪组织代谢产热,增加能量消耗,对肥胖、脂肪肝、代谢紊乱等疾病具有改善作用[23-24]。因此,口服高剂量RJ 可能对减轻肥胖有辅助作用。MRJPs 可加速雌性大鼠青春期的发生,促进卵泡发育[13],但在本实验结果中未发现RJ 对大鼠卵巢指数有明显的影响。而在RJ 类雌激素样活性物质的研究中得出,摄入RJ 后使子宫上皮细胞高度略有增加,而对子宫重量没有影响[12],本研究中未探究子宫上皮细胞高度,但子宫重量不变是与之前研究结果保持一致的。RJ 的弱雌激素作用可能对卵巢和子宫结构都有有益影响[17]。
3.2 蜂王浆对雌性未孕大鼠血清激素水平的调控
乳腺组织的发育受多种性腺激素和生长因子的调控,如 E2、P、PRL、生长素(GH)等[25]。其中 E2能够刺激乳腺导管生长和性成熟阶段乳腺导管的生成,血清E2 浓度还可作为评价下丘脑-垂体-生殖腺轴功能的指标之一[26-27]。
本实验的研究结果显示,当RJ 摄入量为100 mg/(kg·d)(RJ100 组,低剂量)时大鼠血清 E2 水平与CK 组无显著性差异,且该剂量与人体正常消耗的 RJ 的量(1 g/kg)相关[22]。然而,RJ200 组和RJ400 组大鼠血清E2 的水平较 CK 组(CK:37.03 pmL/L)E2 水平升高41.29%和22.48%,表明补充中、高剂量RJ 后,机体内血清E2 水平显著上升,表现出雌激素活性,这与之前的研究结果相一致[17]。提示当RJ 摄入量达到200 mg/(kg·d)(RJ200 组,中等剂量)和400 mg/(kg·d)(RJ400 组,高剂量)时,可提高大鼠血清中E2 水平,因此,过多的摄入RJ 可能会提高处于能量储备高度敏感期的青春期女性的E2 水平[28],进而促进生殖器官发育。
大鼠血清P 也是一种非常重要的性腺激素,可促进乳腺小叶的形成和腺泡的发育[27]。实验结果显示,除 RJ100 组外,RJ200、RJ400、RJ800 组大鼠血清P 水平较CK 组(CK:16.45 ng/mL)显著降低,分别为:50.19%、41.53%、27.44%。乳腺是内分泌激素的靶器官,当体内E2 和P 水平发生周期性分泌失调,即E2 水平绝对或相对升高、P 水平不足时,容易导致乳腺增生的发生[29]。那么长期摄入中、高剂量RJ 有可能会促进乳腺组织过度发育,甚至发生乳腺增生。研究人员发现,机体内PRL 水平升高会对乳腺组织造成一定的刺激,还可通过抑制黄体期黄体酮的分泌,导致雌孕激素比例失调[30]。结果显示,当雌性大鼠摄入RJ 的量为200 mg/(kg·d)和400 mg/(kg·d)时,大鼠血清 PRL 水平较 CK 组(CK:688.87 mlU/L)分别升高27.48%和27.32%,而摄入 100 mg/(kg·d)时,对血清 PRL 无影响。因此,当RJ 摄入量超过低剂量2 倍甚至更高时,可能会对性成熟初期大鼠乳腺组织发育及内分泌系统造成不利影响。
3.3 蜂王浆对雌性未孕大鼠乳腺发育及乳腺组织形态的影响
青春期后,机体内激素水平逐渐提高,乳腺导管系统迅速生长扩张,乳腺开始发育[31]。本研究中乳腺组织切片病理检查结果显示,与CK 组(CK:57.87 μm)相比,四个剂量组大鼠的乳腺导管直径分别增加了 16.43%、47.49%、45.34%、55.04%。乳腺组织切片显示,CK 组存在极少量腺导管组织,且导管上皮细胞排列整齐,表明性成熟初期雌性大鼠乳腺组织发育正常。补充RJ 后,RJ100 组乳腺组织中可见零星导管,并出现乳导管上皮轻微增厚的变化;RJ200、RJ400、RJ800 组乳腺组织中导管明显增多,并可见散在的乳腺小叶存在,其中RJ800 组最为明显,可发现该组乳腺组织中总导管的数量及管腔明显扩张。大鼠乳头直径结果中,与CK 组(CK:1.13 mm)相比,RJ100、RJ200、RJ400、RJ800 组乳头直径分别增加1.89%、7.22%、1.98%、4.8%,与乳腺组织切片结果基本保持一致。表明摄入高剂量RJ 可能会促进雌性未孕大鼠的乳腺发育并促使乳腺导管数量增多。
RJ 通过与雌激素受体(ERs)相互介导而表现出雌激素活性,可导致细胞增殖和基因表达的改变[32]。Suzuki 等[12]研究表明 RJ 中四种活性物质10-HDA、10-H2DA、2-DEA、24-MET 可优先结合ERβ 来发挥雌激素作用。因此,当RJ 摄入过多时,四种活性物质含量增多,这可能是导致大鼠血清E2水平和导管数量增多的原因[12]。超高剂量组(800 mg/(kg·d))的血清E2 水平与对照组无明显差异,可能是因为RJ 本身的剂量依赖效应导致的。
4 结论
本文是首次研究RJ 对雌性未孕大鼠乳腺组织发育的影响。研究发现,每天摄入100 mg/kg 的RJ对雌性未孕大鼠血清E2、P、PRL 水平,乳腺组织形态及生长指标无影响,能够有效发挥RJ 的多种生物学活性功能,提示100 mg/(kg·d)可能是雌性未孕大鼠摄入RJ 的最佳剂量;但每天摄入RJ 达到200、400、800 mg/kg 时,可不同程度上提升雌性未孕大鼠血清E2、PRL 水平,降低血清P 水平,促进乳腺组织发育,且呈剂量依赖效应[33]。这些影响可能部分归因于RJ 所具有的雌激素活性和提高繁殖性能的功能[12-13],但其中确切的作用机制还有待进一步研究。
综上,由于内分泌功能失调(E2 升高、P 下降以及PRL 升高)可能会导致多种内分泌功能紊乱性疾病的发生,特别是乳腺增生的发生与发展。因此,处于青春期的女性或本身内分泌功能紊乱的患者应在医生的指导下正确食用RJ,以免过量摄入对机体造成不利影响。