羊骨胶原肽对大鼠腹腔巨噬细胞免疫能力的影响
张慧琴霍乃蕊冀霞段卓马林峰古少鹏
(山西农业大学动物医学学院,山西晋中 030801)
我国为畜牧大国[1],羊骨资源十分丰富,但其生物利用率极低,多用于动物饲料的添加[2]。羊骨营养丰富,蛋白含量约为15.4%,但90%以上的羊骨蛋白为生物利用度很低的胶原蛋白[2-3]。通过酶解制成羊骨胶原多肽(sheep bone collagen peptide,SBCP),不仅可提高生物利用度[4-5],而且赋予了其独特的生理功能,如抗氧化[6]、免疫调节[7]、改善松质骨[8]等。
巨噬细胞是一种多功能细胞[9],几乎存在于所有组织,构成机体免疫的第一道防线,是炎症反应的核心细胞[10]。巨噬细胞受到细菌脂多糖(lipopolysaccharide,LPS)刺激后,释放炎症因子如TNF-α、IL-6、IL-1 和 IFN-γ 等,产生 NO、活性氧等一系列炎症介质,激活 TLRs、NF-κB、MAPK 等信号通路[11],参与机体的炎症级联反应[12]。
前期研究表明,SBCP 可增强大鼠的免疫功能[7]。本研究旨在探究SBCP 对大鼠腹腔巨噬细胞体外吞噬活性、代谢活力、炎症因子释放能力等免疫功能的影响;同时以LPS 刺激大鼠腹腔巨噬细胞,建立炎症免疫调节的细胞模型,探究SBCP 对炎症的免疫调节作用,为SBCP 开发为免疫调节剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
30 只 2 ~ 3 月龄 SPF 级 SD 大鼠,体重(203 ±20)g,雌雄兼用购自中国食品药品检定研究院(大兴)【SCXK(京)2017-0005】。饲养于山西农业大学动物实验室【SYXK(晋)2020-0003】,维持饲料购自山西医科大学动物实验中心。自由饮水,控制环境温度为(22 ± 2)℃,相对湿度40% ~ 60%,昼夜交替各12 h,其它环境条件符合GB14923-2001 的要求。本试验方案符合山西农业大学动物护理与使用委员会的要求(SXAU-EAW-2020SD0201)。
1.1.2 主要试剂与仪器
羊骨胶原肽购自内蒙古锡盟肽好,蛋白含量为98.78%,其中含90.78%分子量 ≤ 1000 Da 的肽,6.89% 羟 脯 氨 酸。RPMI-1640 基 础 培 养 液(Hyclone)、脂多糖(索莱宝,北京)、胎牛血清(ScienCell,美国)、肿瘤坏死因子(Tumor necrosis factor-α,TNF-α) 和白介素 6(Interleukin-6,IL-6)ELISA 试剂盒购自江苏酶免;RT-PCR 及 SYBRTMPremix Ex TapTMⅡ试剂为TaKaRa 产品等。
311 型 CO2培养箱(Thermo,美国);SpectraMax M5 酶标仪(Molecular Devices,美国);StepOnePlus实时荧光定量PCR 仪(ABI,美国)等。
1.2 方法
1.2.1 大鼠腹腔巨噬细胞的制备及分组处理
大鼠腹腔巨噬细胞的提取参照Petinatti 等[13]的方法,离心(1500 r/min,5 min)所得沉淀即腹腔巨噬细胞,加入RPMI-1640 完全培养基(含10%胎牛血清和1%青霉素-链霉素-庆大霉素混合溶液)重悬细胞,调节细胞浓度至每毫升2 × 106个。37℃、5% CO2培养至细胞贴壁,弃掉培养液,无血清培养基洗去未贴壁细胞即得纯化的巨噬细胞。
96 孔板,每孔接种2 × 105个巨噬细胞,培养至贴壁,更换RPMI-1640 完全培养基、加入SBCP(PBS溶解)和/或LPS 后,用完全培养基补充至200 μL。SBCP 组分别加入终浓度为 10、102、103、104、105μg/mL的 SBCP;LPS + SBCP 组在加入上述浓度SBCP 的同时加入 10 μg/mL 的 LPS。所有处理组每个浓度设置3 个复孔,并设置阴性对照孔(只含巨噬细胞)、炎症模型孔(巨噬细胞 + 10 μg/mL 的LPS)和调零孔(只含培养基)。
1.2.2 巨噬细胞代谢活力及吞噬活性的测定
各组细胞培养12 h 后,弃去培养液,每孔加入10 μL MTT(5 mg/mL)和 90 μL 完全培养基,孵育4 h,加入100 μL DMSO,缓慢震荡10 min,酶标仪490 nm处测定吸光度值(OD490nm)。巨噬细胞吞噬中性红的测定参照左爱玲[7]的方法进行。
1.2.3 巨噬细胞炎性介质和炎性因子分泌量的测定
收集各组细胞上清液,参考Kim 等[14]的方法测定其中炎性介质NO 的含量,按试剂盒说明测定其中炎性因子 TNF-α、IL-6 的含量。
1.2.4 巨噬细胞总RNA 的提取及qRT-PCR
6 孔板,每孔接种2 × 106个巨噬细胞,培养至贴壁,更换 RPMI-1640 完全培养基,加入 SBCP 和/或LPS 后,用完全培养基补充至3 mL。参照田胜男等[15]的方法提取巨噬细胞RNA,微量紫外分光光度计测定浓度。RT-PCR 参照李杰等[16]的方法进行。qRT-PCR 按照TaKaRa 试剂盒说明建立总体积为10 μL 的反应体系,程序:95℃ 10 min;95℃ 15 s,60℃ 30 s,72℃ 10 s,40 个循环;插入熔解曲线,60℃ 1 min,95℃ 15 s。反应结束后,以 GAPDH 为内参基因,2-△△Ct计算TLRs 通路相关基因在巨噬细胞中mRNA的表达量。巨噬细胞TLR4 等引物序列(上海生工合成)及预期产物大小见表1。将qRT-PCR 产物送至生工(上海)进行测序,确保其为目的基因片段。
1.3 统计学分析
SPSS 26.0 对试验数据进行单因素方差分析,多重比较使用LSD,以平均值± 标准差(±s)表示,GraphPad Prism 8.0 绘制柱状图,P< 0.05 为差异具有统计学意义。
2 结果
2.1 SBCP 对巨噬细胞代谢活力和吞噬活性的影响
MTT 法中,巨噬细胞的代谢活力与OD490nm值呈正相关,SBCP 各剂量组除10 μg/mL 外均极显著增强巨噬细胞代谢活力(P< 0.01),且呈剂量依赖性。经LPS 诱导后,巨噬细胞代谢活力极显著增强(P<0.01),SBCP 各剂量组均可抑制其代谢活力,以102μg/mL 效果最佳(图1A)。在中性红吞噬试验中,OD540nm值越大,巨噬细胞的吞噬活性越强,不经LPS刺激的正常巨噬细胞,SBCP 浓度越大,巨噬细胞的吞噬功能越强;经LPS 刺激后,其吞噬活性极显著增强,SBCP(102~104μg/mL)的加入则起到极显著的抑制作用(P< 0.01),以103μg/mL 效果最佳(图1B)。
2.2 SBCP 对巨噬细胞炎性介质和炎性因子分泌量的影响
SBCP 各剂量组均可促进巨噬细胞炎性介质NO(图2A)和炎性因子 TNF-α(图2B)、IL-6(图2C)的分泌,且呈剂量依赖性,浓度为105μg/mL时,上述物质的分泌量与 LPS 组无显著性差异(P> 0.05)。

表1 TLRs 通路各基因的qRT-PCR 引物序列及预期产物大小Table 1 Primer sequences and the expected size of qRT-PCR product of genes in TLRs pathway
经 LPS 诱导,巨噬细胞的 NO,TNF-α 和 IL-6 分泌量极显著升高(P< 0.01),不同剂量的SBCP 均可抑制上述炎性介质和炎性因子的分泌,均以103μg/mL 效果最佳。
2.3 SBCP 对巨噬细胞内 TLRs 通路相关基因mRNA 表达量的影响
不同剂量的SBCP 均可上调巨噬细胞中TLR4(图 3A)、Nf-κBp65(图 3C)、MyD88(图 3D)、TRAF6(图3E)和 TNF-α(图 3F)mRNA 的表达量,并下调其负性调控因子SIGIRR(图3B)mRNA 的表达量,且均呈剂量依赖性。
经 LPS 诱 导, 巨 噬 细 胞 TLR4、 Nf-κBp65、MyD88、TRAF6 和 TNF-α mRNA 的表达量极显著升高(P< 0.01),SIGIRR mRNA 的表达量极显著降低(P< 0.01)。LPS+SBCP 组中,不同剂量的 SBCP 对TLRs 通路上述相关基因表达则呈反向调节,103μg/mL 的 SBCP 极显 著下 调 Nf-κBp65、 TRAF6、TNF-α mRNA 的表达量(P< 0.01),102μg/mL 的SBCP 极显著下调 MyD88 mRNA 的表达量(P<0.01),104μg/mL的 SBCP 使 TLR4 的表达极显著下降,使SIGIRR mRNA 表达极显著上升(P< 0.01)。
3 讨论
炎症反应过程中,机体组织中的巨噬细胞首先与异物接触而活化,分泌并释放各种炎性介质和炎性细胞因子,招募单核细胞、嗜中性粒细胞等到达炎灶,吞噬降解细菌、递呈抗原,激活Th、Tc 以及B淋巴细胞,辅助激活特异性免疫应答,在抗感染、抗肿瘤免疫中发挥作用[17]。炎症是一种保护性的生理反应,反应初期,炎性介质和炎性因子的适量释放有助于机体对抗炎症反应,过量释放则加重炎症反应,造成机体组织损伤。本研究10 ~104μg/mL SBCP 可增强巨噬细胞的吞噬活性和代谢活性,促进TNF-α、IL-6 等炎性因子和炎症介质NO 的释放,但105μg/mL 的SBCP 刺激巨噬细胞时上述指标变化与LPS 差异都不显著,所以在实际应用中应当控制SBCP 的用量,适当浓度可发挥免疫增强作用,浓度过高则可能诱发炎症反应。
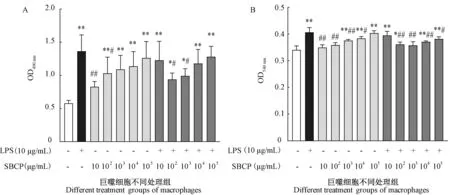
注:“-”代表不加 LPS,“+”代表加 LPS;与阴性对照组比,*P< 0.05,∗∗P< 0.01;与炎症模型组相比,#P< 0.05,##P< 0.01。(下图同)。图1 SBCP 对巨噬细胞代谢活性及吞噬活性的影响Note. “-” means no LPS. “+” means adding LPS. Compared to the nagative control group, *P< 0.05, ∗∗P< 0.01. Compared to the inflammatory model group, #P< 0.05, ##P< 0.01. (The same in the following figures)Figure 1 Effects of SBCP on metabolic activity and phagocytic function of macrophages with or without the stimulation by LPS
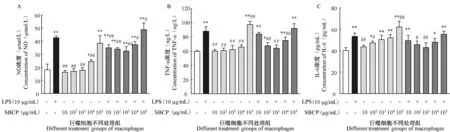
图 2 SBCP 对巨噬细胞 NO、TNF-α 及 IL-6 分泌量的影响Figure 2 Effects of SBCP on NO, TNF-α and IL-6 production by macrophages
炎症反应初期 NO、TNF-α、IL-6 的分泌量是判断炎症模型是否建立成功的标志[18-19]。经LPS 活化的巨噬细胞,炎症介质NO 及炎性因子TNF-α、IL-6 等的分泌量极显著增加,与姜文清等[20]、庞逸敏等[21]的研究结果一致,说明LPS 诱导的巨噬细胞炎症模型建立成功。LPS+SBCP 组中,不同剂量的SBCP 对巨噬细胞的代谢活力和吞噬活性均起到抑制作用,同时可降低炎性因子TNF-α、IL-6 和炎症介质NO 的释放,说明SBCP 可通过抑制巨噬细胞的代谢和吞噬活性,降低炎症因子和炎症介质的分泌发挥抗炎作用。
TLRs 是介导炎症反应的主要信号通路[22]。LPS 与巨噬细胞表面的Toll 样受体相互作用,进一步激活 NF-κB 通路[23],NF-κB 转移至细胞核内,启动炎性因子TNF-α 等基因的转录和翻译,引发炎症反应[24]。LPS 刺激下,负性调控因子 SIGIRR 与TLR4 受体复合物结合,抑制 TLRs 信号通路的转导,从而抑制炎症的发生[25]。qPCR 结果表明,不同剂量的SBCP 均可上调巨噬细胞TLRs 通路相关基因mRNA 的表达量,下调SIGIRR mRNA 的表达量,说明SBCP 可通过激活TLRs 通路增强机体免疫功能。LPS 诱导的炎症模型中,巨噬细胞TLRs 通路相关基因mRNA 的表达量极显著升高,SIGIRR mRNA的表达量极显著降低,与Brady 等[26]的研究结果一致。LPS 诱导,加入不同剂量的SBCP 对TLRs 通路相关基因及SIGIRR 表达呈反向调节,说明SBCP 可通过抑制TLRs 通路相关基因的表达,促进负性调控因子的表达从而发挥抗炎作用。
综上可知,SBCP 可通过TLRs 信号通路对炎症反应发挥双向调节作用,剂量为10 ~104μg/mL 可增强巨噬细胞的免疫能力,105μg/mL 时诱导巨噬细胞释放大量炎性介质,引起炎症反应。而对LPS诱导的炎症反应,SBCP 各剂量组均发挥抑制作用,具有一定的抗炎效果。