羊骨胶原肽钙螯合物对去卵巢大鼠肾组织病变的改善作用
冀霞段小超马林峰韩克光霍乃蕊
(山西农业大学动物医学学院,山西晋中 030801)
雌激素是维持雌性动物内环境稳态必不可少的信号分子[1]。雌激素缺乏易引起机体氧化应激[2],导致机体氧化与抗氧化作用失衡,从而诱导炎症和脂质过氧化,造成细胞毒性,危害机体健康[3]。传统的雌激素替代疗法由于致癌风险,已逐渐被临床治疗所摒弃[2],因此,如何有效改善雌激素缺乏引起的氧化应激已成为当前研究的热点。
我国羊骨资源丰富,可通过酶解获得大量生物活性肽[4-5],但目前羊骨副产品多限于制作低值的动物饲料或骨胶,大部分被填埋浪费[6]。前期研究证实羊骨胶原肽钙螯合物(collagen peptide chelated calcium,CPCC)比雌激素更安全[7],可有效抑制去卵巢大鼠骨质疏松的发生[8]。雌激素替代疗法容易诱发子宫内膜癌和乳腺癌[2],相比之下,CPCC 具有稳定性好、生物效价高、安全无毒副作用等优点[9]。
通过观察去卵巢大鼠肾形态学变化、测定肾GSH-Px、T-SOD、T-AOC 和 MDA 氧化应激指标以及血清炎性因子 IL-2、TNF-α 和 IFN-γ 的含量,探讨雌激素缺乏与肾组织损伤的关系;qRT-PCR 检测CPCC 对去卵巢大鼠JAK/STAT 信号通路相关基因mRNA 的表达量,揭示CPCC 改善雌激素缺乏所致肾氧化应激和炎性病变的相关作用机制,为雌激素缺乏相关疾病的防治提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
32 只 8 周龄体重为(203 ± 20)g 的 SPF 级雌性SD 大鼠,购自中国食品药品检定研究院(大兴)【SCXK(京)2017-0005】,24 只行双侧卵巢切除术[10],8 只切除卵巢周围等量脂肪,各组大鼠分笼饲养于山西农业大学动物实验室【SYXK(晋)2020-0003】。实验期间给予大鼠充足的维持型饲料,购自山西医科大学动物实验中心,自由饮水,温度为(22 ± 2)℃,相对湿度60% ~ 65%。所有操作均符合山西农业大学实验动物伦理委员会要求(IACUC审查号:SXAU-EAW-2020SD0201)。
1.1.2 主要试剂与仪器
CPCC 按照实验室前期方法制备[11],丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒均购自南京建成生物工程研究所。IL-2、TNF-α 和 IFN-γ 试剂盒购自北京华英生物研究所。qRT-RCR 及SYBRTMPremix Ex TapTMII 试剂购自大连宝生物工程有限公司。
CFX Maestro 实时荧光定量PCR 仪购自上海伯乐生命医学产品有限公司,高级智能全封闭组织脱水机(ASP 200S)购自上海博讯医疗生物仪器股份有限公司,生物组织包埋机(KD-BM)购自浙江科迪仪器设备有限公司。
1.2 方法
1.2.1 动物分组及实验干预
去卵巢大鼠手术2 周后随机分为模型组(model)、CPCC 高(CPCC-H)和低(CPCC-L)剂量组,CPCC-H 和CPCC-L 组灌胃剂量分别为5 g/(kg·d)和1 g/(kg·d),模型组和假手术组灌胃等体积蒸馏水,连续8 周。
1.2.2 肾组织形态学观察及取材
最后一次给药结束后禁食12 h,眼眶后静脉采血,脱颈处死大鼠,收集肾组织,部分用10%甲醛溶液固定,24 h 后修剪为约3 mm3的组织块,二甲苯浸渍透明,石蜡包埋,切片厚度5 μm,蒸馏水展片,44℃烤片,常规苏木精伊红(hematoxylin-eosin,H&E)染色[12],中性树胶封片,10 × 40 倍镜下拍照,光学显微镜观察肾组织形态学变化并对肾组织切片行病理组织学评分,评分标准如下:肾小球萎缩(0 ~ 5 分);红细胞浸润(0 ~ 5 分);淋巴细胞浸润(0 ~ 5 分);肾小管内形成管型(0 ~ 5 分);肾小管上皮细胞脱落、坏死(0 ~5 分)。
1.2.3 抗氧化指标的测定
肾组织(g)和生理盐水(v)以1 ∶9的比例冰浴混合,充分研磨,瞬时离心收集上清,制备10%肾组织匀浆,-20℃保存备用。采用比色法检测T-AOC 和GSH-Px 活力,硫代巴比妥酸法测定MDA 含量,羟胺法测定T-SOD 活性,均按照试剂盒说明操作。
1.2.4 炎性因子水平测定
采用酶联免疫竞争法检测血清中IL-2、TNF-α和IFN-γ 的含量。参照说明书梯度稀释标准品并测定OD450nm值,建立标准曲线拟合方程。检测大鼠血清样本OD450nm值,代入拟合方程得出各组大鼠血清中 IL-2、TNF-α 和 IFN-γ 的含量。
1.2.5 qRT-PCR 检测JAK/STAT 信号通路相关基因mRNA 表达
设计引物序列,并在NCBI 数据库中比对大鼠JAK2、STAT1、STAT3 基因及内参基因 GAPDH 的目标序列(见表1)。将PCR 产物进行2%琼脂糖凝胶电泳,并送交上海生物工程股份有限公司测序。
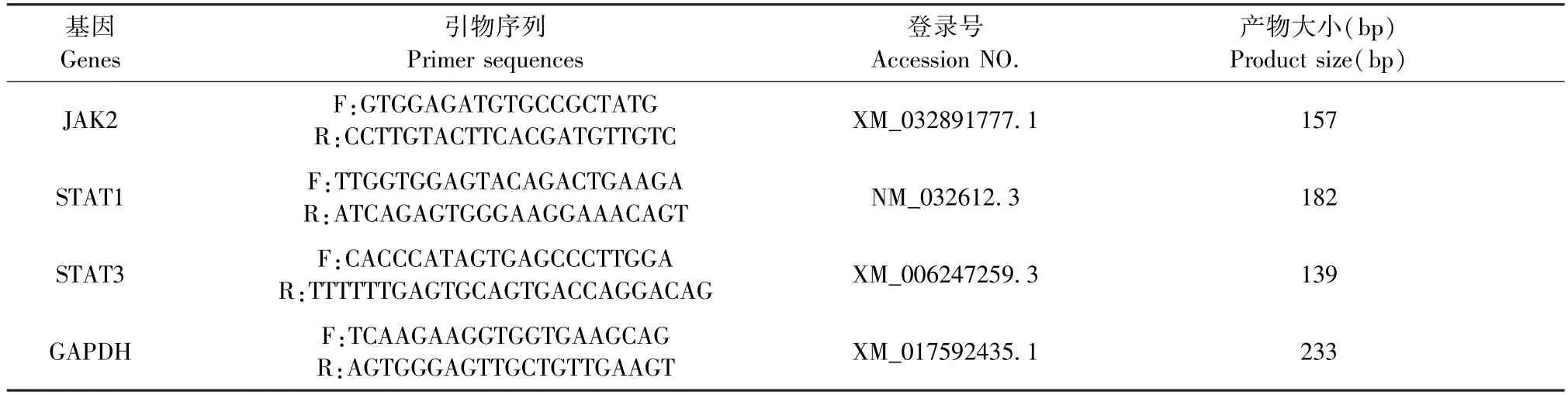
表1 qRT-PCR 引物序列及产物大小Table 1 qRT-PCR primer sequences and product sizes
提取大鼠肾总RNA[13],紫外分光光度计测定总RNA 纯度及浓度,选择OD260/280比值在1.8 ~2.0间的总 RNA 进行反转录[14]。建立 qRT-PCR 扩增体系:SYBR® Premix Ex TaqTMII(2 ×)5 μL、ROX Reference Dye II(50 ×)0.2 μL、PCR 上游序列(10 μmol/L)0.3 μL、PCR 下游序列(10 μmol/L)0.3 μL、cDNA 1 μL、ddH2O 补充至 10 μL。反应条件为:95℃预变性10 min;95℃变性15 s,60℃退火30 s,72℃延伸10 s,40 个循环;插入熔解曲线,95℃ 15 s;60℃ 1 min;95℃ 15 s。
1.3 统计学分析
利用统计学软件SPSS 26.0 对实验数据进行单因素方差分析,LSD 进行多重比较,实验数据以平均值± 标准差(±s)表示。抗氧化指标所有结果均以牛血清白蛋白为标准[15]归一化为蛋白质含量,各项指标独立检测。qRT-PCR 结果以相对表达定量(relative quantity,RQ)表示。计算方式如下:RQ=2-△△CT;△CT=目的基因 CT 值-内参基因 CT 值;△△CT=实验组△CT-对照组△CT。
2 结果
2.1 肾组织形态学变化
模型组较假手术组肾小球稍有萎缩,肾小囊壁层上皮细胞崩解。肾小管管腔形成管型,上皮细胞脱落、坏死,间质毛细血管散在大量红细胞和淋巴细胞(图1A、B)。CPCC 干预可以显著减轻肾病变(图1C、D)。总体来说,假手术组得分极显著低于模型组(P< 0.01),CPCC 各剂量组得分极显著低于模型组(P< 0.01)(图1E)。
2.2 CPCC 对去卵巢大鼠抗氧化能力的影响
按照试剂盒说明,酶的百分抑制率在45% ~55%间,T-SOD 和 GSH-Px 的活力最强。由图2 知,当肾组织匀浆液浓度为0.2%和0.8%时,T-SOD 和GSH-Px 的百分抑制率在45% ~55%之间。因此,0.2%和0.8%为测定相应酶活性的最佳取样浓度。
由图3 可知,与假手术组相比,模型组T-SOD、GSH-Px 和T-AOC 水平极显著降低,MDA 含量极显著增加(P< 0.01);与模型组相比,CPCC 各剂量组T-SOD、GSH-Px 和T-AOC 水平均极显著增加,MDA含量极显著下降(P< 0.01)。
2.3 CPCC 对血清炎性因子的影响
按照试剂盒说明书操作,建立标准曲线拟合方程。IL-2 标准曲线拟合方程为:y=(A-D)/[1+(x/C)^B]+D,其中 A = 1.25373、B = 1.79750、C =354.53007、D=0.19753,r2=0.99685。TNF-α 标准曲线拟合方程为:y=(A-D)/[1+(x/C)^B]+D,其中A = 1.62753、 B = 1.46026、 C = 45.24075、 D =0.50353,r2= 0.99840。IFN-γ 标准曲线拟合方程为:y=(A-D)/[1+(x/C)^B]+D,其中A=1.56921、B = 1.13601、 C = 75.14627、 D = 0.11419,r2=0.99865。测定样本 IL-2、TNF-α 和 IFN-γ 的 OD值,代入标准拟合曲线得到其血清含量,如图4。与假手术组比,模型组 IL-2、TNF-α 和 IFN-γ 水平极显著增加(P< 0.01)。与模型组相比,CPCC 各剂量组IL-2、TNF-α 和 IFN-γ 水平极显著下降(P< 0.01)。
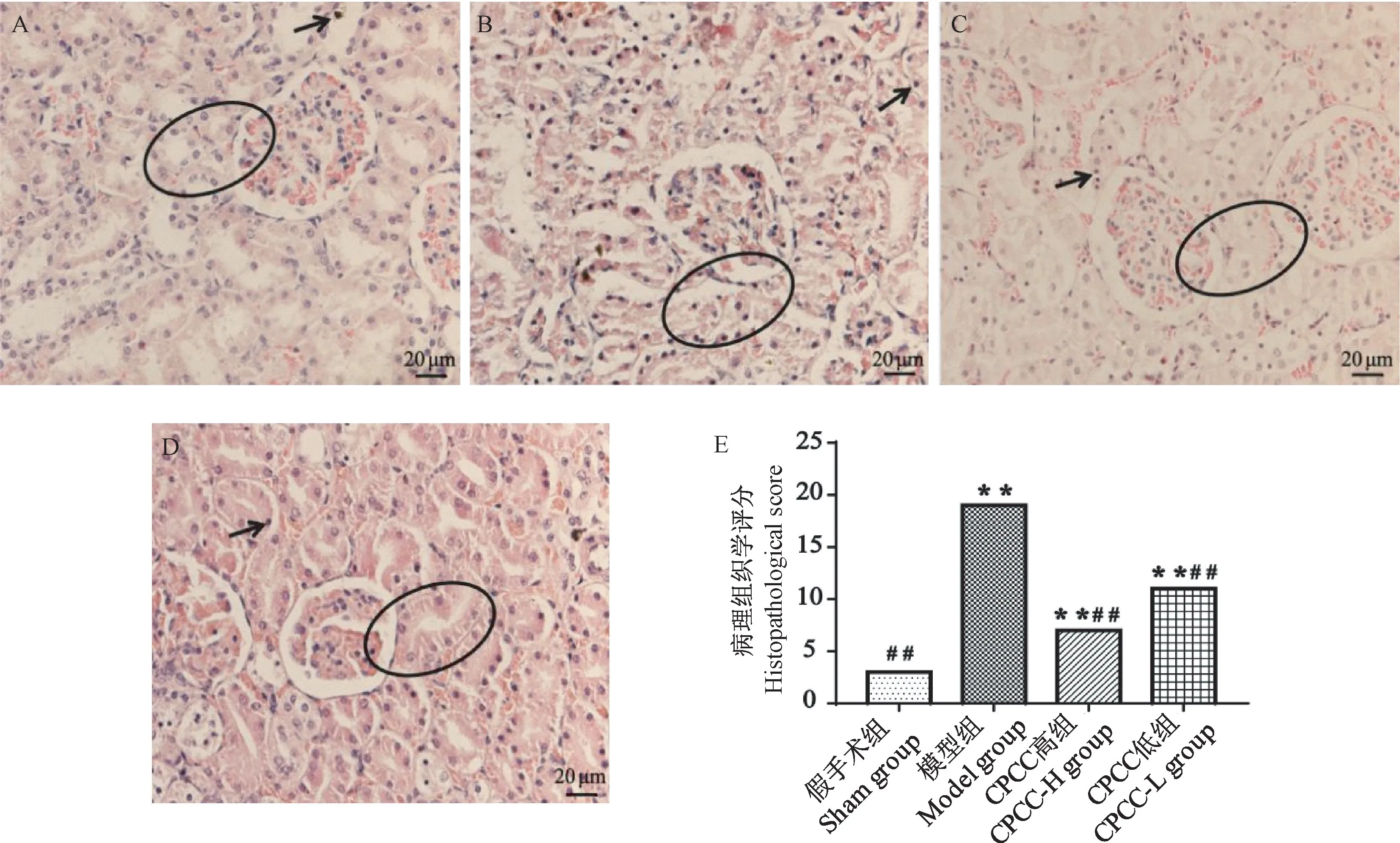
注:A:假手术组;B:模型组组;C:CPCC 高组;D:CPCC 低组;E:病理组织学评分;箭头表示淋巴细胞浸润;与假手术组相比,∗∗P < 0.01;与模型组相比,##P < 0.01。(下图同)图1 大鼠肾组织病理学切片及评分Note. A. Sham group. B. Model group. C. CPCC-H group. D. CPCC-L group. E. Histopathological score of kidney. Arrow indicating lymphocyte infiltration. Compared with sham group, ∗∗P < 0.01. Compared with model group, ##P < 0.01.(The same in the following figures)Figure 1 Pathologiclal sections and scores of rats kidney tissue
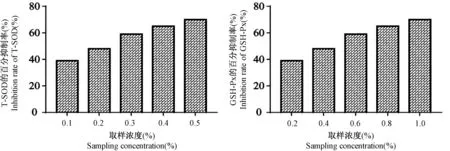
图2 肾组织匀浆液中T-SOD 和GSH-Px 的百分抑制率Figure 2 Inhibition rate of T-SOD and GSH-Px in kindey tissue homogenates
2.4 CPCC 对 JAK/STAT 信号通路相关基因mRNA 表达的影响
由图5A 可知,JAK2、STAT1 和 STAT3 基因的PCR 产物条带单一、明亮且无非特异性扩增,产物大小依次为157、182 和139 bp,与预期一致。测序结果表明各基因序列与基因标准序列同源性≥98%。由图5B-5D 可知,与假手术组相比,模型组JAK2、STAT1 和 STAT3 基因 mRNA 表达量均极显著增加(P< 0.01)。CPCC 各剂量组均能极显著抑制JAK2、STAT1 和 STAT3 基 因 mRNA 表 达 (P<0.01)。其中 CPCC 低组 JAK2 基因 mRNA 表达量极显著低于假手术组(P< 0.01);CPCC 高组STAT1基因mRNA 表达量与假手术组无显著性差异(P>0.05);CPCC 高组 STAT3 基因 mRNA 表达量极显著低于假手术组(P< 0.01)。
3 讨论
肾是全身毒性和氧化应激的靶点[16]。肾组织损伤后生成大量活性氧自由基,损伤肾小球基底膜和毛细血管、破坏细胞结构、造成脂质过氧化并产生MDA[17]。MDA 能破坏细胞膜和细胞酶系统,使抗氧化水平降低,导致对活性氧自由基的清除能力减弱,最终造成氧化应激[18-20]。本研究模型组大鼠肾抗氧化能力极显著下降,而MDA 含量极显著增加,肾组织淋巴细胞浸润,结构改变,血清中炎性细胞因子 IL-2、TNF-α 和 IFN-γ 水平极显著升高,与王海敏等[21]、钱珺等[22]、靳贝芳等[23]研究结果一致,说明雌激素缺乏可引起肾发生氧化应激和炎症反应。
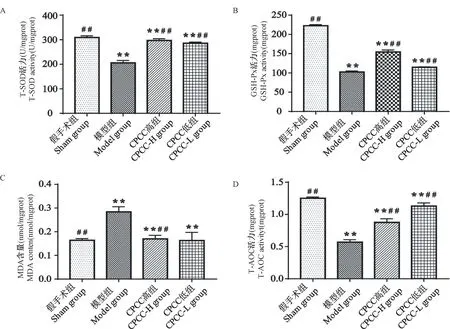
图3 各组大鼠肾组织抗氧化指标Figure 3 Antioxidant index of renal tissue in each group
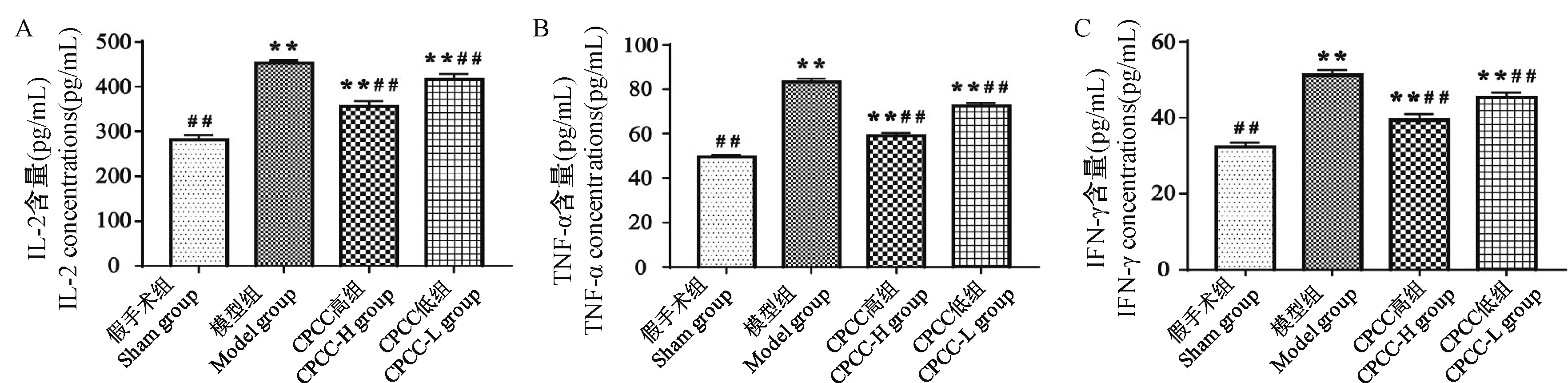
图4 各组 IL-2、TNF-α 和 IFN-γ 水平Figure 4 IL-2, TNF-α and IFN-γ levels in each group
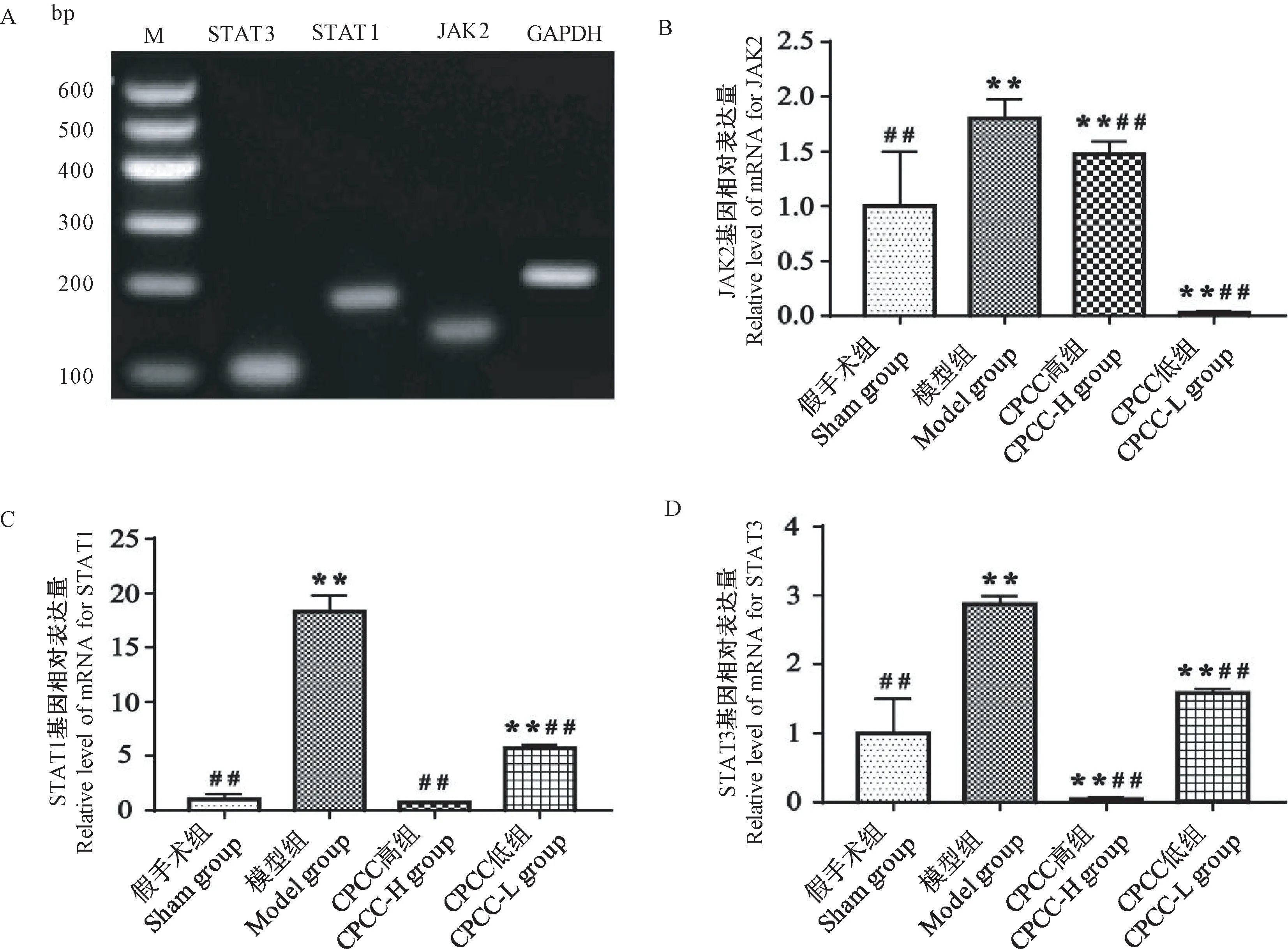
注:M:DL600 DNA marker。图5 JAK2、STAT1、STAT3 基因2%琼脂糖凝胶电泳及qRT-PCR 结果Note. M. DL600 DNA marker.Figure 5 JAK2, STAT1, STAT3 genes 2% agarose gel electrophoresis and qRT-PCR results
JAK/STAT 通路通过STAT 蛋白介导从质膜到细胞核的应激信号传导[24],主要由JAKs 蛋白家族和STATs 蛋白家族组成,磷酸化的JAKs 激活受体,形成STATs 停靠位点,STATs 与停靠位点结合并磷酸化,形成异源二聚体,进入细胞核参与基因转录,调节氧化应激、炎症反应等的发生发展[25]。Rai等[26]发现通过抑制JAK/STAT 信号通路相关基因的表达可以抑制大肠癌中的氧化/代谢应激。本研究模型组大鼠肾组织 JAK2、STAT1 和STAT3 基因mRNA 相对表达量均极显著高于假手术组,说明雌激素缺乏致肾氧化应激可导致JAK/STAT 信号通路激活,与他人研究结果一致[27-28]。去卵巢大鼠灌胃CPCC,各剂量组 JAK2、STAT1 和 STAT3 基因的mRNA 表达水平均极显著低于模型组,同时肾的抗氧化能力极显著增加,MDA 含量极显著下降,肾组织病变减轻,淋巴细胞浸润减少,说明CPCC 可通过下调JAK/STAT 信号通路相关基因的表达抑制雌激素缺乏引起的肾氧化应激和炎症反应。
卵巢切除常用于建立骨质疏松模型[29-30],本研究模型组大鼠经血清学指标和骨micro-CT 扫描证实发生了骨质疏松[9],说明雌激素缺乏不仅可引发骨质疏松,还可引起肾病变,CPCC 对松质骨[31]和肾病变都有改善效果。本研究发现CPCC 可能通过激活JAK/STAT 信号通路提高去卵巢大鼠肾的抗氧化能力,减轻肾病变,是比雌激素替代疗法更为安全的选择。