SRC 激酶和磷酸酶PP1γ2/PP2A 的相互作用对小鼠附睾精子成熟及运动的调控
吴文静张昕谭霞解道豪杨明华李亚辉
(云南农业大学动物科学技术学院,昆明 650201)
蛋白激酶和磷酸酶调控细胞内蛋白的磷酸化水平,已有的研究更多的是蛋白激酶对精子功能的调控,而磷酸酶对精子功能的调控研究报道较少,且在精子功能(如精子运动)调控中蛋白激酶与磷酸酶是否存在相互作用,其作用机制如何等均未被阐明。
在SRC 家族激酶(SRC family kinases,SFKs)中,最早发现的 SFKs 成员是 SRC 激酶[1-2]。Stival等[3]建立了Src基因敲除的小鼠模型,发现Src基因敲除的小鼠精子活力显著降低。进一步研究发现抑制SRC 激酶会抑制小鼠获能相关的酪氨酸磷酸化增加、改变精子运动性以及小鼠精子的顶体反应[4]。
Ser/Thr 磷酸酶在由未成熟精子变成成熟精子过程中发生磷酸化,并且与精子运动性有密切联系[5]。刘芳等[6]的研究表明小鼠精子中磷酸酶PP1γ2 和PP2A 对小鼠附睾精子成熟、运动性及精子获能具有重要的调控作用,表现出负调控的作用方式:即 PP1γ2 和 PP2A 活性高,精子运动性低,PP1γ2 和PP2A 活性低,则精子运动性高,但这种负调控机制至今不清楚。Signorelli 等[7]研究发现人精子中的PP1γ2 被抑制时,获能精子数显著增加。Ser/Thr 磷酸酶在获能过程中酶活性呈下降趋势,但其蛋白表达量不发生改变,这种磷酸酶活性的下降和随后苏氨酸磷酸化的增加可能是精子获能成功的重要条件。Krapf 等[8]研究发现SRC 激酶抑制剂SU6656 或SKI606 能够抑制小鼠精子获能及获能时发生的蛋白酪氨酸磷酸化,但Ser/Thr 磷酸酶抑制剂如 Okadaic acid 和 Calyculin-A 能够消除 SU6656或SKI606 对小鼠精子获能的抑制作用。表明Ser/Thr 磷酸酶抑制剂克服了SFKs 抑制剂对获能相关信号转导的阻碍,这些信号转导包括与精子获能相关的超激活运动[8]。鉴于精子运动性是保证精子获能的前提条件,且精子在获能过程中伴随着超激活运动,说明获能中的一些分子及事件可能对精子运动产生影响,因此认为:Ser/Thr 磷酸酶可能对精子的运动具有调控作用,且其作用可能与SRC 分子相关,这一观点在此之前并未得到证明。而且,磷酸酶对精子运动性的调控大多来自牛、犬、灵长类、仓鼠等物种的实验,在小鼠上仅报道过其对精子超激活运动的调节[9-13]。SRC 激酶参与小鼠精子获能的调控,Ser/Thr 磷酸酶是调控小鼠精子成熟、运动性获得的关键酶,但目前都是从单个分子角度研究对小鼠精子获能的调控,目前对Ser/Thr磷酸酶与SRC 激酶的关联性研究仅限于Krapf等[8]这篇关于精子获能的报道,Krapf 等[8]从精子获能相关的参数研究了这两者之间对小鼠精子获能的调控作用,而精子获能伴随着精子超激活运动的发生,所以SRC 激酶与Ser/Thr 磷酸酶可能会共同调控小鼠精子运动,为了获得其精子运动性的调控以及精子成熟机理,为此,本研究探索了SRC 激酶与Ser/Thr 磷酸酶之间的联系对小鼠精子运动的调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
本试验选用60 只8 ~12 周龄体重至少36 g 性成熟雄性清洁级昆明小鼠,由昆明医科大学【SCXK(滇)2020-0004】提供。所有小鼠饲养在昆明医科大学实验动物楼【SYXK(滇)K2020-0006】,饲养环境:室温(22 ± 3)℃,相对湿度 40% ~ 70%,12 h 循环灯光,自由取食饮水。按照云南农业大学生命科学伦理委员会批准的实验方案进行(审批号:202005011)。
1.1.2 主要试剂
洗精液:NaCl、 KCl、 KH2PO4、 MgSO4、 Glucose、Pyruvic acid、lactic acid、Hepes(获能液包含 CaCl2、NaHCO3、BSA)除 BSA 购自 Solarbio 公司,其它试剂均购自 Sigma 公司; SRC 抗体(Cell Signaling Technology,2108 s);phos-SRC 抗体(Cell Signaling Technology,59548 s); phos-Threonine 抗体(Cell Signaling Technology,#9386);PP1γ2 抗体(Abcam,ab134947);PP2A 抗体(Abcam,ab32104);sc-3052(Santa Cruz Biotechnology,sc-3052);SU6656(Med Chem Express,HY-B0789);洗精液参照文献Tateno等[14]的方法配制。
1.2 方法
1.2.1 不同获能时间对小鼠附睾头和附睾尾精子中苏氨酸磷酸化的影响
小鼠附睾精子在洗精液中游离出来后观察精子活力并计数,附睾头精子悬液不孵育直接提取蛋白,附睾尾精子悬液按照 0、10、30、60、90 min 时间梯度孵育然后进行Western Blot 分析。
1.2.2 SRC 激酶在小鼠附睾头和附睾尾精子中的存在形式
将小鼠附睾头和附睾尾精子直接提取蛋白,然后进行Western Blot 分析。
1.2.3 SRC 激酶与 PP1γ2 和 PP2A 的免疫共沉淀分析
SRC 激酶与 PP1γ2 和 PP2A 的相互作用通过免疫共沉淀分析,具体的实验操作步骤采用Stival等[3]的方法。
1.2.4 小鼠附睾头和附睾尾精子磷酸酶活性分析
采用Jin 等[15]的方法对小鼠精子中磷酸酶活性进行分析。
1.2.5 SRC 抑制剂及激活剂分别对小鼠附睾尾和附睾头精子磷酸酶活性和运动度影响
向小鼠附睾头和附睾尾精子悬液分别加入50 μmol/L sc-3052 和 50 μmol/L SU6656,具体的实验操作步骤采用Jin 等[15]的方法。
1.2.6 小鼠附睾头和附睾尾精子中SRC 激酶活性的分析
小鼠附睾精子在洗精液中游离出来后观察精子活力并计数,具体的实验操作步骤采用Leclerc等[16]的方法。
2 结果
2.1 不同获能时间对小鼠附睾头和附睾尾精子中苏氨酸磷酸化的影响
小鼠附睾尾精子中苏氨酸的磷酸化水平高于附睾头精子,并且小鼠附睾尾精子在0 min 就开始磷酸化(见图1)。结果表明,参与Ser/Thr 去磷酸化的Ser/Thr 磷酸酶在附睾头精子中比在附睾尾精子中更活跃。
2.2 SRC 在小鼠附睾头和附睾尾精子中的存在形式
附睾头精子中SRC 激酶的非磷酸化水平明显高于附睾尾精子。相反,在附睾头精子中磷酸化的SRC 激酶(Y416 位点)的水平明显低于附睾尾精子(见图2)。一般来说,非磷酸化的SRC 激酶代表没有或很少催化活性,而磷酸化的SRC(Y416 位点)具有较高的酶活性。因此,结果表明,SRC 激酶在附睾头精子中的活性低于附睾尾精子。
2.3 SRC 激酶与 PP1γ2 和 PP2A 的免疫共沉淀分析
当SRC 激酶抗体与精子悬液孵育时,可以沉淀SRC 激酶,并通过 Western Blot 检测到 PP1γ2(图3Aa)。相反,阴性对照组不加SRC 激酶抗体,通过Western Blot 没有检测到蛋白沉淀(图3Ab)。结果表明 SRC 激酶与 PP1γ2 相互作用。当 SRC 激酶抗体与精子悬液孵育时,可以沉淀SRC 激酶,并通过Western Blot 检测到 PP2A(图3Ba)。相反,阴性对照组不加SRC 激酶抗体,通过Western Blot 没有检测到蛋白沉淀(图3Bb)。这些结果表明SRC 激酶与PP2A 相互作用。
2.4 小鼠附睾头和附睾尾精子磷酸酶活性分析
为了确保准确的结果,分别用0.5 × 106和1.0× 106细胞检测了附睾头和附睾尾精子的磷酸酶活性。对比结果如图4 所示,表明无论精子细胞数量多少,附睾头精子的磷酸酶活性都明显高于附睾尾精子,差异具有显著性(P< 0.05)。
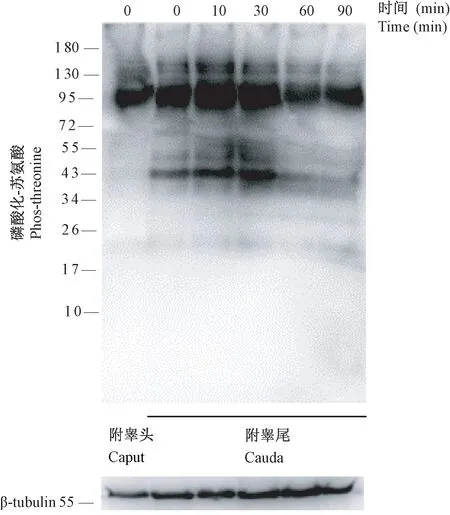
图1 不同获能时间对小鼠附睾头和附睾尾精子中苏氨酸磷酸化的影响Figure 1 Threonine phosphorylation in mouse sperm from the caput and cauda of epididymis

图2 SRC 与phos-SRC 在小鼠附睾头和附睾尾精子中的存在形式Figure 2 Present form of SRC in mouse sperm from the caput and cauda of epididymis
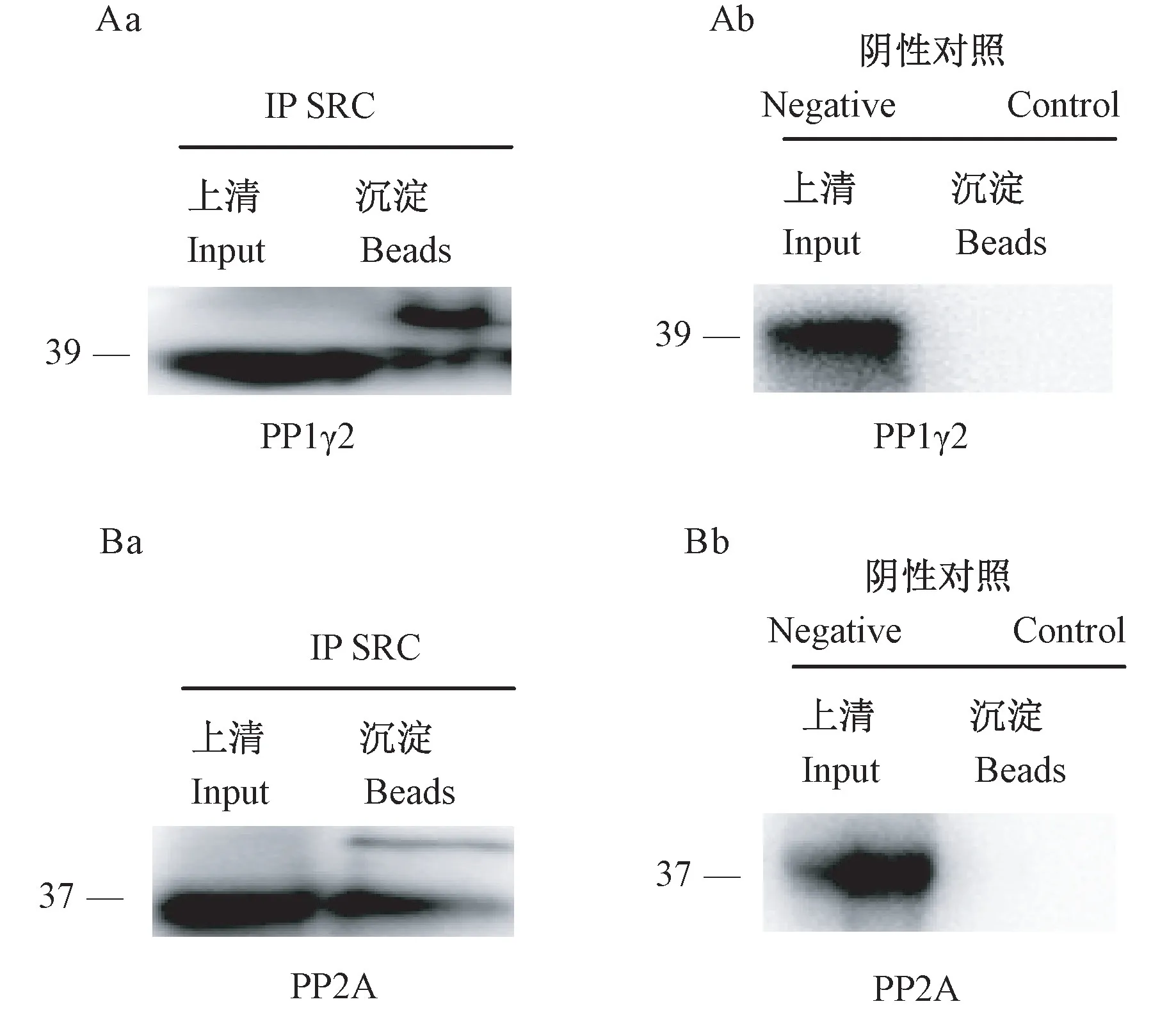
图3 SRC 与 PP1γ2 和 PP2A 的免疫共沉淀分析Figure 3 Co-immunoprecipitation analysis of SRC with PP1γ2 and PP2A
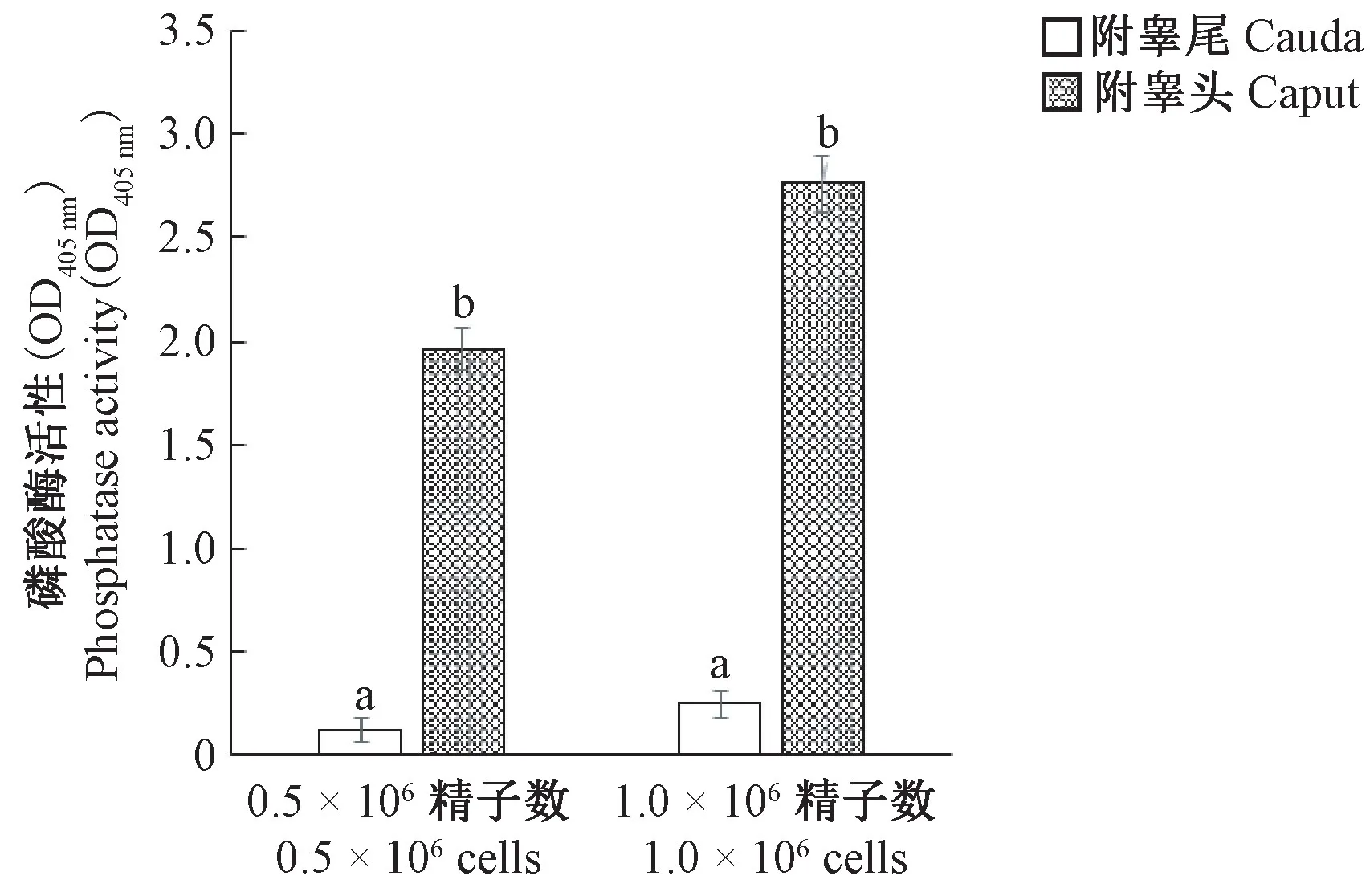
注:图中相同精子数条件下,与附睾尾比,bP< 0.05。图4 昆明小鼠附睾头和附睾尾精子磷酸酶活性分析Note. This is the same sperm count compared to caudal epididymis,bP< 0.05.Figure 4 Analysis of phosphatase activity in caput and cauda sperm of mouse epididymis
2.5 SRC 抑制剂对小鼠附睾尾精子磷酸酶活性和运动度的影响
对照组是成熟的附睾尾精子,当磷酸酶受到抑制或活性降低时,精子表现出较高的活力。然而,当SRC 激酶抑制剂SU6656 添加到附睾尾精子中孵育30 min,磷酸酶活性增加,而精子的运动度与对照组相比显著降低(P< 0.05)(见图5),表明SRC 激酶对磷酸酶有抑制作用,SRC 激酶通过抑制附睾尾精子的磷酸酶活性来调控精子运动度。这也表明,即使在精子成熟且运动活跃的附睾尾中,精子的运动度也是通过SRC 激酶、磷酸酶等某些酶活性的改变而可逆的。同时表明SRC 激酶、磷酸酶及其相互作用在调节精子运动中起着关键作用。
2.6 SRC 激活剂对小鼠附睾头精子磷酸酶活性和运动度的影响
对照组是运动度较低的附睾头精子,但磷酸酶活性较高。然而,将SRC 激酶的激活剂sc-3052 添加到附睾头精子中孵育30 min,磷酸酶活性降低,而精子运动度与对照组相比显著增加(P< 0.05)(见图6),说明与附睾尾精子不同,SRC 激酶在附睾头精子中不活跃或活性较低,并释放磷酸酶活性,导致精子不运动或运动度降低。在附睾头精子中添加sc-3052 可以提高SRC 激酶活性,随后降低磷酸酶活性,从而证实了这一推断。
2.7 sc-3052 对小鼠附睾头精子中SRC 激酶活性的影响
当SRC 激酶的底物enolase 与附睾头精子孵育时,enolase 组SRC 激酶活性明显高于非enolase 组。此外,在精子悬液中添加SRC 激酶激活剂sc-3052,SRC 激酶活性明显升高(见图7),说明SRC 激酶在附睾头精子中是不活跃或活性很低,被sc-3052 激活活性升高。
2.8 SU6656 对小鼠附睾尾精子中SRC 激酶活性的影响
当SRC 激酶的底物enolase 与附睾尾精子孵育时,enolase 组SRC 激酶活性明显高于非enolase 组。相反,在精子悬液中添加SRC 激酶抑制剂SU6656,SRC 激酶活性明显下降(见图8)。SRC 激酶在附睾尾精子中的活性高于附睾头精子(与图7 相比)。

注:与对照组比,bP< 0.05。(下图同)图5 SRC 激酶抑制剂对小鼠附睾尾精子磷酸酶活性和运动度影响Note.Compared with control group, bP< 0.05.(The same in the following figures)Figure 5 Effects of SRC inhibitor on sperm phosphatase activity and motility in cauda sperm of mouse epididymis
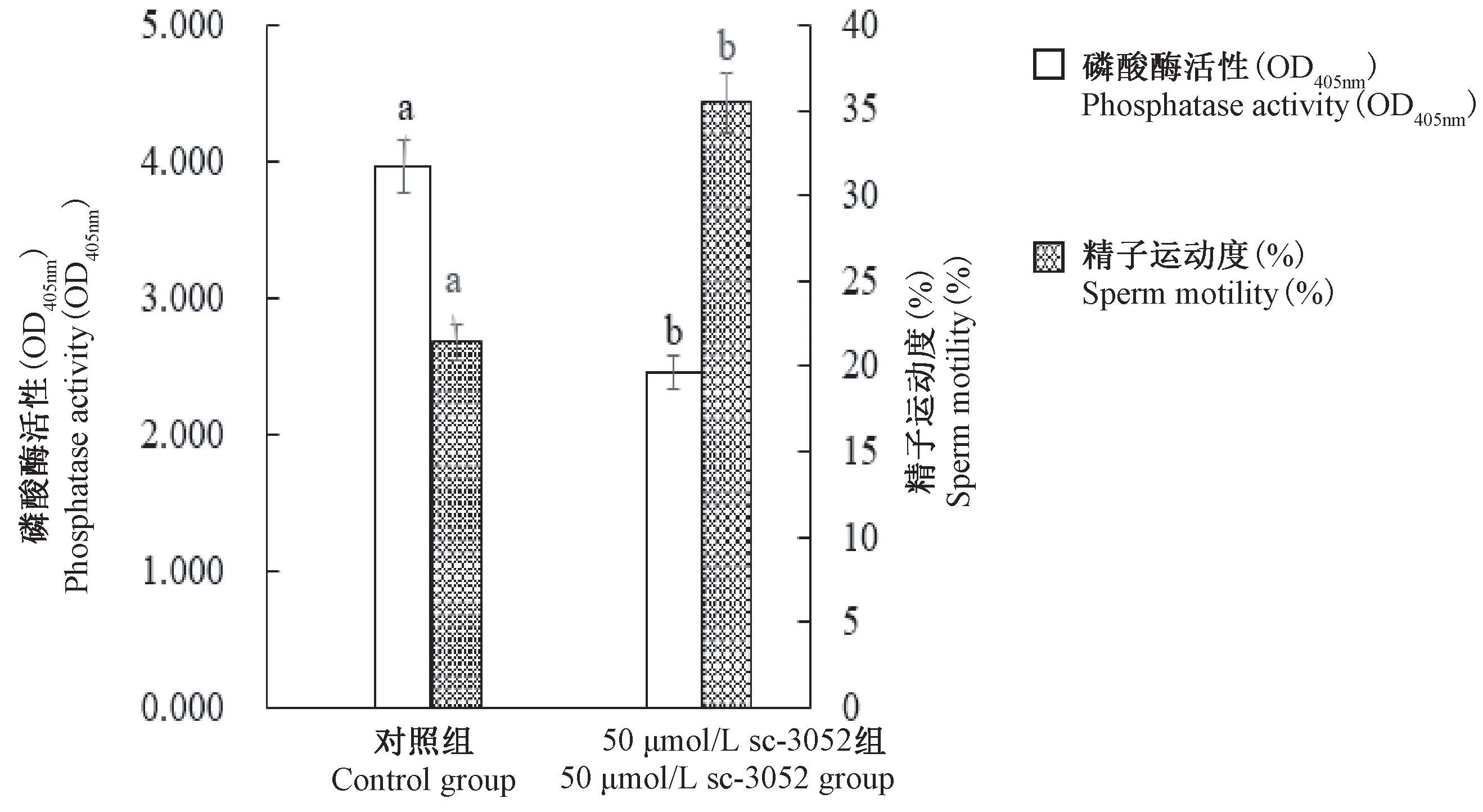
图6 SRC 激酶激活剂对小鼠附睾头精子磷酸酶活性和运动度影响Figure 6 Effects of SRC activator on phosphatase activity and motility in caput sperm of mouse epididymis
3 讨论
研究显示Ser/Thr 磷酸酶PP1γ2/PP2A 在不运动的小鼠附睾头精子中的催化活性远高于具有运动能力的附睾尾精子,且通过化学药物干预抑制或激活这两种磷酸酶可以使精子运动度发生显著变化,表明 Ser/Thr 磷酸酶 PP1γ2/PP2A 在精子运动的启动和调节中发挥作用,这与其他物种上(如牛,灵长类等)的研究结果“磷酸酶对附睾精子成熟具有调控作用”一致[5,17]。此外本研究结果首次表明了 Ser/Thr 磷酸酶 PP1γ2/PP2A 的活性受 SRC 激酶的调节控制。
本研究发现小鼠附睾头精子中SRC 激酶活性低于附睾尾精子,且精子运动度低于附睾尾精子,而Ser/Thr 磷酸酶活性高于附睾尾精子,在运动度较低的附睾头精子中加入SRC 激酶激活剂sc-3052,能显著降低Ser/Thr 磷酸酶活性但显著提高精子运动度,在运动度较高的附睾尾精子中加入SRC 激酶抑制剂SU6656,能显著增加Ser/Thr 磷酸酶活性但显著降低精子运动度,表明SRC 激酶与Ser/Thr 磷酸酶之间可能具有某种相互作用从而调控小鼠精子运动,且通过免疫共沉淀分析得到SRC 激酶与Ser/Thr 磷酸酶PP1γ2/PP2A 具有关联性作用,其可能是这二者都参与调控精子运动性,结合其Ser/Thr磷酸酶活性以及运动度分析,表明SRC 激酶通过抑制小鼠精子Ser/Thr 磷酸酶活性从而调控小鼠精子运动度,其作用机制可能是小鼠精子在从附睾头转移至附睾尾的过程中,SRC 激酶活性增强,抑制了其Ser/Thr 磷酸酶活性,通过其Ser/Thr 磷酸酶活性变化而实现对精子运动的调控作用。未成熟精子从附睾头到附睾尾最终成为成熟精子,这个过程精子活力逐渐增强,而Ser/Thr 磷酸酶活性逐渐下降,因此Ser/Thr 磷酸酶活性变化与精子运动性有关[7]。从 Krapf 等[8]的研究表明,SRC 激酶抑制剂可以阻断小鼠精子获能相关的蛋白酪氨酸磷酸化,但Ser/Thr 磷酸酶抑制剂能够消除SRC 激酶抑制剂对获能的影响,包括体外受精。这似乎暗示了SRC激酶与Ser/Thr 磷酸酶具有某种关联性。本研究证明小鼠精子中Ser/Thr 磷酸酶PP1γ2/PP2A 与SRC激酶确实存在相互作用,且SRC 激酶通过调控Ser/Thr 磷酸酶的活性而对小鼠精子运动作出调控,即SRC 激酶通过抑制Ser/Thr 磷酸酶而提高小鼠精子的运动能力。本研究首次为精子中SRC 激酶和磷酸酶间存在互作关系之推测提供了直接的证据。研究所发现的小鼠精子中SRC 激酶对Ser/Thr 磷酸酶具有抑制作用这一现象与SRC 激酶在其它细胞中的作用结果相一致,此前,有研究证明SRC 激酶可以下调其它细胞的Ser/Thr 磷酸酶[18-19]。SRC 激酶在不同种类细胞中对Ser/Thr 磷酸酶具有相似的调控作用,说明SRC 激酶作用机制的通用性。
探明SRC 激酶与Ser/Thr 磷酸酶之间的联系对小鼠精子运动性的调控作用,有助于获得小鼠附睾尾精子成熟和运动的机理,还能丰富SRC 激酶与Ser/Thr 磷酸酶对小鼠精子运动性调控的研究内容以及作用机制,为相关男性不育症的理解和诊治提供科学依据。
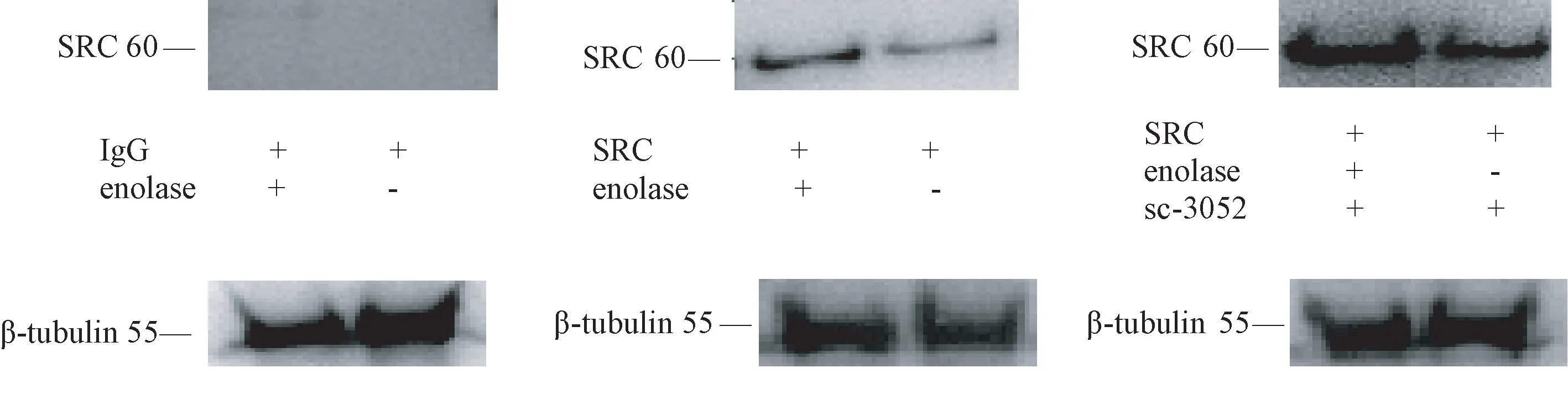
图7 sc-3052 对小鼠附睾头精子中SRC 激酶活性的影响Figure 7 Effect of sc-3052 on SRC kinase activity in epididymal caput sperm

图8 SU6656 对小鼠附睾尾精子中SRC 激酶活性的影响Figure 8 Effect of SU6656 on SRC kinase activity in epididymal cauda sperm
本研究虽然阐明了SRC 激酶和Ser/Thr 磷酸酶PP1γ2/PP2A 的相互作用及其对精子运动的调控作用,但其中仍有一些问题并不清楚,如SRC 激酶活性的调节受控于何种分子、SRC 激酶和Ser/Thr 磷酸酶之间是直接作用还是通过其他分子起作用、是何分子、何种磷酸酶(PP1γ2 还是 PP2A 或 PP2B)起作用、磷酸酶失活(被抑制)后又是如何引发精子运动的,其下游的信号通路是什么等,这些重要问题的解答将有助于深入理解Ser/Thr 磷酸酶对精子运动精细调控作用机制及较为完整的相关信号转导途径,它们可作为磷酸酶与精子功能关系领域中未来的重点研究内容,其中一些内容正在本实验室中进行。
4 结论
研究发现小鼠附睾头精子中SRC 激酶活性低于附睾尾精子而Ser/Thr 磷酸酶活性显著高于附睾尾精子,研究表明小鼠附睾精子中 SRC 激酶与PP1γ2/PP2A 具有相互作用,呈负相关性,即 SRC激酶通过抑制精子中Ser/Thr 磷酸酶活性以调控精子运动。