防肌腱粘连膜制备材料的研究进展
路明宽,蔡传栋,王 伟,范存义,刘 珅
上海交通大学附属第六人民医院骨科,上海200233
肌腱受到损伤或进行修复手术后,常伴随着粘连组织的形成。在肌腱愈合过程中,其会与周围组织形成不同程度的粘连,该粘连组织可限制肌腱的滑动能力,导致肢体运动受限,从而影响患者的术后生活质量[1]。目前,已有多种防治肌腱粘连的方法应用于临床,其中以肌腱松解术为代表的手术治疗较为常见,但由于施行该手术后患者的功能恢复不甚理想,学者们则逐渐将目光聚焦于能够起到物理阻隔作用的防粘连膜方面[2]。近年来,随着材料科学的不断进展,越来越多的生物材料和合成材料被应用于防粘连膜的制备,由于材料的理化性质各异,使得该膜的体内反应和疗效也存在差异;且已有研究者针对不同材料构建的防粘连膜进行了较为深入的体内、外研究,取得了一定的进展。基于此,本研究针对当前防粘连膜制备材料的研究进展进行综述,以期在优化防粘连膜的设计和构建方面提供一定的参考。
1 天然生物材料
1.1 透明质酸
透明质酸(hyaluronic acid,HA)是细胞外基质和滑液的组成成分,具有良好的生物降解性和组织相容性。在防治肌腱粘连的应用过程中,HA 既可作为物理屏障,又可起到控制炎症、抑制成纤维细胞增殖等作用[3],但存在降解速度较快、机械性能较差等问题[4]。有研究显示,通过在HA 上负载不同的药物如乳铁蛋白衍生肽(PXL01)[5]、 布 洛 芬[6]、 微 小RNA (microRNA,miRNA)[7]等,可起到促进防粘连物质生成、减少炎症介质表达、抑制环氧合酶等作用,以减轻腱周炎症、增强HA的防粘连性能(图1)。
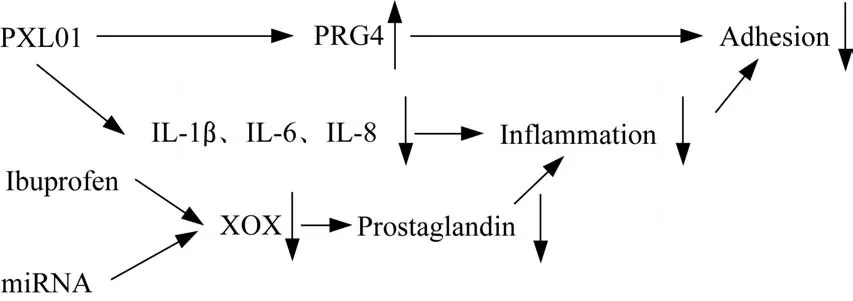
图1 3种负载药物防治腱周粘连的作用机制Fig 1 Mechanism of three loading drugs in prevention and treatment of peritendinous adhesion
Seprafilm®是一种由英国Genzyme公司生产的可吸收生物膜,该生物膜由透明质酸钠和羧甲基纤维素共2种阴离子多糖组成。Yurdakul 等[4]的动物实验显示,在预防挤压型肌腱损伤后粘连中,无论肌腱纤维是否修复,Seprafilm®均能有效抑制腱周粘连的形成。目前,Seprafilm®已成为临床常用的防粘连产品,并广泛应用于防治肌腱修复术后的肌腱周围组织粘连中[8]。
1.2 壳聚糖
在自然界中,甲壳素广泛分布于甲壳类动物中,而壳聚糖(chitosan,CS)是甲壳素脱除部分乙酰基的产物。CS 具有良好的抗菌性、生物降解性和组织相容性等特性;与其他聚合物材料相比,以CS 为基础制备的防粘连膜具有较低的细胞亲和性,对成纤维细胞的黏附较少,因而在防治腱周组织粘连中获得了较多应用[9]。由于CS的降解速度较快,研究者们多采用CS 与其他材料如HA[10]等复合的方法制备防粘连膜,以延长该膜的降解时间、改良防肌腱粘连性能。同时,也有学者就CS 在预防肌腱粘连中的分子机制进行探索,如Chen 等[11]发现CS可通过上调去乙酰化酶1激活P53,从而抑制炎症、预防肌腱粘连,且该方法或将为肌腱损伤修复术后的肌腱粘连的防治提供新策略。
1.3 羊膜
来自生物体的羊膜是一种天然高分子半透膜,含有细胞因子、酶等多种活性成分,具有较好的生物降解性、良好的组织相容性以及较轻的炎症反应等特性,是一种良好的防粘连生物材料[12]。在动物实验中,Liu 等[13]构建了鸡屈指肌腱损伤模型,设置实验组(应用脱细胞羊膜)及对照组(应用医用膜),结果显示羊膜可以促进鸡屈指肌腱的愈合,避免肌腱粘连的形成,且其并发症发生率低于医用膜组。Ding等[14]在鸡屈指深肌腱切断修复模型的研究中,采用光化学组织黏合的方法,使损伤肌腱与局部包裹的人羊膜紧密结合,结果显示:与对照组相比,采用光化学组织黏合方法的人羊膜组的关节活动情况较好,粘连形成、炎症反应有明显降低。
目前,由生物羊膜制备的防粘连屏障已经应用于临床,但Leppänen等[15]将异体羊膜移植物作为机械屏障用于患者屈肌腱的损伤部位发现,损伤部位仍有较多的粘连组织形成,这可能与技术因素和异体羊膜移植物本身有关。Liu等[16]在近期的研究中发现,采用静电纺丝技术将聚己内酯(polycaprolactone,PCL)涂覆在冷冻羊膜的表面,不仅可保留人羊膜中的许多细胞生长因子,还可以提高羊膜的机械强度及疏水性,优化羊膜的防粘连性能。
1.4 丝素蛋白
丝素蛋白是一种具有较好组织相容性和生物降解性的天然高分子材料,是制备防粘连膜的良好材料之一[17],但在制成防粘连膜后,其力学性能不够理想。Ni等[18]将由丝素蛋白制成的电纺纤维膜包裹于兔的损伤跟腱处,利用光化学组织黏合法将这种电纺纤维膜紧密地附着在损伤肌腱表面,结果发现该纤维膜可在修复部位提供良好的物理屏障作用,以减少腱周粘连形成。Yao等[19]将多孔和无孔的丝素蛋白膜用于损伤肌腱,结果发现无孔丝素蛋白膜能更好地减少炎症细胞浸润,降低受损肌腱周围的炎症程度,防止腱周粘连。
2 合成材料
2.1 聚乳酸
聚乳酸(polylacticacid,PLA)又称聚丙交酯,可通过乳酸分子的聚合作用合成,具有良好的生物降解性、组织相容性和优良的力学性能等;同时,由于该材料缺乏生物活性和亲水性,使得成纤维细胞难以被黏附于该膜上[20]。鉴于以上特性,PLA 及其衍生物在近年来已被广泛应用于制备防粘连膜,且其防粘连性能也得到了更深入的探究。Liu 等[21]发现由PLA 制备的电纺纤维膜在发挥物理屏障功能时会引起局部巨噬细胞浸润,继而导致炎症和肉芽肿形成;与PLA 电纺纤维膜相比,负载布洛芬的PLA 电纺纤维膜可通过减少局部巨噬细胞的浸润,增强PLA 电纺纤维膜的抗炎和抗粘连的作用,从而进一步抑制损伤肌腱周围粘连组织的形成。
PLA 有3 种立体异构体,包括左旋聚乳酸(Lpolylactide, PLLA)、 右 旋 聚 乳 酸 (D-polylactide,PDLA)和外消旋聚乳酸(D,L-polylactide,PDLLA)。其中,PLLA 和PDLA 的熔点高达170~180 ℃,机械强度高且降解时间长,是制备防粘连膜的理想材料;PDLLA是非结晶性的,体内降解速度快,可作为防粘连膜中负载药物的组成材料[22-23]。
2.2 PCL
PCL 是一种可以生物降解的半结晶聚酯,具有良好的力学性能、较好的热稳定性及相对较低的酸性;同时,PCL 的某些特性(如疏水性、降解性等)可以根据需要发生改变[24]。由于PCL 的亲水性和弹性不佳,缺乏防粘连功能,因而常被用作防粘连材料的载体。Chen 等[25]制备了HA接枝于PCL的纳米纤维膜,通过体外实验和动物实验证实,这种纳米纤维膜具有良好的预防腱周粘连的功效。Shalumon等[26]制备了以嵌入纳米银粒子的聚乙二醇(polyethylene glycol,PEG)/PCL 为壳、以HA/布洛芬为核心的核-壳纳米纤维膜;在该多功能屏障膜中,HA 可在肌腱滑动中发挥润滑作用,降低成纤维细胞附着;纳米银粒子和布洛芬则分别起到抗感染和抗炎的作用,因而这种纳米纤维膜既可减轻肌腱手术后的感染又能减轻局部炎症,抑制肌腱周围粘连组织的形成。
另有学者在PCL 的基础上构建了聚氨酯(polyurethane,PU)薄膜,PU 薄膜较PCL 薄膜具有更好的力学性能和组织相容性,较低的炎症反应及适当的降解时间,且无细胞毒性。Hsu 等[27]合成了基于PCL 的PU 薄膜,并分别将PU 薄膜和PCL 薄膜缠绕于损伤后缝合的兔肌腱周围,结果发现应用PU 薄膜相较于PCL 薄膜在术后的粘连程度更低,表明PU 薄膜具有更好的抗粘连性能。Chen 等[28]同样制备了电纺水性PU 纳米纤维膜,该纤维膜的微孔性可阻止成纤维细胞渗透,同时不影响肌腱愈合所需的营养物质的扩散;其中,体外细胞研究表明,PU纳米纤维膜可有效减少附着的成纤维细胞,且无显著的细胞毒性;其兔屈肌腱修复模型的体内研究显示,PU纳米纤维膜的应用可降低腱周粘连程度。以上研究均表明,PU也是制备防肌腱粘连膜的一种良好的材料选择。
2.3 聚乙醇酸
在组织工程的早期,聚乙醇酸(polyglycolicacid,PGA)是一种较广泛使用的合成高分子材料,具有良好的生物降解性和组织相容性[29]。Xu 等[30]利用PGA 纤维膜修复损伤腱鞘发现,该纤维膜可较好地预防肌腱粘连。但也有研究[31]发现,这种聚合物材料的酸性降解产物会引起炎症反应和纤维化过程。Shen 等[32]通过在PGA 纤维膜表面涂上一层CS来中和酸度,减轻其酸性降解产物引起的无菌性炎症,从而使PGA纤维膜的临床应用成为可能。
2.4 聚(L-乳酸)-聚乙二醇
聚(L-乳酸) -聚乙二醇[poly (L-lactic acid) -polyethylene glycol,PELA]是一种新型的防粘连膜材料,即在PLA 基础上引入了PEG,使PELA 材料不仅具备了PLA 材料拥有的良好的组织相容性和适当的生物降解性,还具有优于PLA 材料的柔韧性和亲水性;但在修复后的肌腱周围包裹PELA膜可引起局部炎症,继而降低其防粘连的作用[33]。一些学者采用PELA 膜载药的方法(如单纯负载塞来昔布[34]等),也有一些学者采用在PELA 载药的基础上与其他高分子材料相结合方法(如构建负载塞来昔布的PELA 电纺纤维膜为外层、HA 和PELA混合电纺为内层的双层仿生膜[35]等),均能够使改进后的PELA膜材料更好地发挥抑制成纤维细胞增殖及炎症反应的作用,从而增强防治肌腱术后粘连形成的性能。
2.5 其他
Ishiyama 等[36]合成了2-甲基丙烯酰氧乙基磷酸胆碱(2-methacryloyloxyethyl phosphorylcholine,MPC) 聚 合物,通过大鼠跟腱模型和兔屈肌腱模型的组织学和力学分析发现,MPC 水凝胶可减少腱周粘连且不损害肌腱愈合。Chou 等[10]合成了聚(N-异丙基丙烯酰胺)[poly(N-isopropylacrylamide),PNIPAM]的热响应原位成型水凝胶,并在PNIPAM 上接枝CS 和HA 以构建HA-CSPNIPAM,结果显示HA-CS-PNIPAM 具有良好的组织相容性,可减少术后腱周粘连且不干扰正常的肌腱愈合。Kuo 等[37]制备了由结冷胶、黄原胶和HA 构成的水凝胶膜制剂并应用于修复后的肌腱周围,结果显示该制剂可有效地降低术后肌腱粘连,不影响肌腱愈合后的机械强度,且在体内的降解速度相对较缓,因此可发挥较长时间的防粘连作用。Meier 等[38]合成了以聚羟基丁酸酯和ε-己内酯为基础的聚酯氨基甲酸酯聚合物——DegraPol管,并在兔跟腱断裂修复模型中对该聚合物的防粘连性能进行研究,结果显示DegraPol 管能紧紧固定在缝合的肌腱周围,不影响肌腱的愈合,可作为一种良好的物理屏障以预防腱周粘连形成。梅宝珊等[39]将水凝胶硅胶膜施用于患者损伤后修复的肌腱周围,术后随访发现,该水凝胶硅胶膜对于预防肌腱粘连的形成有明显的疗效。
3 结论
目前,研究者们根据天然生物材料和合成材料的理化性质及生物学特性,制备出了多种能够抑制粘连形成的防粘连膜。一般来说,天然生物材料制备的防粘连膜具备良好的组织相容性,但存在机械强度低、置入肌腱周围后降解速度过快等不足。相比之下,合成聚合物材料制备的防粘连膜机械性能较好、降解时间较长,但其生物相容性相对不佳,易引起局部炎症反应而影响防粘连性能。因此,亟待进一步研制以新型聚合物材料为基础的防粘连膜,结合不同的载药等方式以取得更好的防粘连疗效,从而助力于防粘连膜在肌腱周围组织粘连的临床治疗中的应用与推广。
参·考·文·献
[1] Titan AL, Foster DS, Chang J, et al. Flexor tendon: development, healing,adhesion formation,and contributing growth factors[J]. Plast Reconstr Surg,2019,144(4):639e-647e.
[2] Legrand A, Kaufman Y, Long C, et al. Molecular biology of flexor tendon healing in relation to reduction of tendon adhesions[J]. J Hand Surg Am,2017,42(9):722-726.
[3] 陈明姣,范先群. 透明质酸-明胶双网络水凝胶促进骨髓间充质干细胞成骨分化的作用[J]. 上海交通大学学报(医学版),2018,38(7):722-731.
[4] YurdakulSıkar E, Sıkar HE, Top H, et al. Effects of Hyalobarrier gel and Seprafilm in preventing peritendinous adhesions following crush-type injury in a rat model[J]. Ulus Travma Acil Cerrahi Derg,2019,25(2):93-98.
[5] Edsfeldt S, Holm B, Mahlapuu M, et al. PXL01 in sodium hyaluronate results in increased PRG4 expression: a potential mechanism for antiadhesion[J]. Ups J Med Sci,2017,122(1):28-34.
[6] Chen CT, Chen CH, Sheu C, et al. Ibuprofen-loaded hyaluronic acid nanofibrous membranes for prevention of postoperative tendon adhesion through reduction of inflammation[J]. Int J Mol Sci,2019,20(20):E5038.
[7] Zhou YL, Yang QQ, Yan YY, et al. Localized delivery of miRNAs targets cyclooxygenases and reduces flexor tendon adhesions[J]. Acta Biomater,2018,70:237-248.
[8] Lin LX, Yuan F, Zhang HH, et al. Evaluation of surgical anti-adhesion products to reduce postsurgical intra-abdominal adhesion formation in a rat model[J]. PLoS One,2017,12(2):e0172088.
[9] 杨川峰,彭银波,郝健,等. 新型壳聚糖-硝酸银凝胶材料的杀菌效果及创面应用[J]. 上海交通大学学报(医学版),2017,37(7):1004-1009.
[10] Chou PY, Chen SH, Chen CH, et al. Thermo-responsive in-situ forming hydrogels as barriers to prevent post-operative peritendinous adhesion[J].Acta Biomater,2017,63:85-95.
惯性导航技术不依赖外部环境,具有较强的环境适应性。基于惯性导航的掘进机导航技术,国内2007年由重庆大学提出并进行了部分理论研究[13]。近年来国内已有基于陀螺仪的技术用于巷道定向掘进的试验[14-15]。国外,德国、澳大利亚相关研究机构在20世纪末即开始研究其用于煤矿井下移动装备的定位导航的可行性,并已有综采工作面上的应用报道。
[11] Chen Q,Lu H,Yang H. Chitosan prevents adhesion during rabbit flexor tendon repair via the sirtuin 1 signaling pathway[J]. Mol Med Rep,2015,12(3):4598-4603.
[12] Liu CJ,Yu KL,Bai JB,et al. Experimental study of tendon sheath repair via decellularized amnion to prevent tendon adhesion[J]. PLoS One,2018,13(10):e0205811.
[13] Liu CJ, Bai JB, Yu KL, et al. Biological amnion prevents flexor tendon adhesion in zone Ⅱ: a controlled, multicentre clinical trial[J]. Biomed Res Int,2019,2019:2354325.
[14] Ding B, Wang X, Yao M. Photochemical tissue bonding technique for improving healing of hand tendon injury[J]. Surg Innov, 2019, 26(2):153-161.
[15] Leppänen OV, Karjalainen T, Göransson H, et al. Outcomes after flexor tendon repair combined with the application of human amniotic membrane allograft[J]. J Hand Surg Am,2017,42(6):474.e1-474.e8.
[16] Liu CJ, Tian SY, Bai JB, et al. Regulation of ERK1/2 and SMAD2/3 pathways by using multi-layered electrospun PCL-amnion nanofibrous membranes for the prevention of post-surgical tendon adhesion[J]. Int J Nanomedicine,2020,15:927-942.
[17] Tomeh MA,Hadianamrei R,Zhao XB. Silk fibroin as a functional biomaterial for drug and gene delivery[J]. Pharmaceutics,2019,11(10):E494.
[18] Ni T, Senthil-Kumar P, Dubbin K, et al. A photoactivated nanofiber graft material for augmented Achilles tendon repair[J]. Lasers Surg Med,2012,44(8):645-652.
[20] Hsu YI, Yamaoka T. Improved exposure of bioactive peptides to the outermost surface of the polylactic acid nanofiber scaffold[J]. J Biomed Mater Res B Appl Biomater,2020,108(4):1274-1280.
[21] Liu S, Chen H, Wu TY, et al. Macrophage infiltration of electrospun polyester fibers[J]. Biomater Sci,2017,5(8):1579-1587.
[22] Bai H,Deng S,Bai D,et al. Recent advances in processing of stereocomplextype polylactide[J]. Macromol Rapid Commun, 2017, 38(23). DOI:10.1002/marc.201700454.
[23] Yu BW, Meng L, Fu SR, et al. Morphology and internal structure control over PLA microspheres by compounding PLLA and PDLA and effects on drug release behavior[J]. Colloids Surf B Biointerfaces,2018,172:105-112.
[24] Rajzer I, Menaszek E, Castano O. Electrospun polymer scaffolds modified with drugs for tissue engineering[J]. Mater Sci Eng C Mater Biol Appl,2017,77:493-499.
[25] Chen SH,Chen CH,Shalumon KT,et al. Preparation and characterization of antiadhesion barrier film from hyaluronic acid-grafted electrospun poly(caprolactone) nanofibrous membranes for prevention of flexor tendon postoperative peritendinous adhesion[J]. Int J Nanomedicine,2014,9:4079-4092.
[26] Shalumon KT, Sheu C, Chen CH, et al. Multi-functional electrospun antibacterial core-shell nanofibrous membranes for prolonged prevention of post-surgical tendon adhesion and inflammation[J]. Acta Biomater, 2018,72:121-136.
[27] Hsu SH, Dai LG, Hung YM, et al. Evaluation and characterization of waterborne biodegradable polyurethane films for the prevention of tendon postoperative adhesion[J]. Int J Nanomedicine,2018,13:5485-5497.
[28] Chen SH, Chou PY, Chen ZY, et al. Electrospun water-borne polyurethane nanofibrous membrane as a barrier for preventing postoperative peritendinous adhesion[J]. Int J Mol Sci,2019,20(7):E1625.
[29] Li Y, Fan P, Ding XM, et al. Polyglycolic acid fibrous scaffold improving endothelial cell coating and vascularization of islet[J]. Chin Med J (Engl),2017,130(7):832-839.
[30] Xu L, Cao DJ, Liu W, et al. In vivo engineering of a functional tendon sheath in a hen model[J]. Biomaterials,2010,31(14):3894-3902.
[31] Lin XX, Wang WB, Zhang WJ, et al. Hyaluronic acid coating enhances biocompatibility of nonwoven PGA scaffold and cartilage formation[J].Tissue Eng Part C Methods,2017,23(2):86-97.
[32] Shen YB, Tu T, Yi BC, et al. Electrospun acid-neutralizing fibers for the amelioration of inflammatory response[J]. Acta Biomater,2019,97:200-215.
[33] Yang DJ, Chen F, Xiong ZC, et al. Tissue anti-adhesion potential of biodegradable PELA electrospun membranes[J]. Acta Biomater, 2009, 5(7):2467-2474.
[34] Jiang SC, Zhao X, Chen S, et al. Down-regulating ERK1/2 and SMAD2/3 phosphorylation by physical barrier of celecoxib-loaded electrospun fibrous membranes prevents tendon adhesions[J]. Biomaterials,2014,35(37):9920-9929.
[35] Li LF, Zheng XY, Fan DP, et al. Release of celecoxib from a bi-layer biomimetic tendon sheath to prevent tissue adhesion[J]. Mater Sci Eng C Mater Biol Appl,2016,61:220-226.
[36] Ishiyama N, Moro T, Ohe T, et al. Reduction of Peritendinous adhesions by hydrogel containing biocompatible phospholipid polymer MPC for tendon repair[J]. J Bone Joint Surg Am,2011,93(2):142-149.
[37] Kuo SM, Chang SJ, Wang HY, et al. Evaluation of the ability of xanthan gum/gellan gum/hyaluronan hydrogel membranes to prevent the adhesion of postrepaired tendons[J]. Carbohydr Polym,2014,114:230-237.
[38] Meier Bürgisser G,Calcagni M,Müller A,et al. Prevention of peritendinous adhesions using an electrospun DegraPol polymer tube: a histological,ultrasonographic, and biomechanical study in rabbits[J]. Biomed Res Int,2014,2014:656240.
[39] 梅宝珊,尹忠祥,方月娥. 接枝水凝胶硅橡胶薄膜骨科防粘连60 例应用分析[J]. 安徽医学,1997,18(2):1-2.

