藻蓝蛋白对小鼠精原细胞氧化损伤的保护作用及其机制
董晓雷 韩晶晶 杨方浩 朱峰 刘国祥 李冰
(青岛大学基础医学院遗传学与细胞生物学系,山东 青岛 266071)
由于环境恶化、生活压力大等因素的影响,人群中不孕不育发病率逐渐增高[1-2],给患者家庭造成极大的困扰。男性不育主要表现在睾丸组织氧化损伤,其中精子数量降低、活动力下降等为主要影响因素。目前常用的改善生殖性能的药物副作用大,从海洋中寻找改善生殖性能且毒副作用小的天然药物成为关注的热点。螺旋藻中藻蓝蛋白(C-PC)含量丰富,具有抗氧化、抗肿瘤等功效[3-6],但其在生殖免疫领域作用的研究较少。活性氧(ROS)是由生物系统代谢产生的一类能够引起机体发生氧化反应的物质[7-9],其主要包括有超氧自由基、羟基自由基等。当细胞内ROS产量增加时,会导致蛋白质、脂质和核酸损伤,对细胞结构产生有害的作用[10]。研究表明,细胞中ROS累积可导致细胞骨架紊乱[11]、抗氧化系统功能障碍[12-13]和细胞凋亡[14]。生殖细胞在正常代谢过程中产生ROS并逐渐累积而导致氧化应激的发生,从而导致生殖细胞的损伤,降低了生殖细胞的质量和数量,影响胚胎发育[15]。氧化应激被认为是潜在的细胞老化的主要机制之一[16-17],其对人类生殖过程的负面影响不再是争论的话题[18]。本研究拟观察C-PC对H2O2诱导的小鼠精原细胞GC-1 spg氧化损伤的保护作用及其机制,旨在为C-PC在生殖免疫领域的开发利用提供理论依据。
1 材料和方法
1.1 材料
C-PC购自台州宾美生物技术有限公司;小鼠精原细胞GC-1 spg购自武汉普诺赛生命科技有限公司;DMEM培养基购自美国Hyclone公司;胎牛血清、胰蛋白酶消化液购自美国BI公司;青链霉素混合液购买于北京索莱宝科技有限公司;BCA蛋白质定量试剂盒购自中国biosharp公司;H2O2购自美国Sigma公司;Annexin V-PI细胞凋亡检测试剂盒、ROS检测试剂盒购自上海碧云天生物技术有限公司;RIP-1购自成都正能生物技术有限责任公司;RIP-3购自美国Santa公司。
1.2 细胞培养及处理
GC-1 spg接种于含体积分数0.10胎牛血清和体积分数0.01青链霉素溶液的高糖DMEM培养基中,置于37 ℃、含体积分数0.05 CO2的细胞培养箱内培养。实验时将细胞分为对照组(A组)、模型组(B组)、C-PC低剂量组(C组)、C-PC中剂量组(D组)以及C-PC高剂量组(E组)。调整GC-1 spg密度为7×107个/L,然后将细胞接种于96孔(每孔100 μL)或6孔培养板(每孔2 mL)中,细胞过夜贴壁后,A组和B组加入培养液常规培养,C、D、E组分别加入0.25、0.50、1.00 g/L C-PC预处理24 h,A组去除培养液换成新鲜培养液,B、C、D、E组去除培养液,加入含600 μmol/L H2O2的新鲜培养液继续培养24 h,然后进行后续实验。
1.3 CCK-8法检测细胞增殖率
各组细胞经处理后,吸出培养基,加入110 μL含体积分数0.10 CCK-8的培养基,继续培养2 h后,应用酶标仪测定450 nm波长处的吸光度(A)值。并计算细胞增殖率。细胞增殖率(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
1.4 DCFH-DA染色测定细胞内ROS水平
按照1∶1 500用无血清培养液稀释二氯荧光黄双乙酸盐(DCFH-DA)荧光探针,并使终浓度为7.5 μmol/L。各组细胞经处理后,弃掉培养基,6孔板中每孔加入1 mL已稀释好的DCFH-DA,37 ℃下置于细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,加入无血清细胞培养液并在荧光显微镜下观察绿色荧光强度。
1.5 流式细胞术检测细胞坏死率
各组细胞经处理后,弃掉培养基,用不含EDTA的胰酶消化,离心收集细胞,用预冷PBS洗涤2次,离心收集细胞。加入100 μL结合缓冲液重悬细胞,加入5 μL Annexin V-FITC和10 μL PI Staining Solution,混匀,室温避光孵育15 min,再加入400 μL结合缓冲液。混匀置于冰上,立即用流式细胞仪进行分析。
1.6 Western blot方法检测细胞中RIP-1、RIP-3的表达
各组细胞经处理后,弃掉培养基,用预冷PBS洗涤细胞3次,每组加入200 μL蛋白裂解液(按照RIPA∶PMSF∶IP按100∶1∶1的比例配制),提取细胞总蛋白,BCA法测蛋白浓度。在SDS-PAGE上分离蛋白质,并将其转移到PVDF膜上,用TBST配制的50 g/L脱脂奶粉封闭2 h。将该膜在4 ℃下与一抗(1∶1 000)孵育12 h,以GAPDH(1∶2 000)作为内参照。将膜用TBST清洗3次,每次10 min。二抗(1∶1 000)在室温下孵育2 h以后,TBST清洗3次,每次10 min。ECL发光显影。使用Image J软件分析蛋白条带灰度值,目的蛋白相对表达量以目的蛋白灰度值/内参照蛋白灰度值计算。
2 结 果
2.1 各组GC-1 spg增殖活性测定
CCK-8法检测结果显示,A、B、C、D、E组细胞的增殖活性分别为(100.00±5.09)%、(64.91±4.75)%、(76.25±4.94)%、(78.69±8.54)%和(84.20±6.36)%。B组细胞活性低于A组(F=76.86,q=23.01,P<0.05),C、D、E组细胞活性均高于B组,差异均有显著意义(q=4.45~10.83,P<0.05)。
2.2 C-PC对GC-1 spg内ROS水平的影响
荧光显微镜下观察可见,与A组相比,B组细胞内绿色荧光强度明显升高;与B组相比,C、D、E组细胞内的绿色荧光强度明显降低(图1)。
2.3 C-PC对H2O2诱导的GC-1 spg坏死的影响
流式细胞术检测结果显示,A~E组细胞坏死率分别为0.004±0.001、0.195±0.004、0.166±0.002、0.153±0.003、0.092±0.003。与A组比较,B组坏死细胞明显增加(F=206.90,q=60.07,P<0.05);C、D、E组坏死细胞均较B组明显减少,差异均具有统计学意义(q=9.09~32.41,P<0.05)。见图2。

①:A组,②:B组,③:C组,④:D组,⑤:E组图1 各组GC-1 spg内ROS水平比较
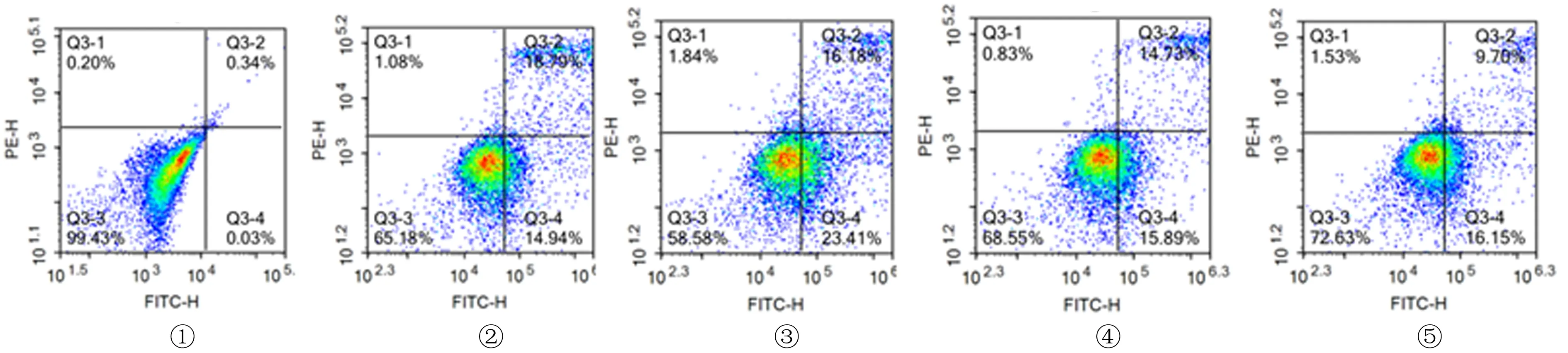
①:A组,②:B组,③:C组,④:D组,⑤:E组图2 流式细胞术检测各组GC-1 spg的坏死率
2.4 C-PC对H2O2诱导的GC-1 spg坏死相关蛋白表达的影响
Western blot结果显示,A~E组细胞内RIP-1蛋白的相对表达量分别为1.013±0.014、1.947±0.038、1.140±0.021、0.877±0.017、0.517±0.012。RIP-3蛋白相对表达量分别为0.930±0.012、1.623±0.052、0.883±0.015、0.603±0.015、0.430±0.015。与A组相比,B组细胞中RIP-1、RIP-3蛋白相对表达量明显升高,差异均有显著性(F=541.2、297.5,q=41.11、26.21,P<0.05);与B组相比,C、D、E组细胞中RIP-1、RIP-3蛋白相对表达量明显降低,差异均具有显著性(q=27.97~62.98,P<0.05)。见图3。
3 讨 论
众所周知,氧化应激对人体健康有害,从而导致一些疾病的发生,如心血管疾病、神经系统疾病、肾脏疾病、性成熟的延迟等[19-21]。ROS过量累积使细胞发生氧化应激,该机制已被认为是导致女性子宫内膜异位症、卵巢癌、多囊卵巢等其他各种常见疾病的潜在影响因素,也是诱导男性精子DNA损伤和精子凋亡的潜在诱因[22]。由于氧化应激被认为是潜在老化的主要机制之一[16-17],降低生殖细胞氧化应激反应可有效增强生殖细胞的活力。研究表明,C-PC是一种有效的过氧自由基清除剂[23]。本研究中,GC-1 spg经H2O2处理后,细胞存活率显著降低,坏死率升高,C-PC各剂量组处理可以提高细胞活力和降低坏死率,将损伤逆转到正常状态。表明C-PC预处理可以保护GC-1 spg免受H2O2的氧化损伤。
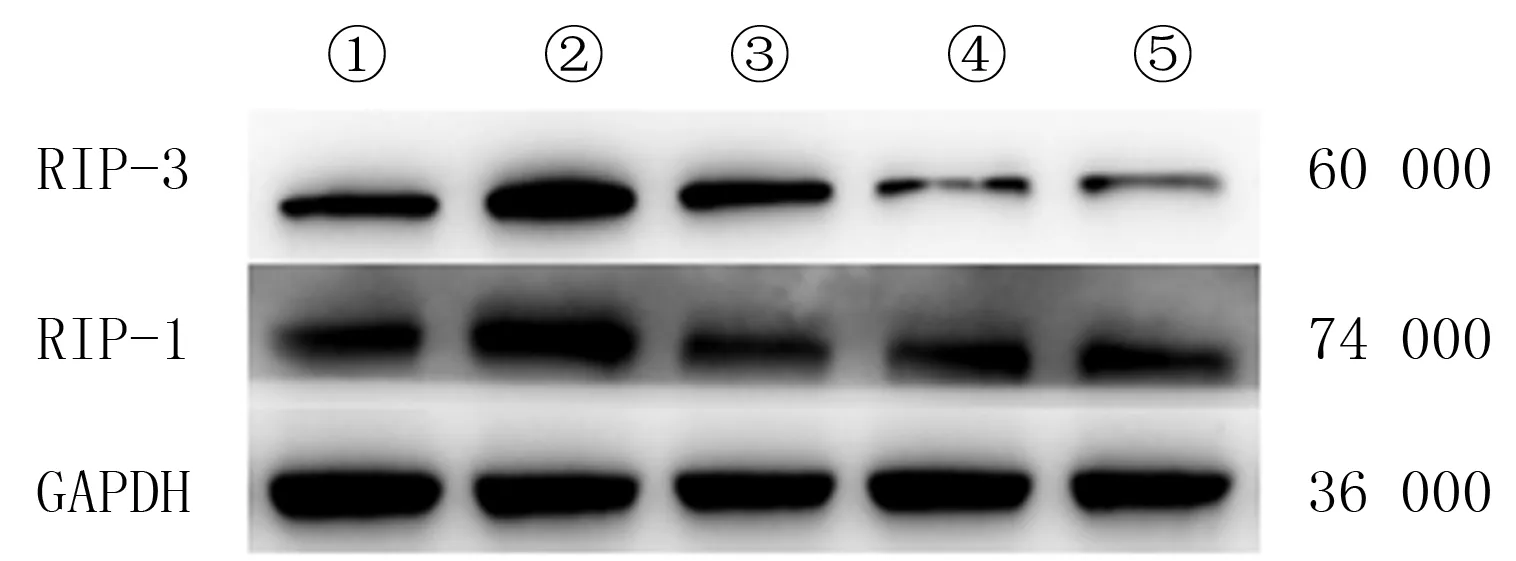
①:A组、②:B组、③:C组、④:D组、⑤:E组图3 Western blot方法检测各组GC-1 spg中RIP-1、RIP-3蛋白的表达水平
ROS在调控细胞各种功能中扮演着重要角色,正常情况下细胞内的稳态通过内源性自由基或抗氧化防御系统来平衡[24-25]。然而,ROS过量最终会导致抗氧化机制失衡,进而诱导细胞发生氧化损伤。其中细胞经H2O2处理后,细胞内会产生过量的ROS,导致细胞抗氧化能力降低[26]。为了阐明C-PC可以逆转GC-1 spg氧化损伤,本研究对H2O2处理的GC-1 spg内ROS水平进行检测。本研究结果表明,H2O2诱导GC-1 spg损伤后细胞内ROS水平较对照组显著升高;与模型组相比,C-PC低、中、高剂量组可有效降低细胞内ROS水平。这些结果表明,C-PC通过降低细胞内ROS水平来降低氧化应激。
程序性坏死是近年来发现的一类受死亡信号的调控、非依赖Caspase的新型细胞死亡方式[27],受体相互作用蛋白RIP是其中的关键组分,是反映程序性坏死的重要指标。程序性坏死抑制剂Nec-1作用于RIP-1和RIP-3的激酶部分发挥作用。HANUS等[28]证实,细胞发生氧化应激后,核膜和质膜会遭到破坏,细胞内ATP耗竭等,这是程序性坏死的主要特征。RIP-3敲除或使用RIP的抑制剂Nec-1可挽救氧化应激引起的细胞死亡,表明RIP对氧化应激诱导细胞发生程序性坏死至关重要。最近的研究表明,程序性坏死也是视网膜色素上皮细胞在氧化应激下死亡的主要机制[28-29]。
本研究利用H2O2建立GC-1 spg氧化损伤模型,结果表明H2O2诱导了GC-1 spg发生程序性坏死,RIP-1、RIP-3是H2O2诱导的细胞程序性坏死的关键分子,说明RIP-1、RIP-3介导的程序性坏死参与了H2O2诱导的GC-1 spg氧化损伤。
细胞水平证实,H2O2在引起GC-1 spg损伤的同时,可上调RIP-1、RIP-3蛋白的表达水平。说明C-PC预处理GC-1 spg能抑制H2O2诱导的RIP-1、RIP-3蛋白表达上调,同时能显著抑制H2O2引起的细胞损伤,使细胞存活率升高,降低细胞内ROS生成。因此,抑制程序性坏死可能是C-PC保护GC-1 spg的另一个重要机制。
综上所述,本研究初步认为H2O2诱导了GC-1 spg氧化损伤和RIP-1、RIP-3介导的细胞程序性坏死。这项研究表明,C-PC对H2O2诱导的GC-1 spg氧化损伤具有明显的保护作用,其作用可能与C-PC显著降低GC-1 spg内ROS水平,下调坏死通路蛋白RIP-1、RIP-3的表达水平,降低细胞坏死率,从而具有抑制氧化应激诱导的程序性坏死的能力有关。该研究为C-PC在生殖领域的开发利用提供了理论依据,具有较好的临床应用前景。

