多囊卵巢综合征患者颗粒细胞中miR-1270及其靶基因CYP19A1的表达及临床意义
张慧敏,朱文倩,马静,徐仰英,张玉,沈伟,郝翠芳,5*
(1.青岛大学医学部,青岛 266071;2.滨州医学院临床医学系,烟台 264010;3.青岛大学附属青岛市妇女儿童医院生殖中心,青岛 266011;4.青岛农业大学生命科学学院,青岛 266109;5.青岛大学附属烟台毓璜顶医院生殖中心,烟台 264000)
多囊卵巢综合征(PCOS)是一种常见的内分泌疾病[1],约占育龄妇女的5%~10%[2],约占无排卵性不孕症的75%[3]。PCOS是一种异质性综合征,临床表型多样,包括高雄激素血症、月经不调和多囊卵巢形态[4]。除不孕外,PCOS的表现通常包括肥胖、多毛、胰岛素抵抗、高风险的子宫内膜癌、代谢综合征[5]、2型糖尿病和心血管疾病[6-7]。MicroRNAs(miRNAs)是一种短的非编码内源性RNA(19~25 bp),能够通过与靶信使RNA(mRNA)上3′UTR处的互补核苷酸结合来降低mRNA的稳定性或抑制翻译[8-9]。有报道指出miR-1270能影响卵巢癌细胞的增殖凋亡,且高表达的miR-1270还能降低卵巢癌细胞对顺铂的敏感性[10-11]。
CYP19A1(Cytochrome P450 19A1 gene)基因编码的细胞色素P450芳香化酶(P450arom)是雌激素合成的限速酶[12]。雄激素转化为雌激素(雄激素和睾酮分别转化为雌酮和雌二醇)时,由于CYP19的异常表达或P450arom的活性抑制而受到限制[13-14]。本研究通过检测miR-1270及其靶基因CYP19A1在PCOS患者卵丘颗粒细胞中的表达,探讨分析其对雌激素生成的影响,为PCOS排卵障碍的分子机制研究提供新的理论依据。
资料与方法
一、研究对象及样本收集
选择2019年4月至2020年12月期间在烟台毓璜顶医院和青岛市妇女儿童医院生殖中心就诊的不孕患者,其中45例月经不调的PCOS患者(烟台毓璜顶医院14例,青岛市妇女儿童医院31例)为PCOS组,65例无PCOS的不孕患者作为对照组,记录两组患者的基本临床资料和促排卵情况;并收集两组患者的卵丘颗粒细胞开展后续实验室研究。本研究经青岛大学附属烟台毓璜顶医院和青岛市妇女儿童医院伦理委员会审批通过。
根据Rotterdam标准(2004),患者纳入PCOS组至少符合以下两个标准:卵巢多囊样改变;无排卵或稀发排卵;临床或生化高雄激素血症症状。排除标准:先天性肾上腺增生、库欣综合征与雄激素分泌性肿瘤等高雄激素血症疾病;甲状腺功能亢进,高泌乳素血症等内分泌性疾病;夫妇双方染色体异常。所有患者年龄小于35岁,均进行体外受精(IVF)或卵胞浆内单精子注射(ICSI)助孕治疗。
二、材料
1.主要试剂和仪器:miRNA分离试剂盒(北京天根);miRcute Plus miRNA第一链cDNA试剂盒(北京天根);SPARKscriptⅡRT-Plus逆转录试剂盒(山东思科捷);SYBR Green Premix Pro Taq HS qPCR Kit(湖南艾科瑞);QuantStudioTM5实时荧光定量PCR(qRT-PCR)仪(Applied Biosystems,美国);兔抗CYP19A1多抗(ab18995,Abcam,美国);兔抗β-Actin多抗(D110007,上海生工);HRP标记的羊抗兔IgG二抗(A0208,上海碧云天);酶联免疫吸附测定试剂盒(KGE014,R&D,美国);双荧光素酶报告试剂盒(南京诺唯赞);qRT-PCR引物及双荧光素酶报告载体由北京擎科新业生物技术有限公司合成;miRNA的过表达模拟物和抑制剂(mimic及inhibitor)及mimic的阴性对照(mimic NC)由苏州吉玛有限公司设计合成。
2.细胞株:人卵巢颗粒细胞(KGN)购自上海酶联生物科技有限公司,人胚肾细胞(293T)由青岛农业大学生命科学学院沈伟教授赠予。
3.生物信息学数据库:NCBI(http://www.ncbi.nlm.nih.gov/),RNA22(https://cm.jefferson. edu/rna22/Precomputed/),RNAhybrid(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid)用于预测靶mRNA及其结合位点。KEGG信号通路数据库(https://www.genome.jp/kegg/pathway.html)用于筛选信号通路。
三、研究方法
1.生物信息学:生物信息学方法预测miR-1270的靶基因,根据靶基因mRNA3′UTR与 miRNAs序列碱基互补的原则筛选两者最可能的结合位点。
2.临床资料收集:分别对PCOS组(n=45)及正常对照组(n=65)患者的临床特征资料进行回顾分析。收集的内容包括:年龄、不孕年限、体重指数(BMI)、抗苗勒管激素(AMH)、黄体生成素(LH)、卵泡刺激素(FSH)、LH/FSH,雌二醇(E2)、睾酮(T)、孕酮(P)、催乳素(PRL)、空腹血糖(FBG)水平以及窦卵泡数、获卵数、胚胎形成率。
3.卵丘颗粒细胞的收集和细胞株培养:注射HCG扳机后36 h,超声引导下经阴道穿刺抽吸直径≥16 mm的卵泡,获得卵丘-卵母细胞复合体。用针分离单个卵母细胞周围的颗粒细胞。在PBS液中清洗3次后,将卵丘颗粒细胞保存在-80℃下直到RNA提取。KGN细胞培养于含10%胎牛血清的DMEM/F12培养基中,293T细胞培养于含10%胎牛血清的DMEM高糖培养基中,细胞培养保持在37℃、5%CO2的环境。
4.RNA提取和qRT-PCR:按照miRNA分离试剂盒说明书提取颗粒细胞总RNA和miRNAs,QuickDrop测定其浓度和纯度,分别按照SPARKscriptⅡRT-Plus逆转录试剂盒和miRcute-Plus-miRNA第一链cDNA试剂盒说明书逆转录mRNA和miRNA为cDNA。按照SYBR Green Premix Pro Taq HS qPCR Kit说明书操作,应用QuantStudioTM5 qRT-PCR仪进行扩增反应,分别以GAPDH和U6作为mRNA和miRNA的内参。引物序列如下:GAPDH上游:5′-GAGTCAACGGATTTGGTCGT-3′,下游:5′-AATGAAGGGGTCATTGATGG-3′;CYP19A1上游:5′-GACTTTGCCACTGAGTTGATTT-3′,下游:5′-CGATCAGCATTTCCAATATGCA-3′;U6上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′;miR-1270:5′-GGAGATATGGAAGAGCTGTGT-3′;UnivR-miR:5′-AACGCTTCACGAATTTGCGT-3′。mRNA和miRNA均采用以下扩增反应条件:95℃预变性30 s,然后按95℃ 5 s,55℃ 30 s,72℃ 30 s,40个循环。每组重复3次,采用2-△△CT法分析各基因的相对表达量。
5.双荧光素酶报告基因实验:在NCBI中查找CYP19A1基因3′UTR序列,根据生物信息学预测与miR-1270的结合位点,设计包含结合位点的序列及突变型序列,长360 bp,由北京擎科新业生物技术有限公司合成并连接于pmirGLO载体上。用感受态大肠杆菌DH5a转化,挑取阳性单菌落进行摇菌并提取质粒。含有结合位点的质粒为野生型(CYP19A1-WT-3′UTR),将结合位点全部突变的质粒为突变型(CYP19A1-MUT-3′UTR)。转染前1 d接种适量的293T细胞于48孔板,使转染时细胞密度达到70%~80%,每组设置3个重复孔。共分为4组,野生型实验组:CYP19A1-WT-3′UTR质粒+miR-1270 mimic;野生型对照组:CYP19A1-WT-3′UTR质粒+mimic NC;突变型实验组:CYP19A1-MUT-3′UTR质粒+miR-1270 mimic;突变型对照组:CYP19A1-MUT-3′UTR质粒+mimic NC。按照lipofectamine2000说明书进行转染,并于转染后6~8 h更换新的培养液。转染24 h后,按照双荧光素酶报告试剂盒说明书使用酶标仪(BioTek,美国)检测荧光素酶活性,结果以相对荧光素酶活性(萤火虫荧光素酶/海肾荧光素酶)表示。
6.蛋白质印迹实验:miR-1270 mimic或inhibitor转染48 h后,收集KGN细胞,用RIPA裂解液和蛋白酶抑制剂(PMSF)在冰上裂解。每个蛋白质样品用8%SDS-PAGE凝胶分离,然后转移到PVDF膜上。室温下用5%牛血清白蛋白(BSA)封闭1.5 h,并与CYP19A1或β-actin(1∶1 000稀释)一抗在4℃下培养过夜。然后用PBST清洗这些膜,并在室温下与HRP标记的二抗(1∶2 000稀释)孵育1.5 h。PBST清洗后,使用超敏化学发光液在VIBER Newton 7.0成像系统检测条带灰度。以β-actin灰度值作为内源性对照得到CYP19A1的相对表达量。
7.酶联免疫吸附实验:miR-1270 mimic或inhibitor转染48 h后,收集KGN细胞的上清液,以1 000 r/min在4℃离心10 min后,将上清液收集后,按照酶联免疫吸附测定试剂盒说明书,使用酶标仪检测E2水平。
四、统计学分析

结 果
一、不孕患者的一般资料和临床特征
PCOS组不孕患者的窦卵泡数、BMI、AMH、LH、LH/FSH、PRL、T均显著高于对照组(P<0.05),FSH略低于对照组但尚无显著性差异(P>0.05);促排卵之后,PCOS组的获卵数也显著高于对照组(P<0.05);但胚胎形成率组间比较差异无统计学意义(P>0.05)。两组间年龄、不孕年限、P、E2、FBG差异无统计学意义(P>0.05)(表1)。

表1 PCOS和对照组不孕患者的一般资料和临床特征比较(-±s)
二、生物信息学方法预测miR-1270靶基因
通过RNA22和RNAhybrid在线数据库工具筛选出miR-1270的靶基因,取其交集共计9 282个基因(图1)。在KEGG上富集信号通路,最终选择卵巢类固醇生成途径中的限速酶CYP19A1作为研究对象(图2)。
三、miR-1270和CYP19A1在卵丘颗粒细胞中的表达水平
qRT-PCR检测miR-1270和CYP19A1在PCOS患者卵丘颗粒细胞中的表达变化。统计结果显示,与对照组相比,miR-1270在PCOS患者卵丘颗粒细胞中的表达量显著降低(P<0.05)(图3A),而CYP19A1的表达量显著上升(P<0.05)(图3B)。
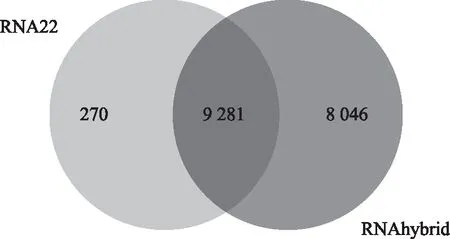
图1 生物信息学工具(RNA22和RNAhybrid)预测miR-1270的候选靶基因
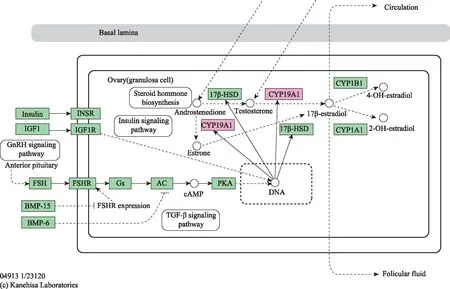
图2 KEGG信号通路分析:CYP19A1参与的卵巢类固醇生成通路示意图(来源:https://www.genome.jp/kegg-bin/show_pathway?157899344364697/hsa04913.args)
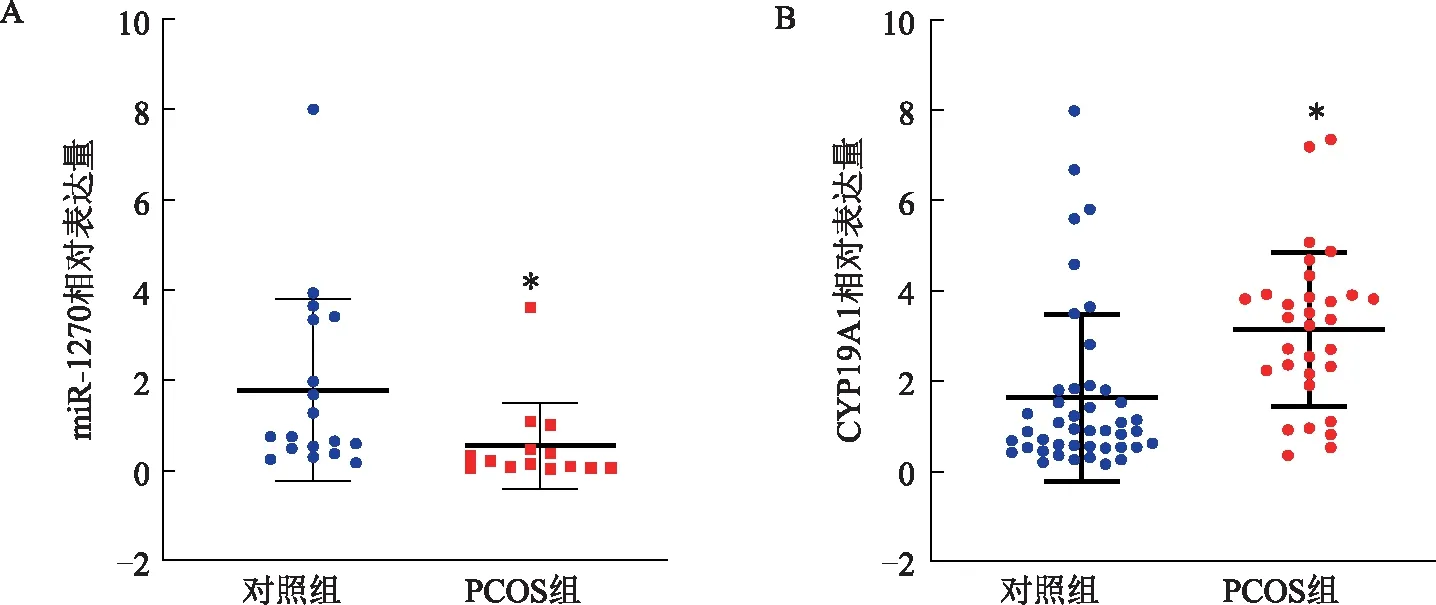
与对照组比较,*P<0.05图3 miR-1270和CYP19A1在PCOS和对照组患者卵丘颗粒细胞中的表达水平比较
四、miR-1270通过靶向CYP19A1抑制KGN细胞E2合成
双荧光素酶报告基因系统检测发现miR-1270 mimic可显著抑制CYP19A1野生型3′UTR报告载体的荧光素酶活性,而对突变型无明显抑制作用(图4A)。Western Blot分析发现CYP19A1的表达在miR-1270的过表达后显著下调(P<0.05)(图4B)。而抑制miR-1270可以在mRNA和蛋白质水平增强KGN细胞中CYP19A1的表达(P<0.05)(图4C)。用miR-1270 mimic转染KGN细胞可显著减少E2的产生(P<0.05);相反,miR-1270的抑制剂增强了KGN细胞培养基中E2的产生(P<0.05)(图4D)。

A:模式图显示了荧光素酶报告基因中miR-1270与CYP19A1的预测结合位点,野生型或突变型结合位点以红色字体表示。柱状图显示野生型实验组CYP19A1-WT-3′UTR质粒+miR-1270 mimic、野生型对照组CYP19A1-WT-3′UTR质粒+mimic NC、突变型实验组CYP19A1-MUT-3′UTR质粒+miR-1270 mimic和突变型对照组CYP19A1-MUT-3′UTR质粒+mimic NC荧光素酶相对表达量(CYP19A1-WT-3′UTR质粒+miR-1270 mimic与CYP19A1-WT-3′UTR质粒+mimic NC比较,*P<0.05)。B~D:分别用Western blot实验、qRT-PCR实验、ELISA实验检测转染miR-1270 mimic或inhibitor后CYP19A1的蛋白水平、mRNA水平和终产物E2的水平。与同组中对照组比较,*P<0.05,**P<0.01。图4 miR-1270通过靶向结合CYP19A1抑制KGN细胞E2合成
讨 论
PCOS是育龄期女性常见的内分泌性疾病,主要的临床表现为高雄激素血症、月经异常、肥胖和不孕。而引起不孕的主要原因是卵泡发育障碍,其卵泡发育停滞在窦状卵泡阶段[15-16]。近年来的研究发现,非编码RNA在多种疾病中均有参与。其中的miRNA是一种保守的、内源性的、非编码的、小的单链RNA分子,在细胞各个功能中起着重要的调控作用[17],如凋亡、增殖和信号转导。miRNAs可以选择性地分泌到血液、血浆或血清甚至卵泡液中,并被认为是治疗的靶点或不同疾病诊断的生物标志物[18]。比如miR-143-3p通过靶向KLF5并失活Wnt/β-catenin途径抑制人牙周膜细胞的成骨分化[19];miR-146a-5p可以抑制坏死性小肠结肠炎(NEC)中的NLRP3下游炎性因子和CLIC4的表达进而减轻NEC引起的肠道炎症和肠道损伤[20]。
近年来许多研究发现,miRNA在PCOS患者的卵泡液[21-22]、卵丘颗粒细胞[23]甚至血液[24-25]里异常表达,并且通过调节细胞增殖、凋亡、激素的生物合成和分泌参与PCOS的发病过程。近期研究表明,miRNA能够通过靶向结合多种下游mRNA,调控激素合成[26-27],进而影响卵泡发育。比如lncRNA ZFAS1/miR-129/HMGB1轴和lncRNA PVT1/miRNA-17-5p/PTEN轴都能抑制PCOS颗粒细胞凋亡并促进E2和孕激素(P4)的分泌,进而影响PCOS的卵泡发育[28-29];miR-155可以作为血液标志物监测PCOS高雄激素血症和抗雄激素的治疗效果[30]。
本研究通过qRT-PCR及后续的转染实验,首次揭示了PCOS患者卵丘颗粒细胞中miR-1270及其靶基因CYP19A1的表达及作用。首先通过生物信息学预测和双荧光素酶报告基因实验,找到与卵巢类固醇生成通路有关的miR-1270靶基因,预测信息和实验结果均证实CYP19A1是miR-1270的靶基因。同时,实验表明,与对照组相比,PCOS组患者卵丘颗粒细胞中miR-1270表达量显著降低,而CYP19A1的表达量显著增高。进一步用qRT-PCR和Western blot在KGN细胞系进行功能验证,发现CYP19A1的表达受miR-1270的影响,miR-1270过表达时CYP19A1的表达受到抑制,而敲低miR-1270时则相反。进一步采用ELISA对miR-1270是否影响CYP19A1的终产物E2进行验证,发现上调miR-1270能够使KGN分泌E2的能力降低,进一步证实miR-1270能够靶向结合CYP19A1抑制E2合成。
有研究证明,类固醇激素生成酶,如CYP11A1、CYP19A1和3β-HSD,在PCOS小鼠的颗粒细胞中增加,同时伴随E2和P的增加[31]。P450scc、3β-HSD、P450arom(CYP19A1)在PCOS妇女多囊卵巢和其他动物模型中的表达也较高[32-33]。CYP19可能作为PCOS表型的遗传修饰物[34]。已有研究表明雌激素是卵巢甾体生成途径的最终产物,因此芳香化酶可以作为选择性抑制的靶点。芳香化酶抑制剂,如来曲唑,在临床上广泛应用于PCOS排卵诱导[12]。来曲唑治疗后E2水平和芳香化酶活性显著降低[35],此外,没有证据表明终产物E2对CYP19A1有抑制作用[36]。来曲唑治疗PCOS的作用机制可能是通过抑制芳香化酶抑制雌激素的分泌,进一步减弱雌激素对下丘脑/垂体轴的负反馈作用,促性腺激素分泌增加刺激FSH生物合成[12,37-38]。FSH促进芳香化酶表达,然后显著加速卵泡发育[39-40],但具体的分子机制尚不明确。PCOS不孕患者伴随miR-1270降低,减少靶向调控CYP19A1的作用,促进芳香化酶的产生,进而增加雌激素的合成,影响PCOS卵泡的发育(图5)。本研究为芳香化酶抑制剂的临床应用提供了新的分子理论依据。

图5 PCOS患者和正常人的颗粒细胞中miR-1270对卵泡发育的影响示意图
综上所述,miR-1270和CYP19A1在PCOS患者卵泡发育障碍方面发挥重要作用,本研究有助于进一步了解PCOS的病理生理机制,特别是雌激素分泌的调节对卵泡发育的影响,以期为PCOS靶向诊治提供新思路。

