上海进口水产品中副溶血性弧菌耐药性、毒力基因和遗传特征
申进玲,赵丽娜,*,韩 伟,许镇坚,蒋 原,,*,杨捷琳,郭德华,薛 峰
(1.上海海关动植物与食品检验检疫技术中心,上海 200135;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
副溶血性弧菌是全球范围内引起水产类食物中毒的首要病原菌,尤其在中国、日本在内的亚洲国家和美国等地区。副溶血性弧菌在美国每年引起约8万 例疾病以及100 人死亡[1],中国台湾、日本和东南亚近50%的食物中毒事件是由副溶血性弧菌引起[2]。副溶血性弧菌可在水生动物的肠道内黏附、聚集和繁殖,引发水生动物疾病,给海水养殖业带来巨大损失,亦可引起人类胃肠炎等疾病,严重者可引发伤口感染和败血症等[3]。溶血素是副溶血性弧菌最主要致病因子,包括不耐热溶血素(thermolabile hemolysin,TLH)、直接耐热溶血素(thermostable direct hemolysin,TDH)和TDH相关溶血素(TDH related hemolysin,TRH),分别由tlh、tdh和trh基因编码。TLH在副溶血性弧菌中高度保守,TDH具有细胞毒性、致死毒性和肠毒性,而TRH具有肠毒性,致病性副溶血性弧菌通常携带TDH和TRH中的1 种或2 种。近年来随着抗生素在水产养殖环节的滥用,细菌耐药性问题更加剧了副溶血性弧菌的风险。上海口岸进口水产品数量居全国第一,且样品来自各个国家地区,种类丰富,代表性强。上海及其周边沿海一带对水产品的消费量逐年递增。进口水产品中副溶血性弧菌的存在对我国食品安全和公共卫生带来极大威胁。研究我国进口水产品中副溶血性弧菌的分布情况、耐药性、毒力基因和遗传多样性,对保障我国人民生命安全和健康具有重大意义。因此本研究拟对不同国家进口水产品中副溶血性弧菌进行耐药、关键毒力基因和多位点序列分型(multi-locus sequence typing,MLST)分析,旨在为进口食品风险科学预警和溯源提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用68 株副溶血性弧菌菌株由2017—2019年上海口岸进口的400 份水产品中分离,样品来自全世界16 个国家(地区),样品种类涵盖鱼、虾、贝、蟹等常见海产品和淡水产品等(表1)。所有菌株经生化和分子生物学鉴定确证为副溶血性弧菌。
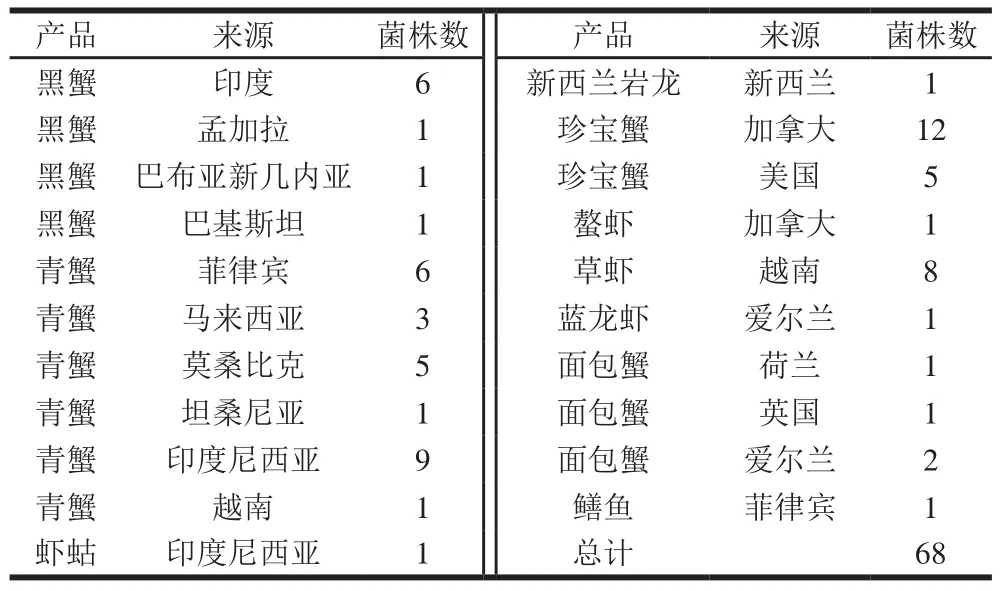
表1 副溶血性弧菌菌株来源信息Table 1 Information about the sources of Vibrio parahaemolyticus isolates
药敏实验所用质控菌株为大肠埃希氏菌标准菌株ATCC25922。分子生物学鉴定所用菌株为副溶血性弧菌标准菌株ATCC33847(tdh+)和ATCC17802(trh+)。所用质控菌株均为本实验室保存。
1.1.2 培养基与试剂
弧菌显色培养基 法国科玛嘉公司;3%氯化钠胰蛋白胨大豆琼脂 北京陆桥技术股份有限公司;Mueller-Hinton琼脂、药敏纸片 英国Oxoid公司;实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)预混液、PCR预混液、DNA Marker DL2000 宝日医生物技术(北京)有限公司。引物探针由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
Vitek全自动微生物生化鉴定仪(梅里埃)、ABI7500 fast实时荧光PCR仪 美国Applied Biosystems公司;5415R离心机 德国Eppendorf公司;ND-1000分光光度计 美国Nano-Drop科技公司;电泳槽、电泳仪美国Bio-Rad公司。
1.3 方法
1.3.1 菌株纯化与鉴定
使用无菌接种环,将菌株划线接种至副溶血性弧菌显色培养基上,37 ℃培养过夜,挑取紫色单菌落,再次划线接种于3%氯化钠胰蛋白胨大豆琼脂上培养过夜。用一次性无菌接种环挑选适量菌落于3 mL无菌生理盐水中充分混匀,制成麦氏浊度为0.5的菌悬液,使用全自动微生物生化鉴定仪进行鉴定。
1.3.2 DNA模板制备
DNA制备方法采用煮沸裂解法。用无菌枪头吸取500 μL 1.3.1节菌悬液于1.5 mL离心管中,100 ℃煮沸15 min后,冷却至室温,12 000×g离心2 min,取上清液备用。对符合生化实验的菌株采用PCR方法扩增副溶血性弧菌特异的tlh基因[4]。
1.3.3 药敏实验
采用WHO推荐的纸片扩散法。共测试对8 类15 种抗生素的耐药性。包括青霉素类:氨苄西林(ampicillin,AMP)、阿莫西林(amoxicillin,AMC)、哌拉西林(piperacillin,PRL);青霉烯类:美罗培南(meropenem,MEM)、亚胺培南(imipenem,IPM);头孢类:头孢他啶(ceftazidime,CAZ)(第3代)、头孢噻肟(cefotaxime,CTX)(第3代)、头孢西丁(cefoxitin,FOX)(第2代);氨基糖苷类:阿米卡星(amikacin,AK)、庆大霉素(gentamicin,CN);氟喹诺酮类:环丙沙星(ciprofloxacin,CIP)、左氧氟沙星(levofloxacin,LEV);氯霉素类:氯霉素(chloramphenicol,C);四环素类:四环素(tetracycline,TE);磺胺类:磺胺新诺明(sulfamethoxazole,SXT)。依据美国临床实验室标准化协会的标准判定药敏结果[5]。以大肠埃希菌标准菌株ATCC 25922作为质控菌株。
1.3.4 毒力基因检测
副溶血性弧菌关键毒力基因tdh和trh检测所用引物探针、real-time PCR体系和条件按照文献报道进行[4,6]。
1.3.5 MLST分析

表2 副溶血性弧菌MLST PCR扩增和测序引物信息Table 2 Amplification and sequencing primers used in multi-locus sequence typing analysis of V. parahaemolyticus isolates
副溶血性弧菌的7 个管家基因recA、gyrB、dnaE、dtdS、pntA、pyrC、tnaA引物、PCR体系和反应条件参考网络数据库(https://pubmlst.org/vparahaemolyticus/info/protocol.shtml),PCR扩增和测序引物序列见表2。PCR产物送生工生物工程(上海)股份有限公司测序。采用Bioedit软件对分离株的每段基因序列与从MLST网站下载的参考菌株序列进行比对,将分离株的基因序列剪切后得到与参考菌株基因相同大小的片段。将经过剪切的每株菌的7 个基因序列按照相同的顺序首尾相接,得到3 961 bp的长片段。将所有菌株的3 961 bp片段导入至MEGA 6.06软件,采用UPGMA方法生成系统发育树图。
2 结果与分析
2.1 耐药结果分析
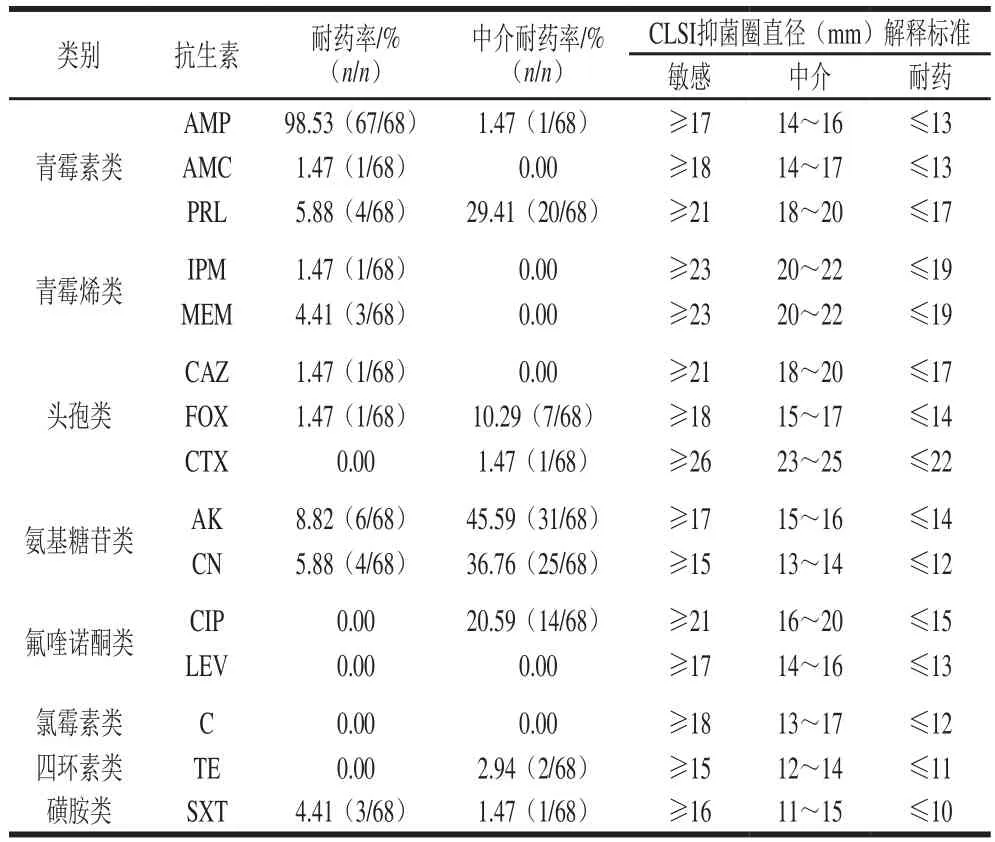
表3 68 株副溶血性弧菌药敏实验结果Table 3 Antimicrobial resistance of 68 V. parahaemolyticus isolates
如表3所示,68 株菌株对LEV和C均敏感,对其余抗生素不同程度地耐药,耐药率最高的是AMP,达98.53%,其次是AK(8.82%)、CN(5.88%)、PRL(5.88%)、MEM(4.41%)、SXT(4.41%)。对AMC、IPM、CAZ、FOX的耐药率较低,均为1.47%。同时,对9 种抗生素中介耐药,其中氨基糖苷类抗生素中介耐药率最高,分别达45.59%(AK)、36.76%(CN)。其他中介耐药率较高的抗生素依次为29.41%(PRL)、20.59%(CIP)、10.29%(FOX),其余抗生素中介耐药率相对较低(1%~3%)。不同地区和产品来源的菌株耐药情况未发现有明显差异。
如表4可知,79.41%的菌株表现出单一耐药,AMP是主要的耐药谱,耐受2 种及以上的菌株占20.59%,其中耐受2 种抗生素的耐药谱较分散,占比14.71%,有4 株耐3 种及以上抗生素,耐药谱分别为AMP-AK-CN(加拿大鳌虾F21),AMP-AK-CN-PRL(美国珍宝蟹F14、孟加拉黑蟹F43),AMP-CAZ-SXT-FOX-AMC-PRL-MEM(爱尔兰面包蟹F64),同时它们也均表现出对2 种抗生素的中介耐药。38.24%表现为单一中介耐谱,对2 种抗生素中介耐药的占25.00%,14.71%的菌株表现对3 种及以上的抗生素中介耐药。
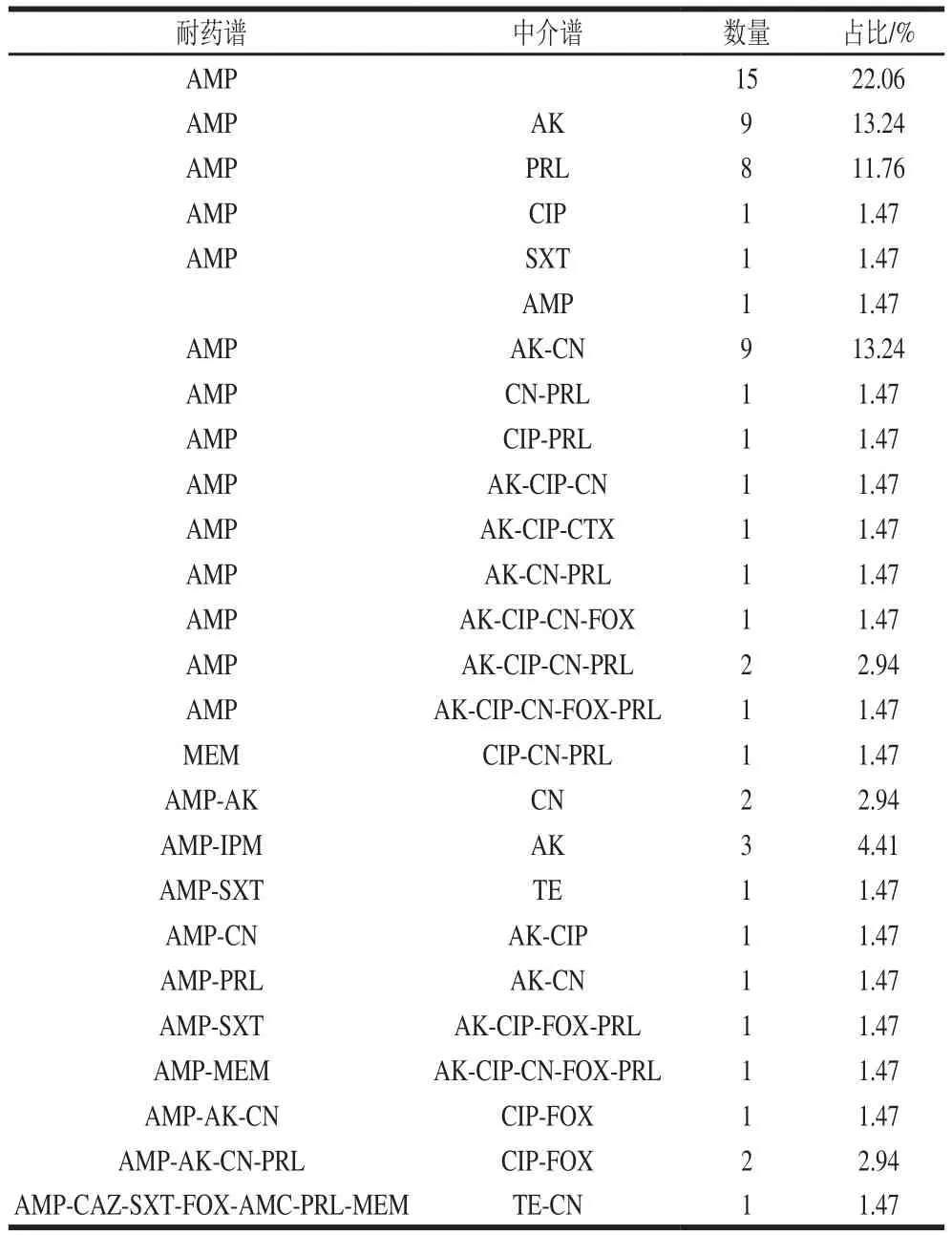
表4 68 株副溶血性弧菌耐药谱和中介谱分布Table 4 Resistance and intermediate resistance spectrum distribution of 68 V. parahaemolyticus isolates
2.2 毒力基因检测结果
所有副溶血性弧菌均为tlh阳性。只有来自印度黑蟹的1 株菌株(F108,未知ST型)检出trh阳性,其余均为阴性,检出率为1.47%(1/68)。所有菌株tdh检测结果为阴性。
2.3 MLST分析
MLST分析结果显示所测试的菌株具有高度遗传多样性。68 株菌株共发现65 种ST型,经与pubMLST数据库比较,只有13 种是已知报道的ST型,分别是ST163、ST423、ST150、ST338、ST340、ST744、ST500、ST2192、ST490、ST338、ST154、ST12、ST424。其余52 种ST型是新发现的,新ST型高达80%。52 种新发现的ST型中,35 株由于一个或多个位点基因突变,不能与pubMLST数据库完全匹配。

图1 不同国家不同食品类型来源副溶血性弧菌系统发育树Fig. 1 Phylogenetic tree of V. parahaemolytics isolates from various types of food imported from different countries
除了2 株recA不能扩增,其余66 株的亲缘关系见图1。副溶血性弧菌高度多样化,分别来自菲律宾和印度尼西亚青蟹中的2 株与其他菌株亲缘关系较远。剩余的菌株中,除了越南草虾中1 株(CXF3)和加拿大珍宝蟹1 株(F62),其余菌株可以分为2 簇:Ia和Ib。5 株欧洲(爱尔兰、荷兰、英国)来源的菌株中,4 株位于Ib;5 株来自莫桑比克青蟹的菌株中4 株位于Ia。未发现其他国家(地区)来源的菌株明显的聚类,如加拿大和美国珍宝蟹、越南草虾、印度尼西亚和菲律宾的青蟹、印度黑蟹分布均较分散。但发现某些从同一地区不同时间点进境的相同食品类型中的菌株ST型一致或非常接近,且这些ST型未在其他地区出现。如F103和F134均来自加拿大的珍宝蟹,但时间相隔1 个月,分别在2019年3月20日和4月16日进境,同属于一个未知的ST型;F58和F121均来自莫桑比克的青蟹,分别于2019年2月25日和4月8日进境,同属于ST338;F18(ST 163)和F79分别来自2018年12月印度尼西亚青蟹和2019年3月马来西亚青蟹,ST型只存在1 个碱基差异。
3 讨论和结论
弧菌一般对人用和兽用的抗生素敏感,但随着抗生素在人类、农业和水产系统的滥用,副溶血性弧菌也表现出对多种抗生素的耐药。据文献报道,副溶血性弧菌对AMP具有较高的耐药率,本研究测定的副溶血性弧菌对AMP的耐药率达98.53%,与国内外报道一致[7-10]。Elmahdi等[11]通过分析不同国家的副溶血性弧菌耐药谱,发现最常耐药的抗生素为AMP、盘尼西林和TE。本研究尚未发现TE耐药,但发现近3%菌株对TE中介耐药。值得注意的是,本研究菌株表现出对多种抗生素的中介耐药,其中氨基糖苷类抗生素中介耐药情况最突出,另外PRL、CIP和FOX中介耐药率也达到10%~30%,与国内外报道一致[7,12-17]。中介耐药说明菌株正在适应抗生素,需要引起重视。据报道,近年来副溶血性弧菌逐渐出现多重耐药现象[15,18-20],本研究也发现上海口岸进口水产品中20.59%的菌株表现出对2 种及以上的抗生素耐药。值得注意的是,深海水产品中副溶血性弧菌也发现多重耐药现象,说明抗生素耐药已经延伸到深海区域,今后应重点关注深海水产品中致病菌的耐药情况。
分子流行病学表明携带tdh和trh基因的副溶血性弧菌产毒株与人类食源性疾病的爆发密切相关,它们在临床菌株中检出率高,而在环境和食品中检出率很低[2,4,21]。于纪棉等[12]报道宁波口岸进口水产品中副溶血性弧菌的tdh和trh携带率分别为0.78%和0%,陈广全等[22]报道北京口岸进口鲜活海产品中副溶血性弧菌tdh和trh携带率均为5%,李薇薇等[23]报道我国国家食源性疾病监测网18 个省、自治区、直辖市水产品中副溶血性弧菌tdh和trh携带率分别为0%和2.08%,白瑶等[8]报道我国26 个省、直辖市和自治区水产品中分离的1 137 株副溶血性弧菌中tdh和trh检出率分别为0.3%和1.7%。本研究也发现水产品中副溶血性弧菌trh和tdh携带率极低,与以往报道相符[7,24-25]。因此,国内市场和进口水产品中均存在致病性副溶血性弧菌,对我国人民健康带来隐患,日后需要加强监测。
本研究测试的水产品中副溶血性弧菌菌株呈现高度的遗传多样性,与以往研究结果一致[26-28]。经pubMLST数据库查询,本研究发现的ST型中,ST338、ST340、ST774均在临床中报道过,因此这些菌株可能具有致病风险。65 种发现的ST型中,新发现的有52 种。新型如此之多,可能是由于副溶血性弧菌基因组通过突变和重组一直在改变[26,29]。有研究表明,副溶血性弧菌基因组高度重组,被称为半克隆(semi clonal)群体[30]。由于基因和基因簇在亲缘关系较远或较近的菌株间传播,因此基于MLST的分型分析较难找到与地域或食品类型高度相关的克隆株[8,17,26]。白瑶等[8]对我国水产品中20 株tdh和(或)trh阳性的副溶血性弧菌PFGE分析结果也显示,PFGE型别与耐药谱、地域来源以及食品类别均无明显关系,但来自河北省的5 株同源性较高。Urmersbach等[26]对来自斯里兰卡、厄瓜多尔、北海、波罗的海和德国环境和水产品中副溶血性弧菌MLST分析,也未发现ST型与地域之间有明显关系。本研究基于MLST分析的系统发育树图显示,国家(地区)、食品类别与MLST型和耐药性并无明显相关性,但发现某些地区来源的菌株在系统发育树图上呈现局部聚集,另外也发现某些ST型分别在相隔数月的时间在来自于同一国家同一食品中出现。这说明,在这些国家可能出现了新的流行克隆株,同时也说明MLST分析在副溶血性弧菌流行病学研究中可以监测并跟踪新的流行克隆,实现早期预警。
有研究报道recA基因存在重组导致的大量位点突变,因此有学者提出recA不是MLST中的理想位点[31]。本研究也发现在68 株菌株的7 个基因中,recA基因差异性最大,与pubMLST数据库相比,2 株具有多个位点突变,其他基因突变位点一般为1 个(结果未显示),另外还有2 株经过多次PCR未能扩增成功。已有不少报道证实,recA扩增不成功是有大片段插入recA基因位点所致,这种插入可对菌株的生物特性产生影响[32-33]。González-Escalona等[32]发现来自弧菌属的长片段插入秘鲁粪便样品中分离的副溶血性弧菌O4∶K8(菌株编号090-96)的recA中,后经对原始recA基因重建分析发现,其祖先为仅在亚洲出现的ST189,证实了菌株的跨海洋传播。Chen xiao等[33]在O4∶KUT中发现与菌株090-96同样的插入片段,基因组分析提示该菌株从O4∶K8进化而来,但插入片段的功能以及与K抗原之间的关系尚未可知。因此未来将对本研究中recA扩增不正常的菌株进行全基因组测序,以揭示插入片段在菌株进化中的作用。
综上所述,通过对上海口岸进口水产品中副溶血性弧菌进行耐药性、毒力基因和MLST分析,发现菌株存在中介耐药和多重耐药现象,尤其在深海水产品中也出现了多重耐药;发现某些ST型在临床中报道过,筛选到携带毒力基因的高致病性菌株,这些均具有高风险;发现某些国家可能存在新的流行克隆。这些均需要引起重视,并在今后工作中持续加强监测,以期为我国进口食品风险因子科学预警和溯源提供数据和技术支撑。

