5 株低产乙醇的非酿酒酵母筛选及其酿造特性
张博钦,方梓庄,成池芳,张如意,段长青,燕国梁,*
(1.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研发中心,北京 100083;2.农业农村部葡萄与葡萄酒重点实验室,北京 100083;3.新疆中信国安葡萄酒业有限公司,新疆 昌吉 832200)
由于全球气候变暖,成熟葡萄中含糖量不断增加,导致葡萄酒中乙醇含量升高[1]。葡萄酒中的乙醇可以赋予葡萄酒甜味,但其含量过高时会产生掩蔽效应,严重影响葡萄酒的风味特征,也不利于人体健康[2-3]。因此,生产乙醇含量较低的葡萄酒被国内外的酿酒师和研究人员广泛关注[4]。目前,普遍采用反渗透、膜过滤等物理方法生产低醇葡萄酒[5-7],但成本较高,同时还会造成葡萄酒中风味物质的损失,对低醇葡萄酒的品质产生不良影响[8]。除了物理降醇的方法,微生物降醇也是一种非常有效的方法,它是利用酿造特性优良的菌株降低葡萄酒中乙醇。该方法不仅能降低葡萄酒中乙醇的含量,还能避免葡萄酒的风味物质的损失,具有成本低、控制条件简单等优点[2,9]。
在葡萄酒酿造中,主要由酿酒酵母将糖代谢成为乙醇,其乙醇合成能力的强弱是控制葡萄酒中乙醇含量的关键[10-11]。为了降低酿酒酵母乙醇合成能力,研究者利用代谢工程和进化工程中的方法改造酿酒酵母,使乙醇的含量大幅下降,但同时会带来一些负面的影响,如菌株发酵活性降低,乙酸含量上升,风味物质含量下降等问题[12-13]。因此,筛选优良的降醇酵母一直是国内外研究的热点,优良的降醇酵母除了有低产乙醇的能力,还应具有较高的生长活力和风味物质的合成能力。
近年来,非酿酒酵母在葡萄酒酿造中的作用受到越来越多的关注。它是葡萄酒酿造中区别于酿酒酵母的一大类酵母的统称,主要包括:毕赤酵母(Pichia)、有孢圆酵母(Torulaspora)、汉逊酵母(Hanseniaspora)、梅奇酵母(Metschnikowia)、克鲁维酵母(Kluyveromyces)和假丝酵母(Candida)等[14]。大量研究表明,非酿酒酵母菌株能高产香气化合物(酯类、高级醇和挥发酸等),改善葡萄酒颜色和口感,提升葡萄酒的品质[15-16]。更重要的是,一些非酿酒酵母与酿酒酵母进行混合发酵还具有降醇的效果[17-18],主要包括美极梅奇酵母(M. pulcherrima)、星形假丝酵母(C.stellatoidea)、德尔布有孢圆酵母(T. delbrueckii)和葡萄汁有孢汉逊酵母(H. uvarum)等。例如,Rossouw等[19]分别使用仙人掌有孢汉逊酵母(H. opuntiae)和葡萄汁有孢汉逊酵母与酿酒酵母发酵皮诺塔吉葡萄汁,使乙醇体积分数下降0.80%和0.60%,高级醇和酯类物质的含量大幅提升,增加葡萄酒中花香、果香和坚果类的香气。Varela等[20]采用美极梅奇酵母和葡萄汁酵母(Saccharomyces uvarum)发酵美乐葡萄汁,使葡萄酒中乙醇体积分数降低1.00%,甘油、高级醇和酯类物质硫化物的含量增加,红色浆果类香气增强。Soden等[21]采用星形假丝酵母(Candida stellata)和酿酒酵母发酵霞多丽葡萄汁,使葡萄酒中乙醇体积分数降低0.70%,甘油和琥珀酸含量增加,葡萄酒中杏和蜂蜜的香气显著增强。
我国非酿酒酵母资源丰富,但目前国内葡萄酒生产企业使用的非酿酒酵母大多由国外进口[22]。这种生产方式不但会增加企业的生产成本,还会严重影响我国葡萄酒酵母资源的多样性,降低葡萄酒的产区特色[23]。为了获得本土低产乙醇的优良非酿酒酵母菌株,本研究以新疆、东北和湖南3 个葡萄酒产区分离得到38 株本土非酿酒酵母为研究对象,对其降醇和酿造特性进行研究。首先通过纯种发酵实验,筛选得到乙醇体积分数、乙醇产率和潜在乙醇体积分数均明显低于酿酒酵母的菌株。在此基础上,将其与酿酒酵母EC1118进行混合发酵实验,以期得到1 株具有低产乙醇且酿造特性优良的酵母,为生产低醇葡萄酒提供了优良的本土酵母资源,有助于促进我国低醇葡萄酒的生产。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及培养基
菌株:从湖南、辽宁和新疆分离得到的38 株野生非酿酒酵母,保藏于中国农业大学葡萄与葡萄酒研究中心[22],具体如表1所示。其中CVE-HV6保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC NO.4-161017。
YPD培养基:1.0%酵母浸提物,2.0%蛋白胨,2.0%葡萄糖;合成葡萄汁培养基[24]:200 g/L葡萄糖,0.3 g/L柠檬酸,5 g/L酒石酸,5 g/L苹果酸,2 g/L硫酸铵,5 g/L磷酸二氢钾,0.5 g/L硫酸镁,0.2 g/L氯化钠,0.05 g/L硫酸锰和1.5 g/L酵母提取物。
葡萄汁为2017年赤霞珠葡萄汁,采自河北怀来,还原糖214.88 g/L,pH 3.24。
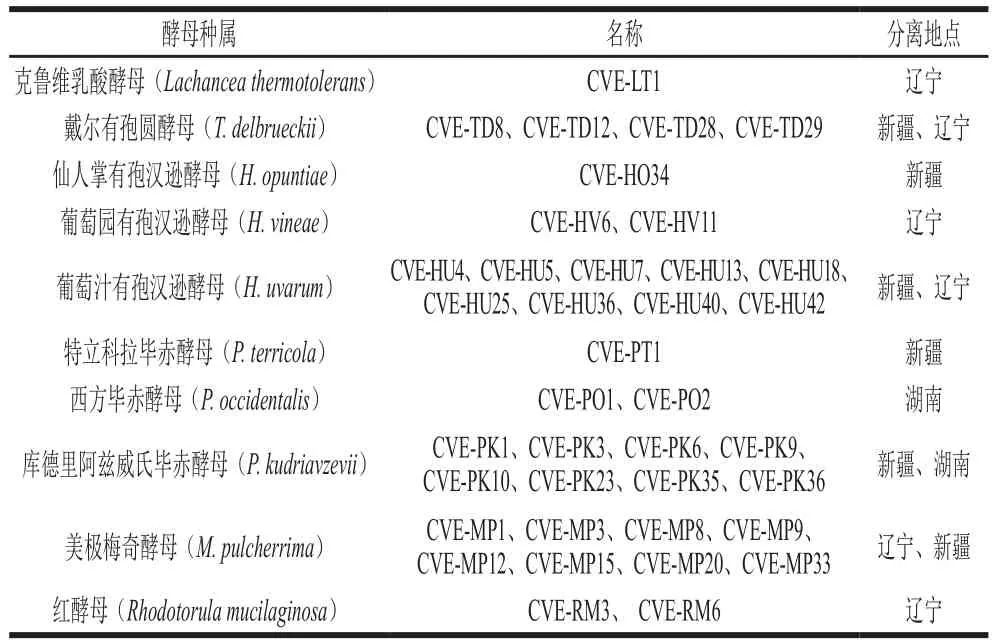
表1 实验用本土酵母菌株及分离地点Table 1 Species and geographical origins of indigenous strains used in this study
1.1.2 试剂
葡萄糖、果糖、浓硫酸、甘油、乙醇 北京化学试剂公司;蛋白胨、酵母浸粉、琼脂 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
HZ-2611 KA立式恒温摇床 太仓市华利达实验设备有限公司;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;JY10001电子天平 上海雷韵试验仪器制造有限公司;DL-CJ-2ND型超净工作台 北京东联哈尔仪器制造有限公司;1200高效液相色谱仪、6890气相色谱仪、5975B质谱仪、HP-INNOWAX毛细管柱美国安捷伦科技有限公司;HPX-87H色谱柱 美国Bio-Rad公司。
1.3 方法
1.3.1 非酿酒酵母菌株纯种发酵实验
为了初步筛选具有低产乙醇特性的非酿酒酵母,将38 株本土非酿酒酵母分别进行纯种发酵实验,以酿酒酵母EC1118作为对照。采用合成葡萄汁培养基进行单独培养发酵实验,接种量为106CFU/mL。发酵容器为250 mL带有橡胶塞和立式发酵栓锥形瓶,每个锥形瓶中装有150 mL灭菌后的合成葡萄汁培养基。将39 株酵母接种于15 mL YPD培养基中活化,30 ℃、180 r/min摇床培养1 d,低温(4 ℃)、6 000 r/min离心5 min后收集菌体,经无菌水洗涤后接入锥形瓶中。各菌株在(23±1)℃下静置发酵,每个菌株2 次生物学重复。每天测定各实验组的CO2质量损失情况,若连续2 d的质量变化小于0.2 g/100 mL,则认为发酵结束。发酵结束后,每个实验组取发酵液10 mL,10 000 r/min离心1 min后取上清液,于-20 ℃冻藏,用于主发酵产物的分析。通过比较各菌株的发酵速率、乙醇产量、乙醇产率、潜在乙醇体积分数等指标,初步确定具有低产乙醇特性的非酿酒酵母。
1.3.2 非酿酒酵母菌株混合发酵实验
将5 株具有低产乙醇潜力的非酿酒酵母与酿酒酵母EC1118进行混合发酵实验,进一步确定其在混合培养发酵中的酿造特性。采用巴氏灭菌后的赤霞珠葡萄汁(70 ℃、15 min),接种方式为延迟接种,即先接入初步筛选得到的非酿酒酵母菌株,4 d后再接入酿酒酵母,并以酿酒酵母单独培养发酵作为对照。非酿酒酵母和酿酒酵母的接种比例为10∶1,非酿酒酵母接种量为107CFU/mL,酿酒酵母接种量为106CFU/mL。混合培养发酵实验在250 mL带有橡胶塞和立式发酵栓的锥形瓶中密封进行,每瓶装有150 mL巴氏灭菌的葡萄汁。菌株接入锥形瓶后,在(23±1)℃下静置发酵,每个实验组做3 个生物学重复。通过测定各实验组中CO2质量损失情况监测整个发酵过程。发酵结束后,测定各实验组中主发酵产物和香气物质含量,进一步比较乙醇体积分数、香气成分含量等指标。
1.3.3 理化指标测定
主发酵产物的测定[15]:使用高效液相色谱仪进行葡萄糖、果糖、乙醇和甘油的测定。使用的色谱柱为HPX-87H(300 mm×7.8 mm),检测器为示差折光检测器。流动相为5 mmol/L的H2SO4溶液,流速0.6 mL/min。进样量20 μL,柱温45 ℃,分析时间30 min。每个样品测定时进行2 次重复。
香气化合物的测定[25]:使用气相色谱仪和质谱仪进行香气物质的测定。使用HP-INNOWAX毛细管柱。载气为高纯氦气(纯度99.999%),流速1 mL/min。柱温箱升温程序:50 ℃保持1 min,以3 ℃/min的速度升温至220 ℃,保持5 min。质谱接口温度为280 ℃,离子源温度为230 ℃,电离方式为电子电离,离子源能量70 eV,质量扫描范围m/z30~350。每个样品测定时进行2 次重复。
通过自动质谱解卷积和鉴定系统(AMDIS)和NIST 11质谱数据库确定香气化合物的保留时间、保留指数和质谱信息。利用质谱全离子扫描(Scan)图谱对所测香气化合物进行定性和定量分析。依据本实验已建立的相同色谱条件下所测香气化合物的保留时间、保留指数和质谱信息进行定性分析,通过配制该香气化合物在模拟酒溶液(合成酒溶液为2 g/L葡萄糖、7 g/L酒石酸和12%乙醇的水溶液,NaOH调pH值至3.3。将混合香气标准品配制成15 个梯度)中的标准曲线进行定量。
1.3.4 主要筛选指标的计算[26]

1.4 数据处理与统计分析
2 结果与分析
2.1 非酿酒酵母菌株纯种发酵实验
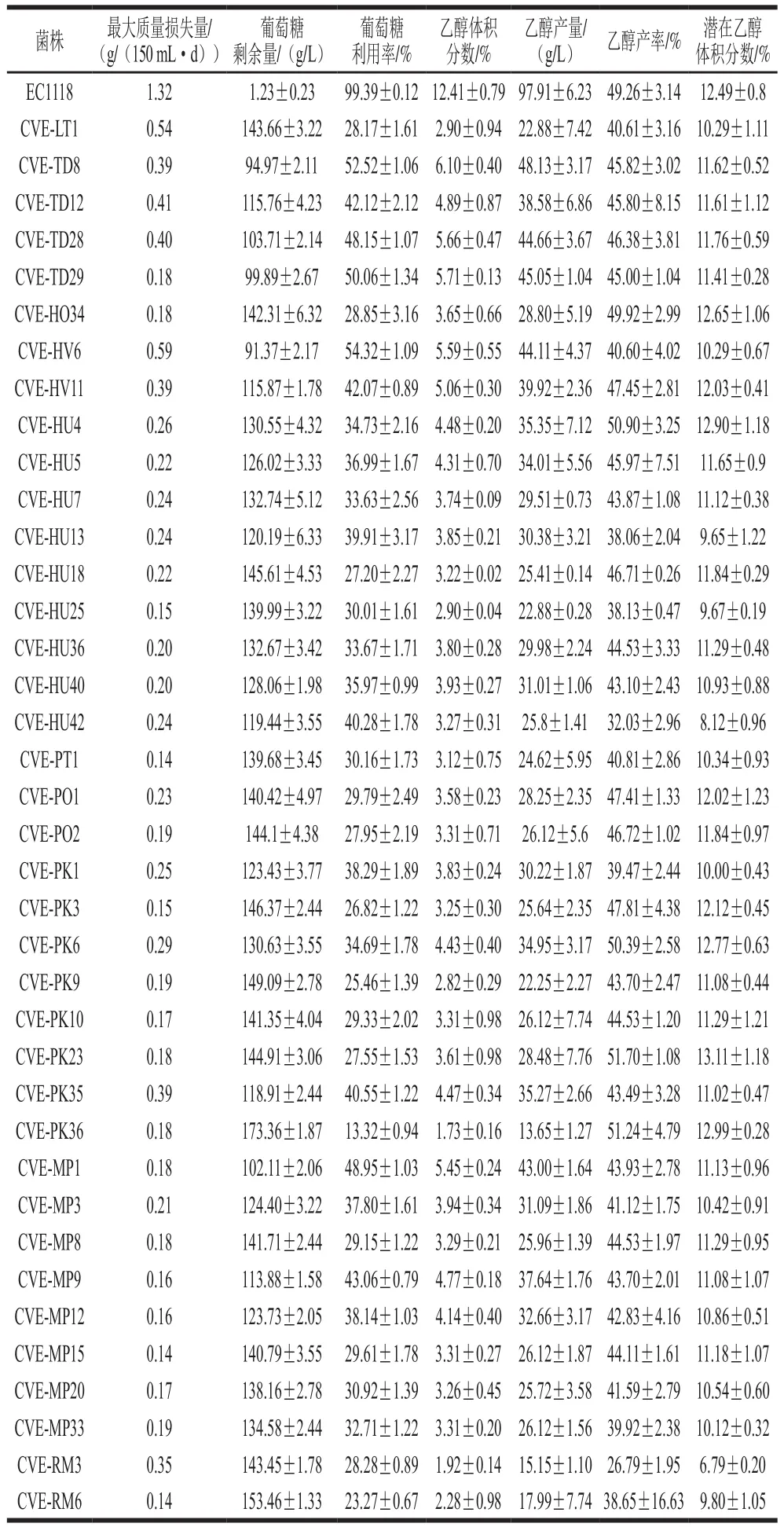
表2 单独培养发酵实验中发酵相关参数Table 2 Fermentation parameters with single cultures
38 株本土非酿酒酵母及1 株酿酒酵母的生长及主发酵产物如表2所示。酿酒酵母EC1118的生长速率明显高于非酿酒酵母,酿酒酵母EC1118的CO2质量损失量可达1.32 g/(150 mL·d),而非酿酒酵母的CO2质量损失量在0.14~0.59 g/(150 mL·d)。其中生长速率较快的5 株非酿酒酵母分别为CVE-HV6(0.59 g/(150 mL·d))、CVELT1(0.54 g/(150 mL·d))、CVE-TD12(0.41 g/(150 mL·d))、CVE-TD28(0.40 g/(150 mL·d))、CVE-TD8(0.39 g/(150 mL·d))。发酵结束后,酿酒酵母的葡萄糖利用率为99.39%,而非酿酒酵母的葡萄糖利用率在13.32%~54.32%。酿酒酵母的乙醇体积分数可达12.41%,非酿酒酵母的乙醇体积分数为1.73%~6.10%。其中乙醇体积分数较低的5 株非酿酒酵母分别为CVE-PK36(1.73%)、CVE-RM3(1.92%)、CVERM6(2.28%)、CVE-PK9(2.82%)、CVE-LT1(2.90%)。由于非酿酒酵母不能单独完成整个发酵,发酵液中存有大量的葡萄糖,导致非酿酒酵母发酵液中乙醇体积分数较低。这不足以说明非酿酒酵母低产乙醇的酿造特性。因此,本研究引入了乙醇产率和潜在乙醇体积分数2 个指标,以评价非酿酒酵母产乙醇的特性[26]。其中酿酒酵母EC1118的乙醇产率为49.26%,非酿酒酵母的乙醇产率为26.70%~51.70%,其中产率最低的5 株非酿酒酵母分别为CVE-RM3(26.79%)、CVEHU42(32.03%)、CVE-HU13(38.06%)、CVE-HU25(38.13%)和CVE-RM6(38.65%)。酿酒酵母EC1118的潜在乙醇体积分数为12.49%,非酿酒酵母的潜在乙醇体积分数为6.79%~13.11%。其中数值最低的5 株非酿酒酵母分别为CVE-RM3(6.79%)、CVE-HU42(8.12%)、CVE-HU13(9.65%)、CVE-HU25(9.67%)和CVE-RM6(9.80%)。
根据非酿酒酵母的生长速率、乙醇产率、潜在乙醇体积分数等指标以及非酿酒酵母种属的情况,初步筛选得到5 株非酿酒酵母,分别为红酵母CVE-RM3、葡萄汁有孢汉逊酵母CVE-HU42、库德里阿兹威氏毕赤酵母CVE-PK1、美极梅奇酵母CVE-MP33、葡萄园有孢汉逊酵母CVE-HV6。使用这些菌株进行葡萄汁发酵后,它们的乙醇体积分数、乙醇产率和潜在乙醇体积分数均远低于酿酒酵母EC1118,具有生产低醇葡萄酒的潜力。
2.2 非酿酒酵母菌株与酿酒酵母混合发酵实验
一般情况下,非酿酒酵母不能单独进行乙醇发酵,需要与酿酒酵母混合培养以保证乙醇发酵的顺利完成[27]。因此,分别将这5 株非酿酒酵母与酿酒酵母EC1118进行混合培养发酵实验(RM3/SC、HV6/SC、MP33/SC、HU42/SC和PK1/SC),进一步评价其酿造特性,并以酿酒酵母单独培养发酵(SC)为对照,测定各实验组中酵母菌株的发酵活性及最终样品中主发酵产物和香气成分的含量。
2.2.1 发酵活性
各实验组酵母菌株的发酵活性(以CO2质量损失量表示)如图1所示。对照组SC在第11天完成乙醇发酵,而混合发酵实验组也能够在第11~13天完成乙醇发酵。对照组SC的CO2质量损失速度明显快于混合培养实验组,最大CO2质量损失量可达11.34 g/150 mL。在混合培养实验组中,HV6/SC的CO2质量损失速度最快,而其余实验组在接入酿酒酵母后才开始迅速增加。发酵结束后,混合培养实验组的CO2质量损失量为9.25~10.65 g/150 mL,MP33/SC实验组的质量损失量最大。

图1 不同发酵条件下各实验组的发酵活性Fig. 1 Fermentation abilities of mixed cultures
2.2.2 主发酵产物分析

表3 不同发酵条件下主发酵产物的含量Table 3 Contents of major products from alcoholic fermentation with mixed cultures
如表3所示,乙醇发酵后,各实验组中葡萄糖和果糖的总量降低到2 g/L以下,甘油质量浓度为6.36(SC)~7.58 g/L(PK1/SC)。5 个混合培养的实验组均能够提升甘油含量,增幅为4.56%~34.91%。对照组SC中乙醇体积分数为9.46%,在混合培养的实验组中乙醇体积分数为8.74%~10.19%。其中,只有HV6/SC、MP33/SC和HU42/SC中乙醇体积分数低于对照组SC,分别下降了0.72%、0.16%和0.14%。
2.2.3 挥发性香气成分分析
香气是葡萄酒最重要的感官品质之一[28]。本实验采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用法测定了各实验组中香气成分的含量,结果如表4所示。本实验共检测到36 种香气物质,主要包括10 种酯类、11 种高级醇、5 种挥发酸、3 种羰基化合物、3 种萜烯类化合物、1 种降异戊二烯化合物等。
酯类物质能为葡萄酒提供令人愉悦的花香和果香,是葡萄酒香气的重要组成部分[29]。乙醇发酵后,各实验组酯类物质的质量浓度从低到高依次为6 145.41(SC)、7 206.69(RM3/SC)、10 512.71(MP33/SC)、15 862.08(PK1/SC)、22 364.34 μg/L(HV6/SC)和26 797.16 μg/L(HU42/SC)。相比于对照组SC,5 种非酿酒酵母混合培养均能够增加酯类物质总量,增幅为17.27%~336.05%。其中,共有5 种酯类物质的香气活力值(odor activity value,OAV)超过0.1,分别为乙酸乙酯、己酸乙酯、癸酸乙酯、乙酸异戊酯、乙酸苯乙酯。乙酸乙酯是葡萄酒中重要的香气成分,其质量浓度低于150 mg/L能够增加葡萄酒香气的复杂性[22]。各实验组中乙酸乙酯质量浓度为5.36~26.29 mg/L,HU42/SC中乙酸乙酯的含量最高,是对照组SC的4.90 倍。己酸乙酯和癸酸乙酯能够为葡萄酒带来青苹果和香蕉等香气[30],对照组SC中这2 种酯类物质质量浓度最高,分别为24.04 μg/L和295.99 μg/L。乙酸异戊酯质量浓度为171.87(PK1/SC)~177.40 μg/L(RM3/SC),各实验组之间差异不大。而乙酸苯乙酯在各实验组之间差异明显,其中HV6/SC质量浓度最高(1 920.14 μg/L),是对照组SC的36.04 倍。
高级醇是酵母代谢产生的次级产物,当葡萄酒中的高级醇含量低于300 mg/L时,对葡萄酒香气具有积极贡献,可增加葡萄酒香气的复杂性。但当其总量超过400 mg/L时,会产生令人不愉快的气味,导致感官葡萄酒品质下降[30]。各实验组中高级醇的总量由低到高分别为17 032.34(PK1/SC)、18 584.63(HU42/SC)、19 658.22(HV6/SC)、20 737.41(SC)、21 207.50 μg/L(RM3/SC)和22 275.87 μg/L(MP33/SC)。所检测到的11 种高级醇中只有1-己醇、异戊醇和2-苯乙醇的OAV超过0.1。其中,1-己醇会给葡萄酒带来生青味和植物味,其质量浓度为570.22(MP33/SC)~942.97 μg/L(HV6/SC)。异戊醇和2-苯乙醇分别为葡萄酒带来溶剂味和玫瑰味,MP33/SC中这2 种物质质量浓度最高,为10 332.18 μg/L和6 104.08 μg/L,分别是对照组SC的1.01 倍和1.50 倍。
挥发酸能够提高葡萄酒香气的复杂性,是葡萄酒中重要的一类香气物质[15]。各实验组中挥发酸总量由低到高依次是267.91(PK1/SC)、347.13(HU42/SC)、516.70(MP33/SC)、573.64(RM3/SC)、820.72(HV6/SC)、914.55 μg/L(SC)。所检测到的5 种挥发酸中己酸和辛酸的OAV超过了0.1,它们具有酸腐味和脂肪味,含量过高降低葡萄酒的感官品质。对照组SC中这2 种挥发酸的含量最高,分别为其余实验组的1.61~7.46 倍和1.63~12.52 倍。除此之外,癸醛、里那醇、4-萜品醇、β-大马士酮和4-乙基苯酚的OAV也超过了0.1。其中,里那醇在各实验组中差异较大,HV6/SC中质量浓度最高(21.52 μg/L),相比于对照组SC提升了49.03%,能够增加葡萄酒中的花香品质。

表4 不同发酵条件下香气成分的含量Table 4 Concentrations of aroma compounds produced by alcoholic fermentation with different mixed cultures
2.2.4 香气成分的主成分分析(principle compounds analysis,PCA)
为了直观展示各实验组之间的差异,对于OAV大于0.1的15 种香气物质进行PCA。由图2可知,2 个PC的总贡献率为70.3%,其中PC1的贡献率为40.0%,PC2的贡献率为30.3%。其中,HV6/SC位于第1象限,与里那醇、1-己醇、乙酸苯乙酯和4-乙基苯酚相关性强;对照组SC位于第2象限,与癸酸乙酯、癸醛、4-萜品醇、辛酸和己酸的联系紧密;MP33/SC和RM3/SC位于第3象限,与2-苯乙醇有较大关联;PK1/SC和HU42/SC位于第4象限,与乙酸乙酯相关。通过PCA发现,5 个添加非酿酒酵母的实验组与对照组SC均有较大的香气差异,不同非酿酒酵母能够增加葡萄酒香气的多样性,为酿造不同风格的葡萄酒提供更多的选择。
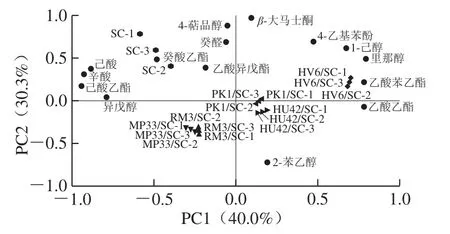
图2 不同发酵条件下香气物质的PCA图Fig. 2 Principal component analysis (PCA) plot for aroma compounds produced with different mixed cultures
3 讨论与结论
近年来,随着对非酿酒酵母的研究越来越多,通过非酿酒酵母降低葡萄酒中乙醇的含量是一种简单且可行的方案。由于非酿酒酵母对于乙醇的转化能力远低于酿酒酵母,在发酵过程中首先加入非酿酒酵母可以消耗大量碳源,从而降低葡萄酒中最终乙醇含量。更为重要的是,非酿酒酵母与酿酒酵母混合发酵能够改善葡萄酒的口感、颜色和香气复杂性,对葡萄酒的品质产生积极作用。
非酿酒酵母种类众多,不同非酿酒酵母的降醇效果存在很大的差异。其中,被广泛报道的美极梅奇酵母具有较强降醇能力,能够使葡萄酒中乙醇的含量下降0.9%~1.6%[32-34]。本实验所筛选得到的CVE-MP33也具有一定的降醇能力,但效果并不显著,可使葡萄酒中乙醇的含量降低0.16%。这可能是由于CVE-MP33的生长能力不强:前4 d的CO2质量损失量为1.29 g/150 mL,仅为对照组SC的13.63%。虽然该酵母在前期单独培养发酵实验中具有较低的乙醇体积分数(3.31%)、乙醇产率(39.92%)和潜在乙醇体积分数(10.12%),但过低的生长能力限制了其在混合培养发酵中降醇作用的发挥。在香气方面,CVE-MP33能够增加葡萄酒中乙酸乙酯、乙酸苯乙酯和2-苯乙醇含量。其中,2-苯乙醇含量在各实验组中最高,是对照组SC的1.50 倍,能够赋予葡萄酒玫瑰花香和蜂蜜甜香。Varela等[35]在霞多丽和西拉葡萄汁中接种美极梅奇酵母和葡萄汁酵母使葡萄酒中2-苯乙醇和乙酸苯乙酯的含量显著增加,这与本研究结果一致。但所选的CVE-MP33酵母生长活性较低,对葡萄酒中乙醇含量的降低效果有限,不适合低醇葡萄酒的生产。
葡萄汁有孢汉逊酵母也具有降醇效果,可使葡萄酒中乙醇含量降低0.94%~1.21%[17,34]。Laura[18]和Rossouw[19]等发现这种酵母会产生较多的乙酸乙酯,对葡萄酒的香气品质产生一定的负面影响。本实验筛选得到的CVEHU42可使葡萄酒中乙醇含量降低0.14%,也会高产乙酸乙酯,其质量浓度可达26.3 mg/L,是对照组SC的4.90 倍。本研究CVE-HU42中乙酸乙酯的产量远低于300 mg/L,能够增加葡萄酒中香气复杂性和果香。但是考虑到大规模生产中使用葡萄汁有孢汉逊酵母CVEHU42可能出现乙酸乙酯过量的情况,该菌株的酿造特性还需要更加细致的评价,并逐步扩大实验规模。
葡萄园有孢汉逊酵母是葡萄酒酿造中一种重要的非酿酒酵母,该酵母具有高产乙酸苯乙酯的特性,能够赋予葡萄酒玫瑰花香和水果香,提升葡萄酒的香气品质。Medina等[36]在霞多丽白葡萄汁中接种葡萄园有孢汉逊酵母02/5A,能够使乙酸苯乙酯的含量提升10.21 倍,增加葡萄酒中香蕉、梨、苹果和柑橘等水果的香气。Lleixà等[37]在马卡贝澳白葡萄汁中接种葡萄园有孢汉逊酵母T02/5AF,可使乙酸苯乙酯含量提升49.40 倍,增加葡萄酒中花香和果香。但目前还没有该酵母降醇效果的研究报道。本实验发现葡萄园有孢汉逊酵母CVE-HV6与酿酒酵母混合发酵可使葡萄酒中乙醇体积分数降低0.72%(与酿酒酵母单独发酵相比)。并且其高产乙酸苯乙酯(可达1 920.14 μg/L),是对照组SC的36.04 倍。CVEHV6还具有较强的发酵能力,前4 d CO2质量损失量可达7.42 g/150 mL,是酿酒酵母的78.35%,明显高于其余非酿酒酵母(图1)。该菌株在低产乙醇的同时,还具有较高的生长繁殖能力以及合成香气化合物的能力,具有生产低醇葡萄酒的潜力。
综上,本实验通过纯种发酵实验和混合发酵实验,从38 株本土非酿酒酵母中筛选得到1 株低产乙醇的菌株葡萄园有孢汉逊酵母CVE-HV6。该菌株在纯种发酵实验中,乙醇体积分数(5.59%)、乙醇产量(44.11 g/L)和潜在乙醇体积分数(10.29%)均远低于酿酒酵母EC1118;与酿酒酵母EC1118混合发酵可使葡萄酒中乙醇体积分数下降0.72%。CVE-HV6菌株还具有较强的生长活性,与酿酒酵母混合发酵能够显著增加乙酸乙酯、乙酸苯乙酯、2-苯乙醇和里那醇的含量,降低己酸和辛酸的含量,从而改善葡萄酒的香气轮廓。未来将进一步优化发酵条件(改变非酿酒酵母的接种方式和接种量),以继续提高CVE-HV6菌株降醇效果,满足实际生产的需要。

