正常体质量人群脂质蓄积指数与高尿酸血症相关性
李玲,张兰予,刘兴振,于静静
(1 中国人民解放军海军第971医院内分泌科,山东 青岛 266071; 2 中国人民解放军空军杭州特勤疗养中心疗养一区)
肥胖是高尿酸血症及其他慢性代谢性疾病的重要危险因素[1]。但高尿酸血症在体质量正常人群中亦不占少数[2],其原因可能与过量内脏脂肪堆积有关[3]。因此,评估体质量正常者是否存在内脏肥胖对高尿酸血症的预防和管理更具临床意义。脂质蓄积指数(LAP)是一项简单而有效的内脏肥胖评估指标,它通过腰围(WC)和三酰甘油(TG)来反映内脏脂肪堆积情况[4]。LAP已被证实与糖尿病、高血压等代谢性疾病显著相关。我们近期的研究也显示,LAP在普通人群中与高尿酸血症密切相关[5]。但是,目前还缺少LAP在正常体质量人群中与高尿酸血症相关性的临床研究。为此,本研究探讨了体质量正常人群LAP与高尿酸血症的相关性。现将结果报告如下。
1 对象与方法
1.1 研究对象
回顾性分析2014年1月—2017年12月在中国人民解放军海军第971医院和中国人民解放军空军特勤疗养中心健康体检人群的临床资料。纳入标准:具有完整的人体测量学和生化资料,年龄≥18岁且体质量指数(BMI)在18~24 kg/m2之间。排除标准:①服用降尿酸(UA)及调脂药物者;②妊娠或者患有其他急性或严重疾病者。最终有76 375例体质量正常的成年人被纳入本研究,根据UA水平分为UA正常组(A组)和高尿酸血症组(B组)。
1.2 资料采集
身高和体质量由电子测量仪自动测得。WC由有经验的护士用软尺手工测得,嘱体检者挺直站立,双脚稍分开,软尺沿髂骨最高点上缘水平一周的长度即为WC,测量时注意软尺要松紧适中[5]。收缩压(SBP)和舒张压(DBP)用欧姆龙电子血压计进行测量,连续测量3次,每次间隔1 min,取其平均值。采集体检者清晨空腹静脉血,利用全自动生化分析仪检测UA、空腹血糖(FPG)、TG、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。高尿酸血症定义为男性和绝经后女性UA≥420 μmol/L或者绝经前女性UA≥360 μmol/L。LAP利用下列公式计算获得:LAP(男)=(WC-65)×TG,LAP(女)=(WC-58)×TG。
1.3 统计学分析
2 结 果
2.1 两组基本临床资料比较
纳入的76 375例体质量正常者中,男性39 426例,女性36 949例;高尿酸血症的比例为16.2%。两组年龄、BMI、WC、SBP比较差异无显著性(P>0.05);高尿酸血症组的UA、DBP、FPG、TC、TG、LDL-C和LAP显著高于UA正常组,HDL-C则显著低于UA正常组,差异均有显著性(t=3.064~289.183,P<0.05)。见表1。
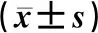
表1 两组基本临床资料比较
2.2 LAP与UA水平相关性分析
本研究正常体质量者的LAP与UA水平呈显著正相关(r=0.254,P<0.001);以性别分组后,LAP在男性组及女性组中也均与UA水平呈显著正相关(r=0.251、0.257,P<0.001)。
2.3 LAP与高尿酸血症相关性分析
本研究正常体质量者高尿酸血症的比例随着LAP三分位的递增而增加(图1)。单因素Logistic回归分析显示,LAP与高尿酸血症显著相关,男性中LAP最高三分位者高尿酸血症风险是最低三分位者的2.99倍(OR=2.99,95%CI=2.81~3.18,P<0.001),女性中LAP最高三分位者高尿酸血症风险是最低三分位者的3.05倍(OR=3.05,95%CI=2.87~3.24,P<0.001)。对年龄、吸烟、血糖及血压进行校正后,多因素Logistic分析结果依然显示LAP与高尿酸血症显著相关,男性中LAP最高三分位者高尿酸血症风险是最低三分位者的2.96倍(OR=2.96,95%CI=2.78~3.15,P<0.001),而女性中LAP最高三分位者高尿酸血症风险是最低三分位者的3.15倍(OR=3.15,95%CI=2.95~3.35,P<0.001)。见表2、3。
注:男性三分位区间的两个切点分别为11.2和20.9,女性为10.5和19.4。

表2 男性LAP与高尿酸血症相关性分析

表3 女性LAP与高尿酸血症相关性分析
3 讨 论
我国高尿酸血症的患病率自改革开放以来不断攀升,目前已超过2型糖尿病而达到了13.3%,某些东南沿海地区甚至高达20%~40%[6-7]。高尿酸血症患病率的分布特点为东部高于西部,沿海高于内地,城市高于农村[8]。本研究纳入的研究对象多为我国东部地区的健康体检者,前期研究报道该人群高尿酸血症的患病率为20.7%[5],而本次研究结果显示,在体质量正常人群中高尿酸血症的患病率也高达16.2%。这一结果提示,即使在体质量正常人群中,高尿酸血症的防控形势仍不容乐观。
高尿酸血症不仅能够导致痛风和肾脏损伤,与其他代谢和心血管疾病的密切关系也逐渐受到重视[9-10]。有研究通过时间关系分析发现,高尿酸血症可能出现在胰岛素抵抗之前,并通过胰岛素抵抗介导血压和血糖的升高[11]。因此,高尿酸血症的有效预防和积极管理对预防胰岛素抵抗相关疾病有着重要的临床意义。肥胖是高尿酸血症最为重要的危险因素之一[12],不管是生活方式干预还是减体质量手术带来的体质量降低都可以获得UA水平的改善[13]。所以,目前高尿酸血症防治指南均推荐对高尿酸血症病人进行积极的体质量管理[14]。
东亚人群体脂分布与欧美及非洲人群有着明显的差异,我国居民更易出现腹型肥胖和内脏脂肪的堆积。因此,体质量正常却存在代谢异常者在我国也比较常见[15]。但是,由于传统肥胖指标的自身局限性[16],体质量正常人群中代谢异常与正常者传统肥胖指标的差异往往不明显,这给进一步的体质量管理带来了不便。在本研究中,高尿酸血症组与UA正常组的BMI及WC均无显著差异。由此可见,BMI和WC等传统的肥胖指标并非体质量正常高尿酸血症病人体质量管理的有效指标。
体质量正常者出现高尿酸血症除与饮食和遗传等因素有关外,还与内脏脂肪过度堆积有关[17]。核磁共振、CT或者双能X线是测定内脏脂肪的金标准,但它们高昂的价格及潜在辐射风险限制了其临床应用[18]。为了弥补传统肥胖指标和影像学方法的不足,一些基于传统人体测量学指标和生化指标的新型肥胖指标被开发出来用于评价内脏肥胖[19]。LAP是KAHN[4]于2005年根据WC和TG与内脏肥胖的密切关系推导而来的。尽管他在推导的过程中未将核磁共振或CT测得的内脏脂肪量作为金标准进行回归分析,但后续的研究均显示LAP与CT测得的内脏脂肪面积有较好的相关性[20]。
尽管LAP与很多代谢性疾病都具有很好的相关性,但是由于种族差异的存在,LAP在中国人群中与不同类型代谢性疾病间的相关性还需要进一步验证。目前两项大型的基于中国人群的研究均证实LAP与高尿酸血症显著相关[21],但尚缺乏在体质量正常人群中LAP与高尿酸血症相关性的研究。本研究通过对大样本的健康体检人群进行分析,证实LAP在体质量正常人群中依然与高尿酸血症显著相关。这为体质量正常的高尿酸血症病人的体质量管理提供了新的、简便的工具。
综上所述,LAP作为简单经济的内脏脂肪评估指标在体质量正常中国人群中与高尿酸血症显著相关。因此,LAP有望成为体质量正常高尿酸血症病人体质量管理的新抓手,为提高这类高尿酸血症病人的管理质量提供帮助。

