基于“免疫微环境调控”的屏障膜研发理念
陈泽涛, 林义雄, 杨杰婷, 黄宝鑫, 陈卓凡
1.中山大学光华口腔医学院·附属口腔医院口腔研究所/种植科,广东省牙颌系统修复重建技术与材料工程技术研究中心,广东 广州(510055); 2. 中山大学光华口腔医学院·附属口腔医院种植科,广东省口腔医学重点实验室,广东 广州(510055); 3.中山大学光华口腔医学院·附属口腔医院珠江新城门诊,广东省口腔医学重点实验室,广东 广州(510055)
颌面部肿瘤、外伤、牙周炎症及牙齿缺失等导致的牙槽骨缺损在口腔临床上常见,其发病率高达83%,且随着年龄增长愈发严重[1]。牙槽骨缺损会导致牙根或种植体暴露,使牙菌斑易于积累并导致炎症的发生。炎症如果没有得到及时彻底的治疗,会逐渐发展破坏牙槽骨导致牙槽骨吸收,最终造成牙齿或种植体松动、脱落。此外,牙槽骨骨量不足会增加缺失牙修复的难度及风险,降低修复治疗的疗效[2]。随着人口老龄化进程的不断加速,食物及环境污染的不断加剧导致的肿瘤及畸形发病率增加,牙槽骨缺损已经成为严重影响人们身心健康的疾病[3],至今在临床工作中仍是棘手且急需解决的临床问题。因此,如何实现骨组织的再生成为缺损修复的关键。
对于牙槽骨骨量不足的病例,引导骨组织再生(guided bone regeneration,GBR)已经在临床上获得了良好的疗效[4]。由于牙槽黏膜直接衬附于牙槽骨表面,并且其生长速度比骨组织快,软组织更容易长入骨缺损进而干扰骨组织再生,因此需要使用屏障膜将骨再生区域与软组织分隔开,以提供充足的时间及空间引导成骨细胞进入,介导骨组织再生[5]。大量临床研究表明,GBR 对典型的牙槽骨缺损即水平骨缺损疗效确切,而对较大范围的骨缺损及垂直骨缺损疗效可预期性较差[6-7]。因此,研发具有稳定且高效的屏障膜来提高引导骨再生疗效具有重要的临床意义。本文首先述评了屏障膜的发展沿革并解析不同阶段屏障膜研发理念及其不足之处,进一步结合本课题组新近在涉及屏障膜与免疫系统交互作用的研究成果,提出基于“免疫微环境调控”的屏障膜研发理念,指导新一代“免疫微环境调控”屏障膜的研发,从而提高引导骨再生修复效果。
1 屏障膜的发展沿革及其研发理念和不足
回顾屏障膜发展沿革,最早的屏障膜研发主要是针对其理化性能及屏障功能,即能够阻挡牙槽骨周围成纤维细胞及上皮细胞的入侵,维持骨再生空间的同时对机体无毒副作用[8]。早在1982年,Nyman 等[9]就已经在非人灵长类上使用基于醋酸纤维素的细菌滤膜作为GBR 屏障膜,并观察到了牙周组织的再生。最早的屏障膜为不可吸收屏障膜,包括膨胀型-聚四氟乙烯、致密型-聚四氟乙烯、钛网、以及钛网加强的膨胀型-聚四氟乙烯膜[10-11]。然而,不可吸收屏障膜更多关注了理化及屏障性能,其不可降解的特性使得患者需要接受二次手术将屏障膜取出[12],同时其设计没有考虑对软组织愈合的影响,使得创口开裂、感染的发生率较高[13]。
针对不可吸收屏障膜的不足,研究者更多地关注降解性能与生物相容性,即通过使用具有良好生物相容性以及可降解的生物材料,开发出兼具屏障功能与降解性能,且拥有良好生物相容性的屏障膜。
可吸收屏障膜的成分主要可分为天然多聚物与合成多聚物两大类[14]。由于天然多聚物保留了原有的理化结构,因此具有良好的生物相容性能够诱导细胞长入,同时其降解产物与机体代谢产物相同,对机体无害。这其中,胶原膜在牙槽骨再生中得到了广泛的应用,并且在水平骨缺损的GBR 治疗中取得了肯定的疗效[15]。然而,胶原膜降解速度过快,空间维持能力不佳,且有潜在传播疾病的风险[16]。天然多聚物的不足,促成了合成多聚物的研发与运用。合成多聚物屏障膜主要由聚酯合成,部分合成多聚物屏障膜已商品化并在动物及人体上取得了良好的疗效[17]。合成多聚物不仅具有良好的生物相容性,而且能够通过调控其组分、浓度、制备工艺或理化交联等手段调控其降解速度及机械性能[18-19],但其酸性降解产物可能会干扰骨组织再生[20]。尽管可吸收屏障膜的理化及降解性能在不断优化,但可吸收屏障膜在垂直骨缺损及大范围骨缺损中的疗效仍然不具备可预期性[6-7]。
屏障膜的植入,不可避免地会改变整个局部微环境。真正调控骨再生过程的是屏障膜与多系统及细胞相互作用后所形成的新的局部微环境,而不仅仅依靠屏障膜的屏障及空间维持功能。简单地将屏障膜视为一个物理屏障,而忽略其他系统细胞及其形成的微环境所研发的屏障膜将可能对局部微环境产生不当的调控,导致不利于骨再生的局部微环境产生及失败的体内成骨。这提示屏障膜的研制不应只关注和强调膜的屏障功能,更应关注屏障膜与多系统及细胞相互作用后局部微环境的改变。新一代屏障膜应该强调对“局部微环境”的调控,才能避免屏障膜潜在的“微环境调控缺陷”,满足迫切的临床需求。
2 屏障膜与免疫微环境的相互作用及其指示意义
屏障膜作为“异己”成分植入体内后,会引发宿主持续的免疫反应即异物反应。生物材料植入机体后,血液从损伤的血管中渗出与材料表面接触并相互作用,继而血浆中的蛋白(白蛋白,球蛋白,纤维蛋白原等)、脂质及糖类迅速并自发地吸附到材料表面。其中,吸附的纤维蛋白原会暴露两个正常状态下隐匿的两个表位P1(γ190-202)和P2(γ377-395),进而触发凝血过程并激活补体通路。随后,大量中性粒细胞浸润聚集于生物材料周围,释放水解酶及活性氧(reactive oxygen spe-cies,ROS)降解生物材料,同时释放大量细胞因子和趋化因子如CXC 基序趋化因子配体8(CXC che-mokine ligand 8,CXCL8),CC 基序趋化因子配体2(C-C motif chemokine ligand 2,CCL2),CC 基序趋化因子配体4(C-C motif chemokine ligand 4,CCL4)招募并激活单核细胞分化为巨噬细胞。激活的巨噬细胞进入局部微环境后,识别纤维蛋白并粘附在生物材料表面,对生物材料进行吞噬或融合形成异物巨细胞一同参与生物材料的降解[21]。急性炎症期后,单核/巨噬细胞数量减少,同时适应性免疫细胞如T 细胞进入,胶原沉积,纤维形成,进入异物反应的慢性炎症及纤维包裹期[22]。
巨噬细胞在异物反应过程中起到了重要作用,不仅通过吞噬作用或释放生物活性因子对植入材料进行持续的降解,同时会持续释放趋化因子招募更多的单核/巨噬细胞。与创口愈合相似,粘附的巨噬细胞最终会向M2 型转换,分泌抗炎细胞因子如IL-10,促进胶原沉积和纤维形成。巨噬细胞表型的转换或吞噬作用受阻后,会通过细胞膜的融合形成异物巨细胞共同参与对生物材料的降解。释放的生物活性因子及降解碎片会改变局部免疫微环境[23-24]。
随着对机体与生物材料的深入理解,研究者认识到免疫系统是生物材料介导的功能组织再生的重要参与部分[25]。免疫系统是一个具有多向调节功能的系统。由于生物材料可以介导局部免疫反应,并且通过改变生物材料机械性能、理化性能等调控其引发的免疫反应[26-30]。因此,对再生生物材料的研发思路应该从传统的免疫抑制的研发思路转变为引导积极有利的免疫反应。
良好的免疫反应可以促进成骨、介导合适的屏障膜降解速度,而不当的免疫反应可能会导致持续的炎症,加速屏障膜降解,影响骨再生进程[31]。这说明了创造良好局部免疫微环境的重要性,然而这一调控作用和机制常常被忽视。忽略屏障膜对局部免疫微环境的调控作用不利于创造促进骨组织再生的微环境,对骨再生进程产生不良影响。因此,需要深入理解屏障膜的免疫调控性能,并使其获得有利于骨组织再生的骨免疫调控性能与降解性能。
2.1 免疫微环境与骨再生
研究者们认识到骨再生过程不仅只有骨相关细胞及骨骼系统参与,而是一个多系统、多细胞共同参与的过程[22]。如今,骨免疫学领域受到越来越多的关注,它将免疫反应视为骨骼愈合过程中的必要过程,而且还强调了免疫系统与骨骼系统的密切关系。
机体的骨骼系统和免疫系统共享多个细胞、细胞因子、受体、信号分子和转录因子,使两个系统之间相互联系、相互影响。免疫系统和骨骼系统中共享的核因子κB 受体活化因子配体(receptor activator of NF-κB ligand,RANKL)/核因子κB 受体活化因子(receptor activator of NF-κB,RANK)/骨保护素(osteoprotegerin,OPG)信号轴证实了两个系统之间的直接联系[32]。免疫细胞在调节骨骼动力学中起着至关重要的作用,而早期的免疫环境决定了再生结果。因此,成功的骨再生需要良好的骨免疫环境,具有良好的骨免疫调节性能的材料可以介导有利的骨免疫微环境,促进骨组织再生。机体骨组织的稳态主要由成骨与破骨活动的平衡维持。在病理状况下,由于机体成骨活动与破骨活动的平衡被打破,可能会导致骨质疏松、骨溶解、骨硬化症等疾病[33]。免疫细胞能够分泌多种细胞因子如炎性细胞因子[肿瘤坏死因子-α(tu-mor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)、干扰素-γ(interferon-γ,IFN-γ)和白介素-17(interleukin-17,IL-17)]、成骨相关细胞因子[骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)、血管内皮生 长 因 子(vascular endothelial growth factor,VEGF)]及破骨相关细胞因子[巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF),RANKL,OPG 参与调节机体的骨组织代谢平衡。这些细胞因子在不同的浓度和作用时间下对骨组织代谢起双重调节的作用[34]。传统观点认为炎性细胞因子可能会导致骨吸收。近来的研究表明,早期阶段炎性细胞因子在生理浓度范围内能够促进血管化,加速坏死组织、代谢产物的排出,介导合适的骨免疫微环境诱导矿化基质的产生[15]。同时研究者们发现,生理浓度的BMP-2 具有良好的促成骨作用[35],而高浓度的BMP-2 会抑制新生骨形成[36-37]。
由于骨组织持续地新陈代谢,功能性骨组织的改建必然伴随着破骨细胞活动。M-CSF、RANKL及OPG 是免疫细胞参与调节破骨细胞形成的三个主要关键细胞因子[38]。早期未成熟的增殖性单核-吞噬细胞被称为破骨细胞的前体。在骨重塑期间M-CSF 和RANKL 等信号因子的刺激下,巨噬细胞发生融合并最终分化为破骨细胞。成骨细胞可以分泌M-CSF,M-CSF 不仅参与了巨噬细胞和破骨细胞的增殖、分化和迁移,同时也是维持成熟破骨细胞功能活动所必需的细胞因子。机体主要通过RANKL/RANK 途径调控破骨细胞的活性。RANKL主要在成骨细胞、活化的T 细胞和中性粒细胞中表达,能够与破骨前体细胞RANK 表面受体结合以调节破骨细胞功能活动[39]。此外,活化的T 细胞还能够分泌多种细胞因子参与骨组织重塑。有研究表明,CD4+T 辅助细胞如Th1(I 型T 辅助细胞)及Th2(II 型T 辅助细胞)分别能够产生IFN-γ 和IL-4,两者均显示出抑制破骨细胞功能的作用[40]。其中,IFN-γ 可以诱导RANK 衔接蛋白肿瘤坏死因子受体相关因子6(tumor necrosis factor-associated factor 6,TRAF6)快速降解,从而抑制RANKL 诱导的转录因子NF-κB 及Jun N 末端激酶(Jun N-terminal kinase,JNK)的激活。因此,T 细胞对破骨细胞的作用取决于T 细胞分泌的多种细胞因子之间的平衡。尽管被募集到损伤部位的活化T 细胞在成骨细胞成骨向分化中主要起抑制作用,但在炎症后期组织重塑阶段,T 细胞被证实能够分泌成骨相关因子促进新骨形成,加速骨组织再生[41]。OPG 主要由骨骼的成骨细胞以及免疫系统中的B 细胞表达,OPG是RANKL 的诱饵受体,能够与RANKL 结合,从而阻断RANKL/RANK 的相互作用,防止骨骼过度吸收[38]。有研究显示,在骨缺损愈合过程中,B 细胞的数量超过T 细胞,被募集的B 细胞被证实能够通过提高OPG 的局部浓度下调破骨细胞活性,从而促进骨骼形成[42]。这意味着T 细胞和B 细胞共同参与了对破骨细胞的调控[43]。
在所有免疫细胞中,巨噬细胞由于在骨骼愈合过程中的多重作用和高可塑性而受到广泛关注。巨噬细胞在机体炎症及固有免疫反应中起到了关键作用。基于其独特的功能特性、表面标志物和诱导剂,巨噬细胞已被广泛表征为M1 和M2 表型。经典激活的M1 型巨噬细胞会分泌多种促炎细胞因子(TNF-α,IL-6,IL-1b)诱导破骨细胞生成并增强破骨细胞活性,从而导致骨吸收。替代激活的M2 型巨噬细胞通过释放抑炎细胞因子(IL-4,IL-10,IL-13)参与组织修复的后期[44]。体内外实验表明,在炎症中晚期,M2 型巨噬细胞不仅会分泌成骨相关因子(BMP-2 和VEGF)促进骨再生,同时还会分泌炎症和纤维化相关因子(TNF-α,TGF-β1,TGF-β3)促进病理性纤维化导致纤维包裹[45-46]。
巨噬细胞的表型会根据微环境的变化而发生动态变化,同时,巨噬细胞分泌的炎性细胞因子和基因表达也会由于表型的改变而变化,这个特性决定了它能够参与到骨愈合过程的各个阶段,从而影响局部免疫微环境。在急性炎症期,被募集到损伤区域的巨噬细胞通常表现为M1 型,通过趋化因子及促炎细胞因子的释放,协同募集更多的免疫细胞及间充质干细胞参与到缺损修复中。此后,随着局部炎症的消退,巨噬细胞表型转变为M2 型,分泌有助于细胞增殖分化和细胞外基质沉积的细胞因子(IL-4,IL-10 和TGF-β),参与缺损部位的再生及修复。持续较强的M1 型反应及M2 型反应缩短减弱导致严重的异物反应和慢性炎症,延迟组织愈合,最终导致生物材料整合的失败[47]。而合适的M1 型向M2 型的表型转换,有利于中后期M2 型巨噬细胞分泌促成骨相关因子,促进新骨再生[48]。有团队针对巨噬细胞在骨缺损修复再生中的表型转换,研发了具备良好免疫调节特性的仿生分层纤维内矿化胶原蛋白。该材料实现了对骨缺损再生中巨噬细胞表型的管控,显著增强了间充质干细胞成骨分化及骨组织再生[49]。因此,对巨噬细胞的深刻理解,特别是对免疫细胞因子释放和M1-M2 极化的正确调控,将为骨组织再生提供有效的调控途径。
2.2 免疫微环境与屏障膜的降解
使用可吸收屏障膜进行GBR 时,需要使用屏障膜阻挡软组织的长入,并持续至少4 周的时间允许成骨细胞的长入和分化。屏障膜过早的坍塌降解会使其失去屏障功能,导致组织再生的失败,而降解时间过长,反过来可能会增加屏障膜暴露及感染风险[14]。因此,良好的屏障膜降解性能能够介导有利于骨组织再生的局部微环境。
由于不同类型、大小及不同病因所致的牙槽骨缺损所需的愈合再生时间不同,因此需要可吸收屏障膜具有可控的降解速率以支持不同类型的牙槽骨组织再生。针对屏障膜的降解性能,已有大量团队针对其理化性能,如通过改变理化溶解、水解、酶解或腐蚀速度等方式调节屏障膜降解速度[50]。交联法是最常用的针对屏障膜降解性能的理化改性方法,并且已成功用于改善屏障膜机械性能和酶解速度。有研究使用天然交联剂京尼平优化静电纺丝壳聚糖纳米纤维,取代了传统有机溶剂三氟乙酸,避免了壳聚糖氨基之间氢键的破坏及断裂,从而显著改善了其机械强度,有效减缓了屏障膜降解速度。体外实验显示,未交联的膜通常在4 周后降解,但交联后的屏障膜在4~6 个月中仍能够保持膜的完整性,维持屏障功能[50]。然而,尽管通过交联改性的屏障膜能够维持更长的屏障时间,但交联剂的引入会使屏障膜在降解过程中引发更强且更持久的宿主炎症反应,导致更重的异物反应进而干扰骨组织再生进程[51]。
在屏障膜降解过程中,细胞介导的降解在生物材料降解中起到了重要作用,其中巨噬细胞和异物巨细胞(foreign body giant cells,FBGCs)是参与生物材料降解的关键细胞。有研究表明,当植入颗粒小于5 μm 时,巨噬细胞可以通过吞噬作用降解材料;当材料颗粒大于10 μm 时,由于吞噬作用受阻,巨噬细胞会融合形成FBGCs 进而提高其吞噬能力[21],同时FBGCs 通过释放活性氧,基质金属蛋白酶(matrix metalloproteinase-9,MMP-9)等降解酶协助参与植入材料的降解[25]。然而,目前细胞介导的屏障膜降解机制尚不清楚。因此,需要了解细胞介导的屏障膜降解的免疫调节机制,以更好地调控屏障膜降解性能。
3 基于“免疫微环境调控”理念的屏障膜应用研发
基于“免疫微环境调控”理念,用于GBR 的屏障膜不应被简单地视为被动的物理屏障,而应视为具有免疫调控能力的生物活性屏障。现有的屏障膜在屏障性能上无法满足临床需求,同时无法为骨生成和重塑提供最佳的微环境。针对屏障膜的两个关键问题,本课题组将“免疫微环境调控”的研发理念应用于改善屏障膜的降解及促成骨性能上,成功研发出具有骨免疫调控性能的新型屏障膜和具有可控免疫降解性能的新型屏障膜,不仅有效地建立了屏障膜的屏障作用,并且通过调控巨噬细胞的活化状态和极化方向创造了促进成骨的免疫微环境,证实了靶向调控巨噬细胞介导的骨免疫微环境,是优化胶原膜屏障功能和骨免疫调控性能,从而有效提高屏障膜介导的GBR 修复效果可行的研发方向。
3.1 通过机械性能及理化性能修饰后具有良好骨免疫调控性能的屏障膜
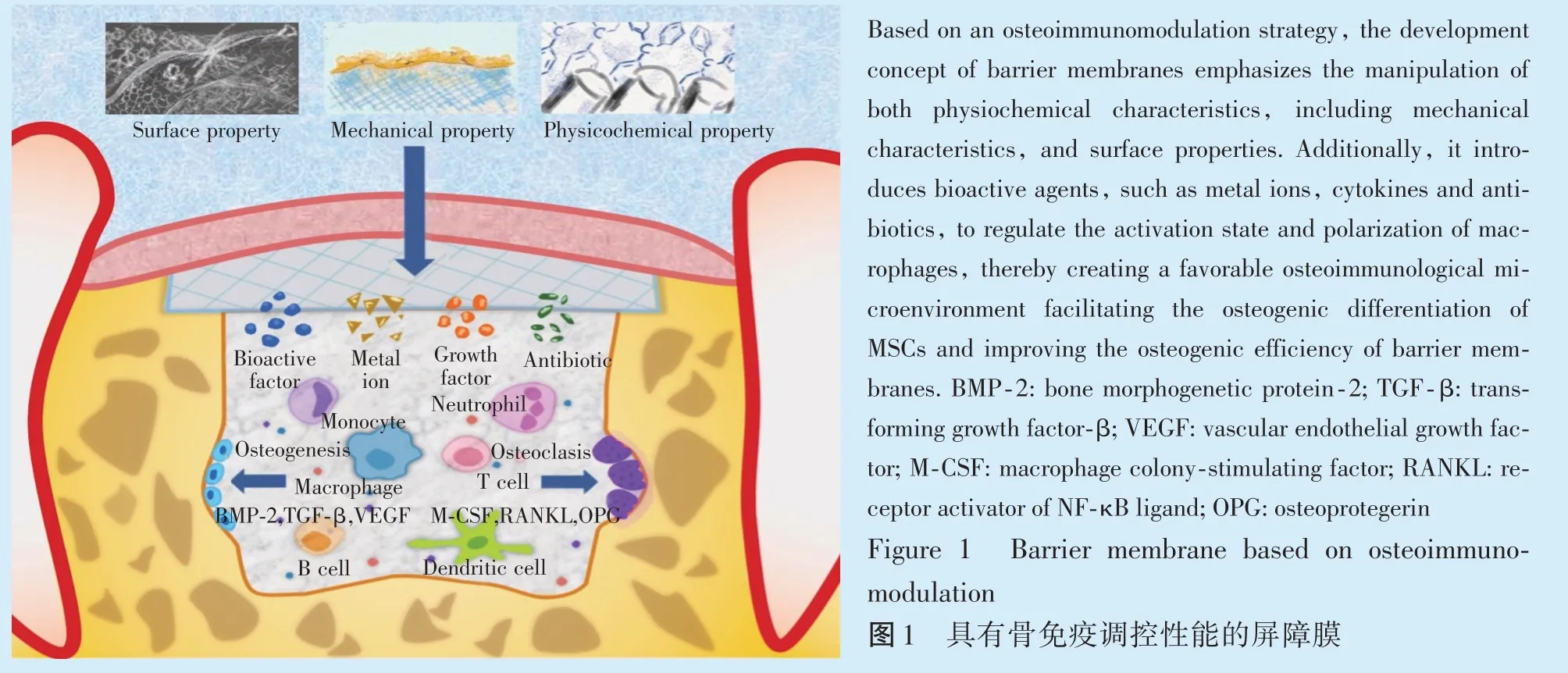
本课题组发现,将临床常用的可吸收性胶原膜植入体内后,机体会产生明显的免疫应答,同时胶原膜光滑面和粗糙面因为表面结构不同呈现不同的免疫应答[52]。胶原膜粗糙面组织会形成明显的单核细胞浸润带,通过免疫组织化学分析证实这一密集单核细胞浸润带以巨噬细胞为主。同时,体外实验也证明胶原膜不仅能促进巨噬细胞分泌促炎细胞因子(TNF-α、IL-1β、IL-6 和IL-18),还能通过释放成骨相关细胞因子[BMP-2,BMP-6、Wnt-10b 和抑瘤素M(oncostatin M,OSM)]促进间充质干细胞(mesenchymal stem cells,MSCs)的成骨分化,证实了胶原膜的有效骨免疫调控作用。因此,通过赋予屏障膜调控巨噬细胞极化、表型转换和局部免疫微环境的良好性能,从而研发具有良好骨免疫调控作用的屏障膜,可能是提高GBR 疗效的一个有效策略。
为了优化屏障膜的骨免疫调控性能,本课题组采用脉冲激光沉积技术于胶原膜表面均匀地涂布Ca2ZnSi2O7生物活性玻璃涂层。覆盖Ca2ZnSi2O7涂层的胶屏障膜在与巨噬细胞相互作用的过程中,缓慢地释放钙、锌和硅离子,刺激巨噬细胞上TNF-α 下调、IL-1β 上调,抑制炎性介质TNF-α,血清环氧化酶-2(cyclooxygenase-2,COX-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iN-OS)的基因表达和巨噬细胞中NO 和IL-6 的产生,同时,提高成骨相关因子如BMP-2,BMP-6,WNT-10b 及OSM 的表达,赋予了屏障膜优秀的骨免疫调控性能,有效促进成骨分化[52]。
此外,通过调控屏障膜机械性能、理化性能,引入生物活性分子、金属离子、生长因子、抗生素等[53-57],同样会影响巨噬细胞的活化状态与极化方向,赋予屏障膜良好的骨免疫调控性能(图1)。有研究表明,负载有免疫相关因子如IL-4 的胶原膜可以通过释放免疫因子,促进抑炎因子的表达,从而减轻炎症反应,加速炎症的消除[53]。有研究通过表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)交联修饰胶原膜,使其具有更好的机械性能和生物活性,同时可以下调促炎因子的表达,通过募集M2 型巨噬细胞,促进VEGF 和BMP-2 的分泌,上调Runt 相关转录因子-2(runt related transcription factor-2,RUNX-2)和OPG 的表达,该研究在EGCG 改性胶原膜中发现了厚而有序的新骨形成[54]。此外,EGCG 交联的胶原膜还能够通过募集M2 型巨噬细胞,促进生长因子的分泌和成骨分化,从而改善FBR,促进体内骨再生[24]。有研究通过向丝素蛋白掺入硫酸软骨素构建了具有微孔结构的混合膜,该膜表现出了更好的机械性能和更高的亲水性,同时能够下调促炎细胞因子的表达,上调成骨相关因子,通过抑制巨噬细胞的炎症反应,抑制破骨细胞生成以增强成骨作用。实验结果表明,SrCS/SF 复合膜具有良好的骨免疫调节特性[55]。聚己内酯(polycaprolactone,PCL)是一种可生物吸收和生物相容的聚酯材料,在临床骨缺损修复具有广泛的应用。有研究使用S-亚硝基谷胱甘肽和人骨髓间充质干细胞外泌体对PCL 屏障膜进行修饰改性后,观察到炎性细胞因子如IL-6,TNF-α,iNOS 和IL-1β 等基因表达发生显著变化,证实该膜可显著减轻炎症,同时促进了间充质干细胞的成骨分化[56]。有学者在啮齿动物颅骨缺损中植入载有阿奇霉素的PCL 膜,不仅赋予了屏障膜良好的抗感染能力,同时改善了骨愈合过程中的巨噬细胞表型转换,促进骨组织再生[57]。
3.2 具有良好“免疫降解”性能的屏障膜
延长膜耐用性的传统策略能够提高其抵抗理化溶解和酶溶解的能力,但也会引起更强烈的炎症反应及更高的感染风险。相反,操纵细胞介导的降解过程不仅能够改善屏障膜降解性能同时不会牺牲材料的生物相容性。因此,通过调控细胞介导的降解以达到一个最佳的平衡点可能是一个优化屏障膜降解性能的有效策略。
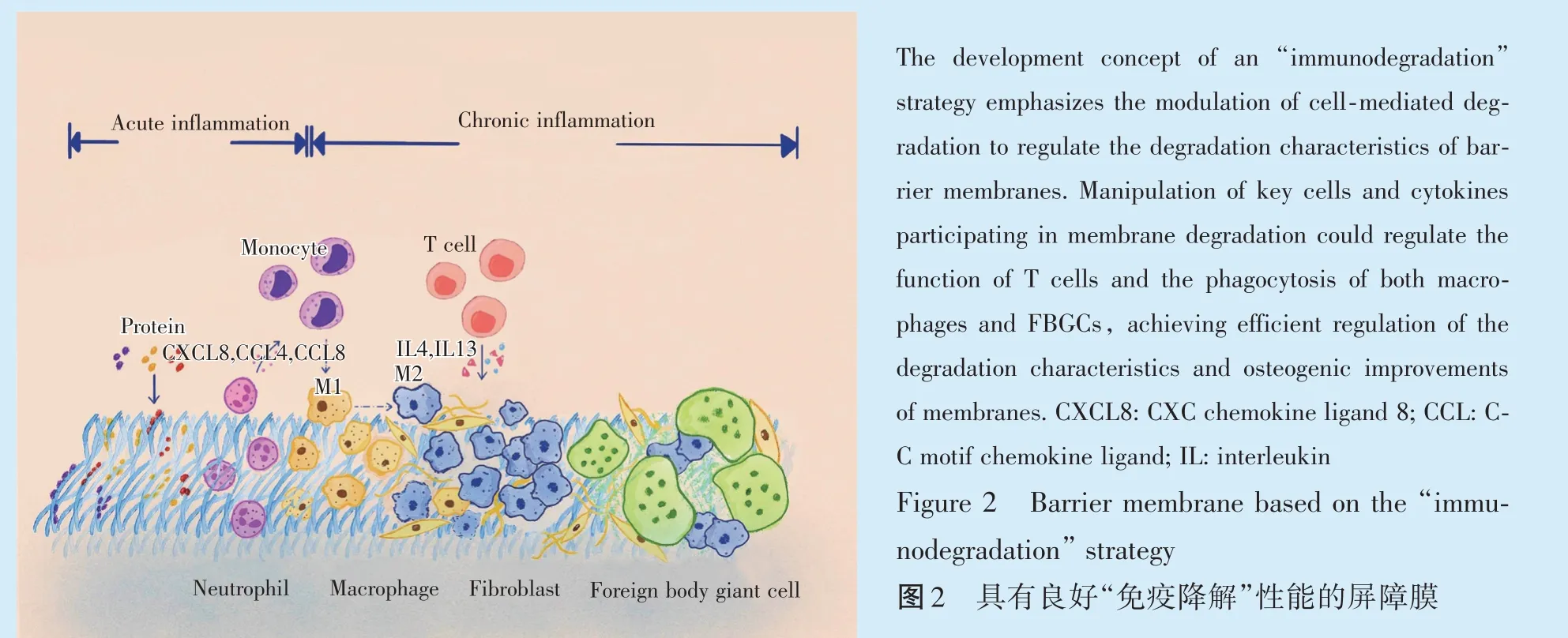
本课题组将胶原膜植入机体后,可以观察到大量巨噬细胞浸润,试图侵入植入的胶原基材料。但直到FBGC 出现,胶原膜才显示出分解的迹象。实验结果显示,巨噬细胞融合形成的异物巨细胞介导的降解在胶原膜降解过程中起到了关键作用[58],该现象也得到了相关研究结果的证实[59]。
胶原膜的植入会诱导T 淋巴细胞向Th2 分化,同时上调IL-13 的表达,诱导巨噬细胞在屏障膜植入处形成FBGC 区。本课题组通过中和巨噬细胞融合诱导剂IL-13,抑制了FBGC 的形成,同时有效延缓了胶原膜的降解。这证实了通过“免疫降解”策略调节细胞介导的降解,可有效延缓胶原膜降解速度,从而大大延长胶原膜的屏障功能。此外,操纵其他潜在的巨噬细胞融合诱导剂,例如IL-4和瞬时受体电位香草酸受体4(transient receptor po-tential cation channel subfamily V member 4,TRPV4),以及其他参与屏障膜降解的中性粒细胞、T 细胞等免疫细胞也可能是开发具有优异降解性能屏障膜的可行策略[60-61](图2)。
有研究通过天然的核糖交联剂作为化学交联的替代方法,制备了具有稳定致密结构的胶原膜,能够抑制免疫细胞的浸润,实现屏障膜降解时间的延长[62]。改变屏障膜的孔径、表面形貌等会导致局部微环境改变[63],由于巨噬细胞具有高可重塑性,能够根据微环境的变化而动态变化,因此笔者推测,通过改变屏障膜理化性能实现对局部免疫微环境的调控可以对巨噬细胞的吞噬和融合功能产生影响,进而实现对细胞介导的屏障膜降解的调控。然而,目前国内外学者针对“免疫降解”策略进行的屏障膜相关研究较少。
4 小结及展望
目前,牙槽骨缺损是口腔中常见的临床问题,具有发病率高、危害大的特点。研发具有良好成骨效能的屏障膜,促进引导骨再生治疗效果具有重要的科学及转化医学意义。传统屏障膜的研发策略集中关注其物理屏障功能、降解性能及如何限制免疫不良反应。然而,屏障膜不仅能够被动地阻挡结缔组织,还能够调控巨噬细胞极化并介导促炎和抑炎微环境的平衡。因此,针对屏障膜的研发更应关注其与多系统、多细胞相互作用后免疫微环境的改变。这一转变,对屏障膜的研发提出了更高要求,需要其满足临床迫切需求的同时有利于调控骨再生及自身降解性能的局部免疫微环境。
通过离子掺入,化学交联及复合材料等方式能够改变屏障膜的机械性能及理化性能,实现对屏障膜植入微环境中免疫细胞尤其是巨噬细胞的调控,进而改变局部免疫微环境影响骨再生及屏障膜降解进程。要实现有利于骨再生及屏障膜降解的局部免疫微环境构建,需要深刻了解屏障膜机械性能及理化性能的改变对免疫细胞的作用。然而,生物材料理化表面及机械性能对免疫细胞的调控机制尚未彻底明晰,屏障膜的降解过程亦未完全探明。此外,研究者必须认识到人类的基因背景与鼠或其他哺乳类动物存在明显差异,因此在不同物种之间对生物材料的骨免疫特性进行研究时,应该注意到免疫学标志物在人-鼠等不同物种间的差异,这也是部分研究无法重复,难以实现有效临床转化的重要原因。基于此,为开发新一代具有良好“免疫微环境调控”性能的屏障膜,未来研究需要从“免疫微环境”角度着手,揭示屏障膜理化机械及表面性能对免疫细胞的调控机制及屏障膜降解过程,以提高GBR 中屏障膜成骨效能,满足临床骨缺损再生修复需求。
【Author contributions】 Chen ZT,Lin YX,Yang JT wrote the arti-cle. Chen ZT,Huang BX,Chen ZF revised the article. All authors read and approved the final manuscript as submitted.

