DNMT3L基因多态性与子宫内膜异位症合并不孕关系
张 统 李海萍 张 琪 刘 蓉 任晓丽
1.青海省西宁市第一人民医院(810000); 2.青海大学附属医院;3.陕西省西安高新医院
子宫内膜异位症影响10%的育龄期妇女,在不孕症妇女中的患病率可达30%~40%[1]。近年来,越来越多的证据表明子宫内膜异位症是一种表观遗传疾病[2]。基因转录的表观遗传调控主要包括DNA甲基化和组蛋白修饰,是独立于DNA序列改变的一种遗传调控模式[3]。以往研究表明,DNA甲基转移酶DNMT1、DNMT3A和DNMT3B在子宫内膜异位症患者中表达异常[4]。此外,人类DNMT3家族中的另一个成员,类DNMT3(DNMT3L),不具有甲基转移酶活性,但可与DNMT3A和DNMT3B协同发挥作用[5]。既往报道发现DNMT 3L的rs113593938位点变异对亚端粒低甲基化有重要贡献,而DNMT3L的rs8129776位点基因变异与子宫内膜瘤的发生有关[6]。因此,本研究探索DNMT3L基因多态性与子宫内膜异位症合并不孕的相关性。
1 对象与方法
1.1 研究对象
选取2016年6月—2018年11月在本院确诊的子宫内膜异位症合并不孕症患者137例作为病例组,选择同期本院体检健康妇女137例作为对照组。病例组对象纳入标准为规律月经、生殖系统无解剖异常和至少有1年的不孕史,且不孕被证实为非男方因素所致。对照组为育龄期妇女,纳入标准为无任何恶性疾病、子宫内膜异位症或子宫腺肌病、规律月经史,以及生殖系统无解剖异常。子宫内膜异位症的分期[7]:Ⅰ期(最低)1~5分,Ⅱ期(轻度)6~15分,Ⅲ期(中度)16~40分,Ⅳ期(严重)>40分。本研究经本院伦理委员会批准,所有研究对象在参加本研究前均签署知情同意书。
1.2 DNMT3L检测
于晨7时抽取研究对象空腹外周静脉血,采用盐提取法从分离基因组DNA。采用Lightcycler 480系统(罗氏诊断公司,德国)和5x热Firehol Evagreen HRM混合物(Solis Biodyne,Tartu,爱沙尼亚)通过高分辨率熔化(HRM)曲线分析,对4个DNMT3L单核苷酸多态性 c.910-635 A/G(rs8129776), c.832C/T(rs7354779), c.812C/T(rs113593938)和c.344+62C/T(rs2276248) 进行基因分型。随后行PCR:在95℃下启动15min的初始步骤,以激活热FirePol DNA聚合酶,95℃下50次变性扩增循环10 s,在60.6℃下进行引物依赖性退火10 s,在72℃下延伸15s。然后将扩增的DNA片段以0.1℃的增量在76~97℃的温度范围内进行高分辨熔融曲线(HRM)。引物序列如表1所示。通过对随机抽取的10%样本重复测量评价基因分型的质量。

表1 DNMT3L多态性变异基因分型的高分辨熔融曲线引物序列
1.3 统计学方法
采用直接基因计数法计算基因型和等位基因频率,使用Pearson拟合优度卡方统计量评估Hardy-Weinberg(HWE)平衡的符合程度。使用Fisher's检验评估病例组和对照组等位基因和基因型频率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
年龄病例组[(33.2±5.3)岁]与对照组[(33.7±4.6)岁]无差异(P>0.05)。病例组不孕时间(2.7±0.8)年,子宫内膜异位症分期 Ⅰ期76例、Ⅱ期61例。
2.2 DNMT3L基因型分布
两组基因型频率无差异(P>0.05),rs8129776和rs7354779基因多态性无差异(P>0.05),而rs113593938和rs2276248基因多态性有差异(P<0.05)。见表2。在rs8129776多态性的显性和隐性遗传模型中,病例组相较于对照组的OR(95%CI)分别为1.07(0.57~1.72)和1.13(0.57~2.24)。在rs7354779多态性的显性和隐性遗传模型中,病例组相较于对照组的OR(95%CI)分别为0.72(0.45~1.17)和1.30(0.57~2.98)。 在rs113593938多态性的显性和隐性遗传模型中,病例组相较于对照组的OR(95%CI)分别为0.37(0.18~0.79)和2.69(1.23~5.88)。在rs2276248多态性的显性和隐性遗传模型中,病例组相较于对照组的OR(95%CI)分别为2.44(1.18~5.06)和0.34(0.15~0.81)。
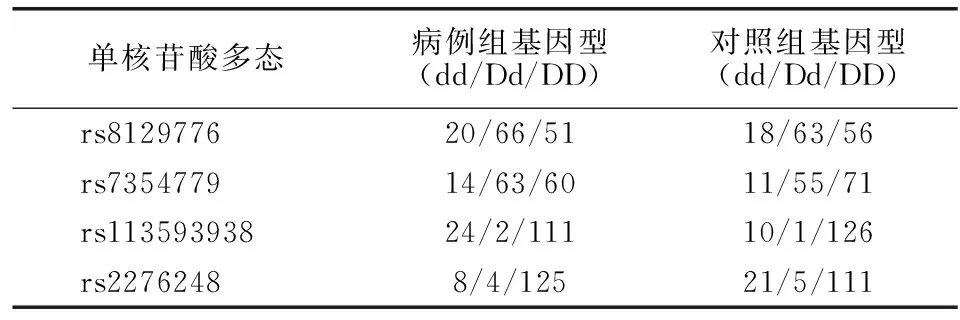
表2 两组DNMT 3L基因多态性情况
3 讨论
子宫内膜异位症是一种雌激素依赖型炎症性疾病,与表观遗传改变密切相关[8-9]。在子宫内膜异位症患者中,已有部分基因被发现具有异常的甲基化和表达模式。研究发现,E-cadherin基因低甲基化会导致子宫内膜异位症细胞雌激素活性和侵袭性增强,这一过程可能与类固醇生成因子1(SF-1)、芳香化酶和雌激素受体2表达水平变化有关[10-12]。另一方面,子宫内膜异位症患者的不孕也可能与HOXA10、HOXA11及孕酮受体(PR-B)基因的高甲基化有关[12-13]。在机体内,DNA甲基化主要由DNA甲基转移酶介导[7],这些酶包括DNMT1、DNMT3A、DNMT3B、DNMT3L等。近年研究发现,DNMT3L是DNMT3A和DNMT3B发挥甲基化作用的重要协同酶,DNMT3L的rs8129776位点可能与子宫内膜癌的发生有关[14]。
本研究通过对比子宫内膜异位症合并不孕症患者与健康妇女对照组,发现DNMT3L的rs8129776和rs7354779位点基因多态性与子宫内膜异位症合并不孕无明显关联,而其rs113593938和rs2276248位点的基因多态性与子宫内膜异位症合并不孕有关。但既往在白种人和日本人中进行的两项全基因组关联研究(GWAS)却未发现DNMT3L单核苷酸多态性与子宫内膜异位症相关不孕之间存在显著相关性[15-16]。这些结果的差异性可能解释为不同人种DNMT3L基因的表达与功能存在一定差异。
DNMT3L基因的单核苷酸多态性与子宫内膜异位症合并不孕发生的相关机制仍不清楚。据推测,与亚端粒低甲基化有关的DNMT3L c.812C/T(rs113593938)转换可导致DNMT3L蛋白271位谷氨酰胺取代精氨酸残基,从而影响DNMT3A的激活。亦有研究发现,DNMT3L是细胞表观遗传重编程过程中DNA从头甲基化所涉及的必需分子之一[17]。DNMT3L与DNMT3A或DNMT3B相互作用以实现从头DNA甲基化。DNMT3L还可以与具有能够调节DNMT3A作用的特异性组蛋白修饰的选择性染色质区域结合[18]。DNMT3L与组蛋白去乙酰化酶1结合的能力进一步表明,DNMT3L在染色质水平调控转录抑制方面具有积极作用。更为重要的是,DNMT3L与组蛋白去乙酰化酶1结合导致的组蛋白高度乙酰化可能是子宫内膜病变中G蛋白偶联雌激素受体1,SF-1和缺氧诱导因子1α过度表达的原因[19]。
综上所述,本研究发现DNMT3L的rs8129776和rs7354779位点的基因多态性与子宫内膜异位症合并不孕无显著相关性,而rs113593938位点的隐性基因模型和rs2276248位点的显性基因模型可能与子宫内膜异位症合并不孕有关。

