糖尿病合并肝脓肿患者HbA1C水平与超声引导穿刺干预效果的关系
张玮 葛辉 孙医学
糖尿病患者是肝脓肿的高危群体[1]。糖尿病合并肝脓肿多以细菌性肝脓肿为主,其中又以肺炎克雷伯菌感染较为常见,有报道发现糖尿病合并肺炎克雷伯菌肝脓肿的病死率可达25%[2]。超声引导下经皮穿刺置管引流术是糖尿病合并肝脓肿的主要治疗方式。但术后仍存在并发症风险,且疗效也存在个体化差异。既往报道证实糖化血红蛋白(HbA1C)控制效果良好有助于延缓糖尿病病情进展[3-4]。本研究分析HbA1C控制效果与糖尿病合并肝脓肿患者恢复时间的关系。
资料与方法
一、临床资料
2018年1月至2019年12月蚌埠市第三人民医院收治的56例糖尿病合并肝脓肿患者。糖尿病诊断参照中华医学会糖尿病学分会标准[5],肝脓肿均经穿刺和手术证实。将56例患者分为控制良好组(HbA1C<7%)、控制一般组(7%≤HbA1c≤9%)及控制差组(HbA1c>9%)[6]。排除标准:合并阿米巴肝脓肿、真菌性肝脓肿及肝结核。
二、超声引导下经皮穿刺置管引流术
所有患者行肝区常规二维超声扫描,明确脓肿部位后,在超声引导下,采用20G肝脏穿刺针,以Seldinger法穿刺置管,进行引流,清洁脓腔,外接引流袋。待引流量<15 mL/d、体温正常、脓腔<2 cm后拔管。
三、疗效评价[7]
临床恢复:白细胞计数、中心粒细胞及淋巴细胞水平等恢复正常,临床症状消失,引流管无脓液流出,脓腔缩小。有效:临床症状显著改善,白细胞计数等炎性因子恢复正常。无效:未达到临床恢复或有效标准,甚至发生肝脓肿感染、复发或死亡者。记录临床恢复时间和总有效率。
四、统计学方法
结 果
一、3组患者临床恢复时间
除控制差组1例在术后20 d复发外,其余患者均获得临床恢复,临床恢复时间为(19.3±13.2)d,总有效率为98.2%。控制良好组临床恢复时间为(13.2±6.9)d,控制一般组为(18.7±7.4)d,控制差组为(22.0±9.3)d。控制良好组恢复时间显著短于控制差组(t=3.282,P=0.002)。HbA1C与临床恢复时间呈显著负相关性(r=-0.519,P<0.01)。
二、3组患者临床疗效比较
不同HbA1C控制效果患者术后1周和术后2周时疗效差异均有统计学意义(P<0.05),见表1。控制良好组术后1周和术后2周时总体疗效显著优于控制一般组(χ2=7.516,6.405;P=0.023,0.041)和控制差组(χ2=9.120,9.570;P=0.010,0.008)。3组患者超声结果见图1。
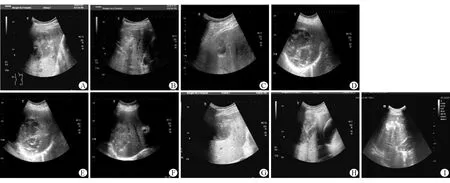
注:控制良好组(A、B、C)、控制一般组(D、E、F)及控制差组(G、H、I)治疗前、治疗期间及治疗后超声表现
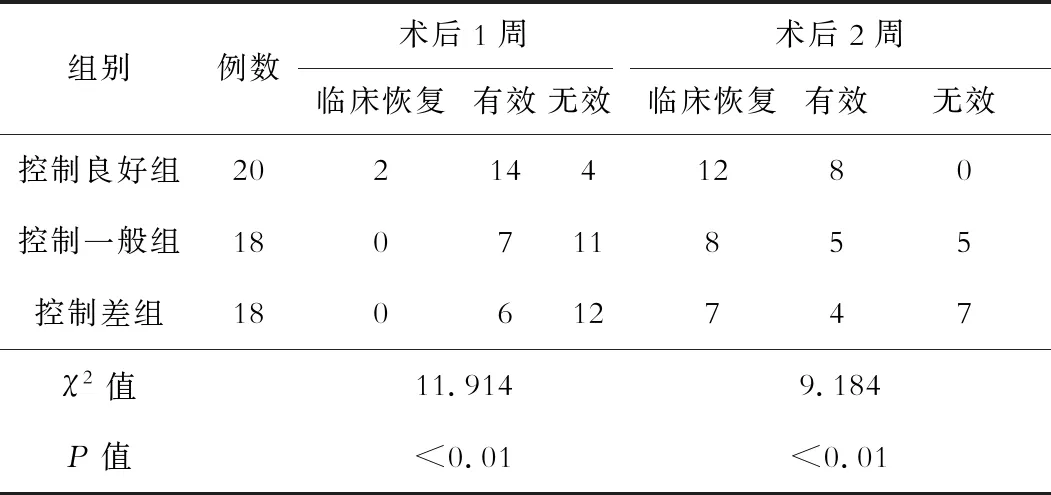
表1 3组患者术后1周和术后2周临床疗效比较(例)
三、3组患者并发症比较
HbA1C控制良好组腹水、胸腔积液、腹腔积液及急性肾衰竭发生例数均显著低于控制差组,差异均有统计学意义(P<0.05),见表2。
四、HbA1C影响因素分析
3组患者的临床资料和实验室指标比较见表3,4。Logistic多因素回归分析显示肾功能不全、空腹血糖(FPG)、餐后2 h血糖(2 h PG)、尿微量蛋白(mAlb)及血尿酸(SUA)是影响HbA1C水平的独立因素(P<0.05),见表5。
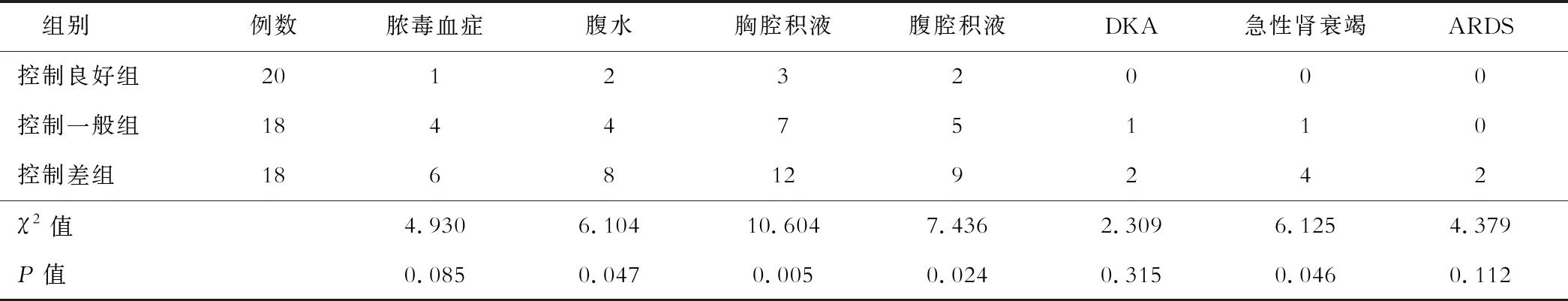
表2 3组患者并发症指标比较(例)
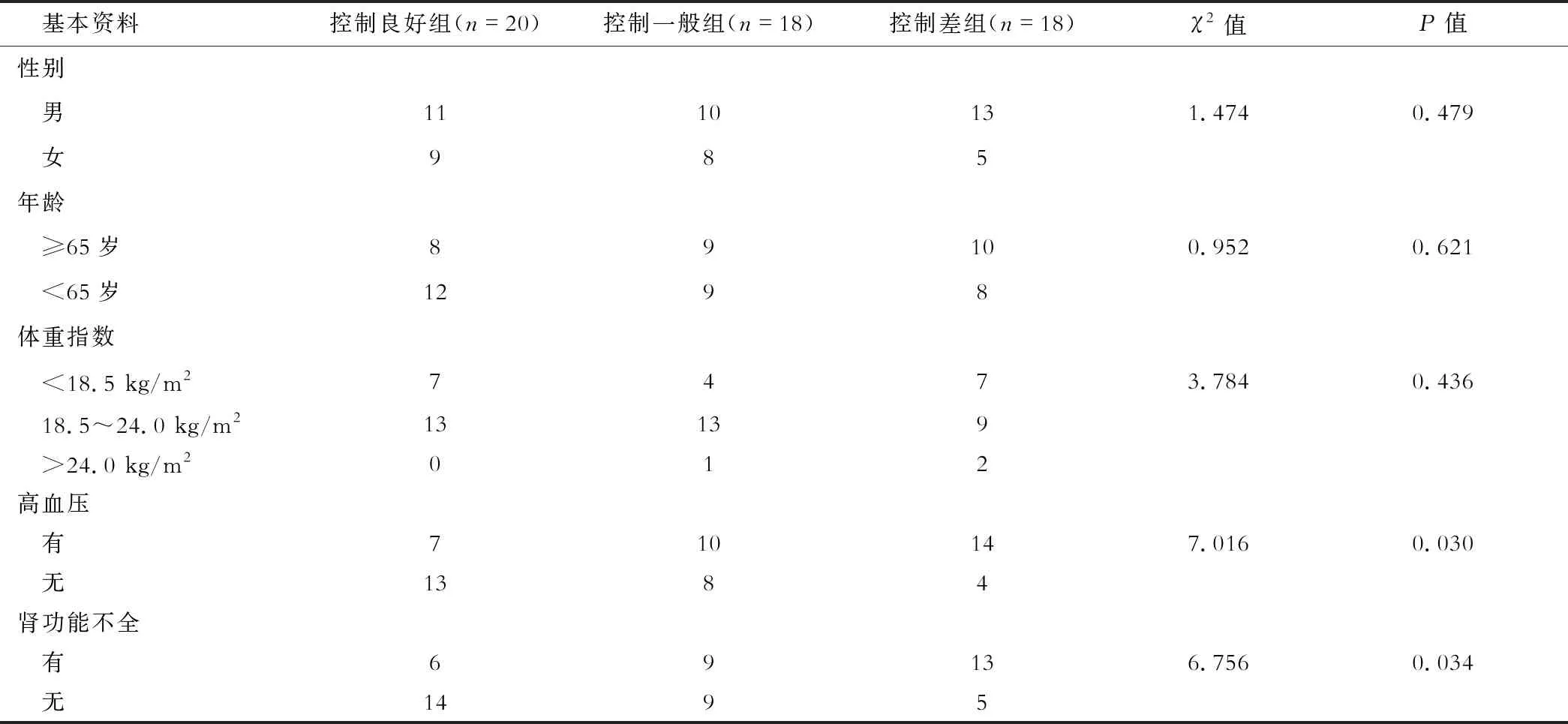
表3 3组基本资料比较(例)
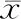
表4 3组实验室检查指标比较(±s)
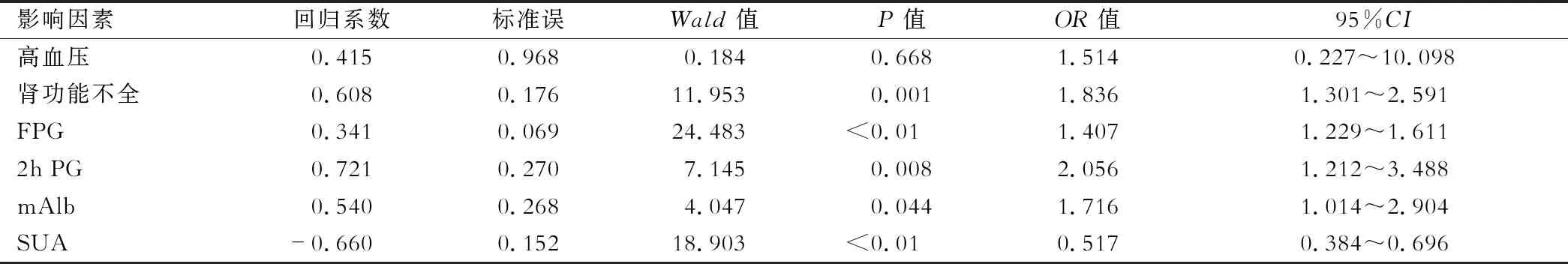
表5 HbA1C控制效果的影响因素分析
讨 论
糖尿病患者蛋白质分解代谢加快,T淋巴细胞数锐减,更易发生感染,增加菌群入侵肝脏的机率[8]。超声引导下经皮穿刺置管引流术是糖尿病合并肝脓肿的首选治疗方法[9]。本研究也显示该术式总有效率达98.2%,与既往报道相近[10]。
HbA1C被共识推荐为评估血糖控制效果的标准指标之一[11]。HbA1C控制效果越差,患者免疫功能受损越严重,使肠道致病菌定植增加,并经血行途径移位,最终导致肝脓肿。另外,糖尿病患者多发生血管神经病变,使血流缓慢,这也为致病菌定植、繁衍及反复感染创造了条件,同时也增加肝脏感染的风险[12]。本研究显示HbA1C控制良好组疗效最为显著,提示HbA1C可能是糖尿病合并肝脓肿患者穿刺置管引流效果的影响因素。因而,监测HbA1C有助于预测疗效,临床通过针对性干预,控制HbA1C水平,对患者的早期康复具有重要意义。
保护肾功能与纠正SUA水平也有助于改善HbA1C控制效果。微血管在糖尿病进展早期即受累,逐渐表现为血管内皮细胞损伤和肾小球毛细血管增生,最终导致肾小球功能障碍甚至完全丧失[13]。另外,SUA与HbA1C异常均与代谢异常聚集有关。Baena等[14]认为SUA与胰岛素抵抗呈正相关性,本研究显示SUA水平是HbA1C独立保护因素,与李小娥等[15]报道相符,但与上述结论相左,其机制尚不明确,有待深入研究。但这一现象值得注意对于糖尿病合并肝脓肿患者,应同时关注HbA1c和SUA水平。
综上,HbA1C控制效果与超声引导下经皮穿刺置管引流术效果密切相关,HbA1C受血糖水平、肾功能及SUA水平影响,临床应引起重视。

