Gd-EOB-DTPA增强MRI联合残余肝脏体积测定在肝切除术前储备功能评估中的价值
贠桂侠 陆松 孟春
虽然近年来原发性肝癌在我国的发病率呈明显的下降趋势,仍然是最常见的恶性肿瘤之一。根治性肝脏部分切除手术目前仍然是原发性肝癌的最主要治愈手段之一[1-2]。然而我国肝癌(liver cancer)大多由乙肝性肝硬化或血吸虫性肝硬化发展而来,合并有肝硬化及纤维化的病理基础,肝脏储备功能明显下降[3-4]。因而术后肝功能衰竭已经成为制约计划手术实施的最主要因素,术前的肝脏储备功能评估的准确性已成为影响预后的关键。钆塞酸二钠(Gd-EOB-DTPA)是一种胆道系统磁共振显像剂,入血后仅通过门脉系统吸收排泄,且无明显的胆肠循环,故在一定程度上可以反映肝细胞的摄取能力,临床上一般应用于肝胆系统的磁共振检查[5-6]。本研究采用残余肝脏体积测定联合增强MRI对肝癌患者部分肝切除术前的肝脏储备进行评估,取得较为满意的临床效果。
资料与方法
一、入组患者的选择
纳入标准为2016年7月至2019年12月安徽省第二人民医院收治拟行手术治疗的肝癌患者。排除标准:①既往肝切除病史;②既往经动脉灌注化疗(TACE)病史;③合并巨大海绵状血管瘤(>10 cm);④合并胆道梗阻;⑤术前手术切除范围与术中实际情况差异较大。本研究通过我院伦理委员会评审,本研究中所有患者在入组前均充分告知相关风险及可能受益,并签署知情同意书。
二、增强MRI信号强度(signal intensity, SI)测定
采用Gd-EOB-DTPA增强MRI(德国西门子公司,3.0T,MagnetomVerio)进行扫描,范围由心包下缘至髂血管起始部,部位预扫描后,由静脉泵以2 mL/s给予0.025 mmol/kg Gd-EOB-DTPA。增强延迟扫描时间:动脉期20 s,门脉期40 s,平衡期100 s。之后行快速自旋回波 T2 加权成像扫描,并行延迟时间10 min。在工作站中将受试患者的肝脏各段中(Couinaud 分段法)避开肿瘤及胆管后,分别测量增强前(增强前SI)及增强10 min后(增强后SI)的肝脏信号强度,并分别取均值。患者的Gd-EOB-DTPA肝脏实际摄取信号强度(TSI)=增强后SI-增强前SI(图1)。
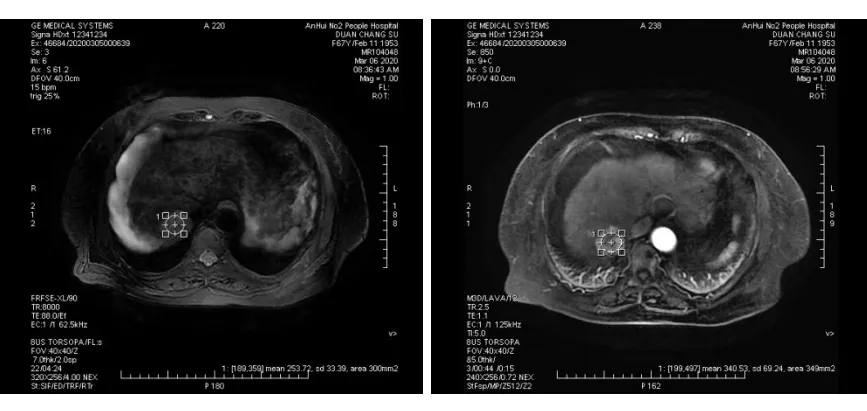
图1 Gd-EOB-DTPA增强MRI信号强度测定
三、模拟肝切除残余肝脏体积率的测定
全肝脏体积(total liver volume, TLV)的计算采用体表面积法:TLV = 706.2× 体表面积 +2.4。肝脏肿瘤(tumor volume, TV)的计算采用实体肿瘤体积计算法:TV=长径×短径2×0.52。本研究患者在完成术前检查后均由同一多学科治疗团队(MDT)评估设计手术切除范围,由一名外科医生及一名影像科医生在工作站中根据手术方案进行断层模拟肝切除进行手术边缘勾画(图2),再通过三维重建工作站每个断层上的勾画的残余肝脏,最后计算残余肝脏体积(Remnant liver volume, RLV)。RLV率(RLVR,RLV rate)=RLV/(TLV-TV)。
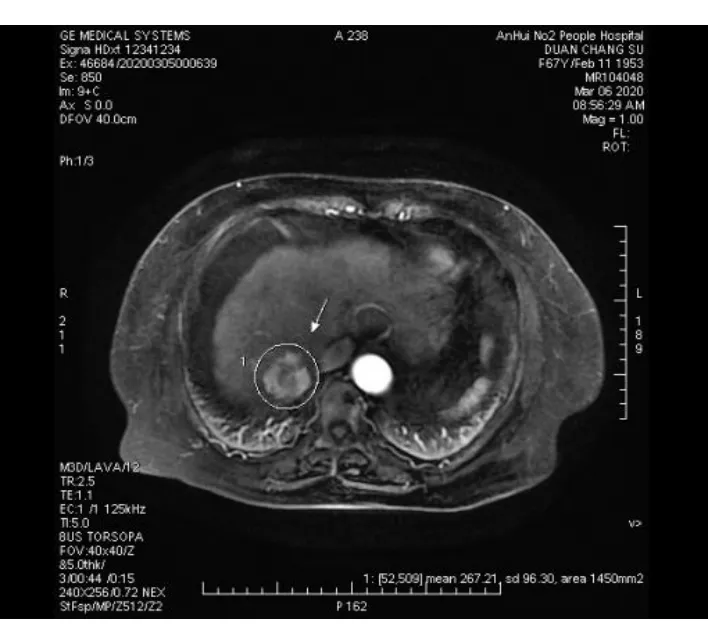
图2 断层叠加法进行残余肝脏体积测定
四、围手术期血液学检查及术后肝功能不全的定义
本组患者术前的常规检查包括:心电图,胸片/胸部CT及血液检查。血液学检查项目及时间点:术前7 d内以及术后第1、3、7天进行血常规、血生化、凝血功能检查。术后肝功能不全的诊断采用《肝硬化患者肝切除术后肝功能不全的预防与治疗专家共识(2019版)》标准:肝切除患者术后第5天TBil > 50 mmol/L和(或)凝血酶原活动度<50%。
五、手术治疗
本研究纳入患者的手术由同一组手术医师实施,采用传统开腹手术或腹腔镜方式进行,术中肝脏切除范围严格按照MDT评估设计手术切除范围进行。若手术中创面出血严重,则采用肝门阻断控制肝脏断面出血。未进行肝门阻断或采用选择性入肝血流阻断的患者阻断时间计为0。
六、统计学分析
本研究采用SPSS 19.0统计学软件进行分析,计量资料采用t检验进行组间比较,计数资料采用χ2检验进行组间比较,术后肝功能不全的危险因素单因素分析P<0.05时纳入Logistic多因素回归分析,多因素回归分析P<0.05时被视为最终危险因素。
结 果
一、患者的一般临床资料
本项研究一共纳入了415例患者,女118例,男297例,年龄35~79岁,平均年龄59.9岁;根据术前Child-Pugh分级评分,A级346例,B级51例,C级18例;根据手术方式,开放手术330例,腹腔镜下肝切除85例;根据术中切除范围,三叶切除55例,半肝切除196例,肝段切除87例,不规则切除77例。
二、肝切除术后短期肝功能不全的发生及预后
本组患者术后平均住院时间7.9 d(6~45 d)。415例患者中56例患者发生了术后肝功能不全,发生率为13.5%,主要表现为术后的高胆红素血症、顽固性腹水及凝血功能异常。其中1例患者在术后第16天进展为肝脏功能衰竭,并在术后第21天死亡,死亡原因为MODS。其余55例术后发生肝功能不全的患者经静脉营养支持、白蛋白输注、护肝等治疗后治愈。
三、术后肝功能不全的单因素分析
术后肝功能良好组359例和术后肝功能不全组56例,两组患者在性别、年龄、体质指数(BMI)、术前血红蛋白、血清白蛋白、AST、ALT、TBil、PT-INR、Child-Pugh分级、肿瘤大小、手术时间、是否微创手术等方面两者无明显统计学差异。术后肝功能不全组患者的术前血小板水平(P=0.036)及RLVR × TIS(P=0.012)明显低于良好组。肝功能不全组患者的肝门阻断时间(P=0.049)及肝切除术中出血量(P=0.032)与肝功能良好组存在统计学差异,详见表1。
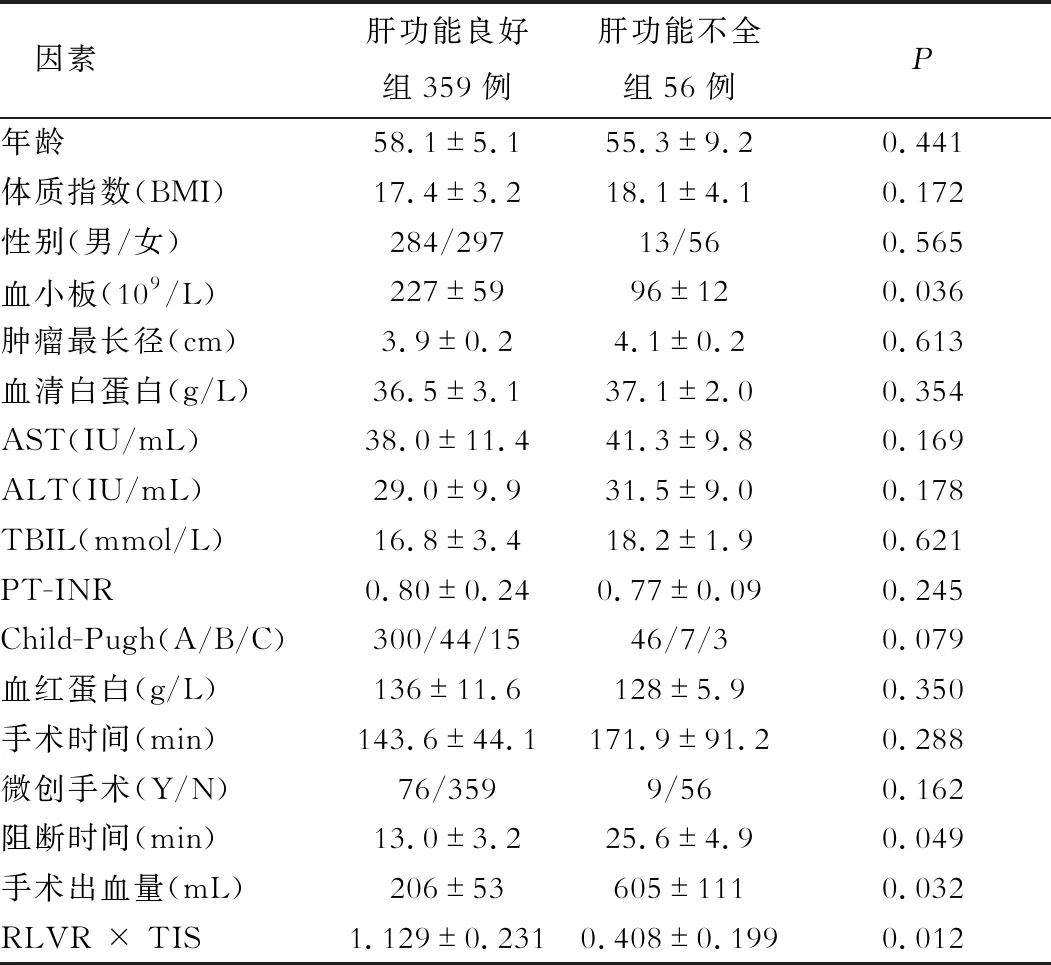
表1 术后肝功能不全的单因素分析
四、术后肝功能不全危险因素的多元线性回归分析
将血小板水平、肝门阻断时间、术中出血量及RLVR × TIS纳入Logistic多因素回归模型中分析,结果发现RLVR × TIS是术后发生肝功能不全的独立危险因素(P= 0.031)。
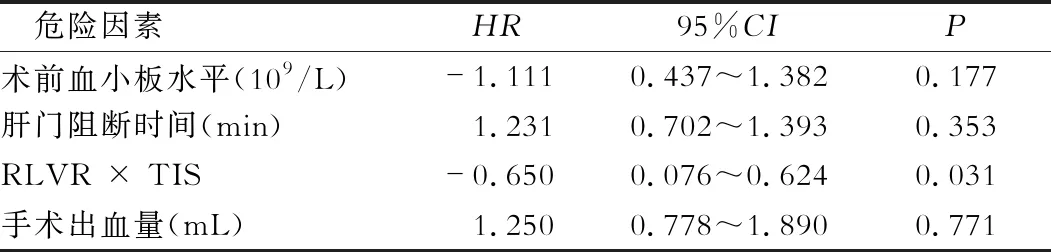
表2 术后肝功能不全危险因素的多元线性回归(Logistic)分析
讨 论
近年来肝脏外科手术相关并发症及手术死亡率呈明显下降趋势,对于有经验的肝脏外科中心,围手术期腹腔内出血、严重胆瘘及脏器副损伤等手术相关并发症的发生已较少见,而术后肝功能不全甚至肝功能衰竭的发生已经成为影响手术治疗疗效最主要因素之一[7-8]。因而,精确的个体化的术前肝脏储备功能评估已经成为影响手术成败的关键。
肝脏储备功能目前认为主要由肝细胞功能和肝细胞数量两个主要因素决定。由于评估的复杂性,目前尚无单一评估指标或金标准。目前临床常用Child-Pugh评分、吲哚菁绿、口服糖耐量、利多卡因排泄试验,残余肝脏体积测定等单个指标进行评估[9-11]。但是上述方法均是对肝脏整体状态的笼统评估,包括手术中正常肝脏组织的损失、不同部位肝细胞功能密度差异等因素均能够对术前肝脏储备功能评估产生较大影响。因此目前肝切除患者缺乏一种可靠性,精准个体化以及可高度重复的肝脏储备功能评估方法。
Gd-EOB-DTPA被注射入血后能够迅速被正常肝细胞有机阴离子转运多肽摄取,几乎不存在肝肠循环,而摄取功能受损的肝细胞对其摄取率明显下降。因此Gd-EOB-DTPA增强MRI的肝脏TSI可以反映相关区域肝细胞功能[12-15],近年来相关研究发现肝脏摄取的Gd-EOB-DTPA信号强度可以准确地评估术前肝脏储备功能。
残余肝脏体积则是肝切除术后肝脏残余功能的另一个敏感指标,其主要由全肝体积、肿瘤体积以及手术正常肝组织切除量决定,它反映的是肝脏在接受手术切除后剩余的功能肝细胞数量。在本研究中,笔者通过模拟肝切除的方式,通过MRI测算残余肝体积,并将肝细胞功能及残余肝体积进行关联(RLVR × TIS),在对患者术后肝功能不全的Logistic多因素危险分析发现:RLVR × TIS是本研究中肝切除术后发生肝功能不全的唯一危险因素,因此我们认为RLVR × TIS可以用于术前肝脏储备功能评估的有效手段及敏感指标。
综上所述,本研究通过对肝癌肝切除患者进行Gd-EOB-DTPA增强MRI联合残余肝脏体积测定进行术前肝脏储备评估的研究证实:联合TSI及RLVR可以对患者术后残余肝脏功能进行较为有效的评估,是一种较为可靠的肝脏储备功能评估手段。

