苯丁酸氮芥协同四价铂药物的合成与抗癌活性研究
屠思嘉,李泽宁,吕 鹤,陈 超
(湖州师范学院 生命科学学院,浙江 湖州 313000)
0 引 言
在癌症治疗中,铂类药物一直扮演着重要角色[1-2].其中,顺铂被用于一半以上的癌症化疗,是化疗效果最好的抗癌药物之一[3].然而,顺铂极大的毒副作用以及肿瘤细胞对其产生的难以克服的耐药性,严重限制了其在临床上的进一步使用[4].因此,不断有其他铂类药物被研究和开发.目前在临床上已被应用的有卡铂和奥沙利铂.但卡铂治疗癌症的类型与顺铂类似,对顺铂耐药的癌细胞同样会对卡铂耐药,并且卡铂还具有严重的骨髓抑制作用[5].虽然奥沙利铂治疗癌症的类型与顺铂不同,而且与顺铂没有交叉耐药性,但奥沙利铂具有较严重的神经毒性[6].
四价铂是二价铂的氧化态化合物,在细胞内被抗坏血酸、谷胱甘肽等还原性分子还原为二价铂化合物,从而发挥抗癌作用[7].作为二价铂药物的前药,四价铂除保留了二价铂药物广谱高效的抗癌活性外,还具有以下优势:四价铂具有六配体稳定结构,血液稳定性高于二价铂;四价铂比二价铂多两个配体,可方便地引入不同官能团,从而可以共价连接其他药物;四价铂具有不同于二价铂类药物的作用机制,可以克服肿瘤细胞对传统铂类药物产生的耐药性[8].本文将传统的化疗药物苯丁酸氮芥通过缩合反应引入到四价铂轴向羟基上,通过两药联用,以期形成治疗效果更好的抗癌药物[9].苯丁酸氮芥是FDA认可的DNA烷基化剂,可用于治疗慢性淋巴白血病、淋巴癌,以及晚期卵巢癌和乳腺癌[10].并且苯丁酸氮芥和铂类药物都能通过攻击细胞中的DNA发挥抗肿瘤作用,两药联用可有效增强药物对DNA靶点的识别,从而提高药物的治疗效果.此外,苯丁酸氮芥与四价铂的结合物能有效调节药物的亲脂性,提高细胞对药物的摄取效率,减少细胞内外药物失活现象的出现.
1 实验材料与方法
1.1 实验试剂
顺二氯二氨基合铂(cis-Pt)、过氧化氢(H2O2)、苯丁酸氮芥(chlorambucil)、二环己基碳二亚胺(DCC).
1.2 二氯二羟基二氨合铂(IV)的合成
二氯二羟基二氨合铂(IV)的合成方法如图1(1)所示[11].将60 mL过氧化氢(30 wt%)逐渐滴加到含有顺铂(1.0 g,3.33 mmol)的圆底烧瓶中.滴加完毕将反应混合物加热至75 ℃搅拌5 h,然后在室温下避光反应过夜使产物结晶.过滤分离黄色固体粉末,用冷水洗涤,干燥,得到1 g产物,产率为90%.
1.3 二氯二苯丁酸氮芥二氨合铂(IV)(chlorambucil-Pt)的合成
二氯二苯丁酸氮芥二氨合铂(IV)的合成分两步进行,见图1(2).第一步,将苯丁酸氮芥缩合形成酸酐,并将苯丁酸氮芥(303 mg,1.0 mmol)溶于20 mL干燥的二氯甲烷溶剂中,加入缩合剂二环己基碳二亚胺(DCC)(153 mg,0.5 mmol),室温搅拌3 h,薄层色谱(TLC)跟踪反苯丁酸氮芥全部形成酸酐;第二步,过滤并除去二氯甲烷溶液,产物不分离,直接加入二氯二羟基二氨合铂(IV)(80 mg,0.25 mmol)、无水二甲基亚砜(dmso)10 mL,避光室温搅拌过夜.反应结束后减压除去dmso溶剂.最终将产物二氯二苯丁酸氮芥二氨合铂(IV)通过薄层色谱提纯分离,得到浅黄色粉末68 mg,产率为31%.

图1 二氯二苯丁酸氮芥二氨合铂(IV)的合成Fig.1 Synthesis of chlorambucil-Pt(IV)
2 结果与讨论
2.1 二氯二苯丁酸氮芥二氨合铂(IV)的质谱和核磁表征[12]
如图2所示,分子量905.091 9(1)处出现了二氯二苯丁酸氮芥二氨合铂(IV)的分子离子峰,这与理论值相符.在1H NMR图(图3(a))中,苯丁酸氮芥形成酸酐后与二氯二羟基二氨合铂(IV)的两个羟基酯化缩合,其中苯环上的芳氢以双峰的形式分别出现在7.07 ppm和6.62 ppm处,N-氯乙基上的氢核磁信号以多重峰的形式出现在3.72~3.61 ppm处,丁酸上的亚甲基信号峰分别出现在2.52 ppm、2.44 ppm和1.86 ppm处,没有发现羧酸氢的信号峰.与中心铂原子配位的氨基特征峰出现在5.46 ppm处.苯丁酸氮芥与氨基的个数比为1∶1,说明二氯二羟基二氨合铂(IV)上的两个羟基都与苯丁酸氮芥进行了缩合.在13C NMR图(图3(b))中共出现了10个特征信号峰,均为苯丁酸氮芥的碳信号峰.核磁数据为:1H NMR(400,MHz,CDCl3):δ7.07(d,J=8.4 Hz,4H);6.62(d,J=8.4 Hz,4H);5.44(b,6 h);3.68~3.72(m,8 H);3.65~3.61(m,8 H);2.52(t,J=7.2 Hz,2H;2.44(t,J=7.2 Hz,2H);1.86(m,2H).13C NMR(100 MHz,CDCl3):δ184.2;144.4;130.5;130.0;112.2;53.5;40.8;34.2;27.5;24.8.

图2 二氯二苯丁酸氮芥二氨合铂(IV)的质谱图Fig.2 The masss spectrum of chlorambucil-Pt (IV)
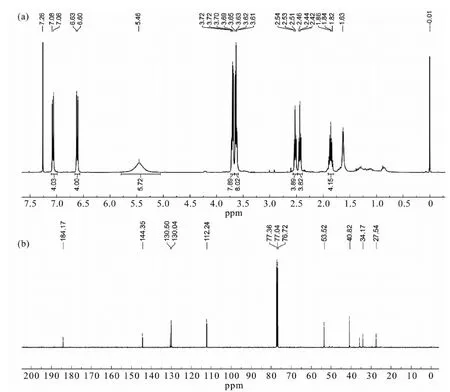
图3 二氯二苯丁酸氮芥二氨合铂(IV)的核磁共振谱图Fig.3 The 1H NMR and 13C NMR spectrum of chlorambucil-Pt(IV)
2.2 二氯二苯丁酸氮芥二氨合铂(IV)(chlorambucil-Pt)的抗癌活性
在确认和表征二氯二苯丁酸氮芥二氨合铂(IV)的结构后,首先通过MTT(噻唑蓝)比色法[13]来评估该化合物在肠癌细胞LoVo、胃癌细胞7901、非小细胞肺癌细胞A549和A549-R(耐顺铂细胞株)3种癌细胞中的细胞活性,并与临床使用的苯丁酸氮芥和顺铂药物进行对比.如图4和表1所示,与苯丁酸氮芥和顺铂相比,二氯二苯丁酸氮芥二氨合铂(IV)对人类癌细胞表现出较高的毒性.在LoVo、7901和A549细胞中,二氯二苯丁酸氮芥二氨合铂(IV)的IC50值(药物半抑制浓度)分别为0.53±0.03 μM、0.74±0.04 μM和1.59±0.12 μM,药效接近或超过顺铂10倍.在耐顺铂的肺癌A549-R细胞中,二氯二苯丁酸氮芥二氨合铂(IV)表现出更高的细胞活性,其IC50值为1.33±0.09 μM,只有顺铂IC50值(31.0±5.50 μM)的1/20.由此表明,二氯二苯丁酸氮芥二氨合铂(IV)不会与顺铂产生交叉耐药性,其能有效杀死耐顺铂的癌细胞,可用于治疗对顺铂产生耐药性的癌症.

图4 苯丁酸氮芥、顺铂和二氯二苯丁酸氮芥二氨合铂作用癌细胞48 h后的MTT曲线Fig.4 MTT assay of chlorambucil,cis-Pt, and chlorambucil-Pt against cancer cell lines after 48 h drug exposure

表1 苯丁酸氮芥、顺铂和二氯二苯丁酸氮芥二氨合铂作用癌细胞48 h后的IC50值
细胞的形态变化是细胞对细胞毒性试剂初步的反应指标[14].如图5所示,健康的LoVo细胞显示出梭形结构(图5(a)).用1.0 μM的二氯二苯丁酸氮芥二氨合铂(IV)处理LoVo细胞24 h后,部分细胞形态明显缩小为圆形并有浓缩的染色质出现,但是大部分细胞的形态依然正常(图5(b)).这可能是由于LoVo细胞在短时间内通过细胞保护机制克服了药物作用.但延长药物作用时间至48 h后,LoVo细胞形态发生了明显变化,大部分细胞已失去其质膜的完整性,并出现明显的核浓缩.由此表明,LoVo的细胞保护机制在二氯二苯丁酸氮芥二氨合铂(IV)的作用下已被完全破坏,并引起细胞死亡.

图5 二氯二苯丁酸氮芥二氨合铂(1.0 μM)作用LoVo细胞后的细胞形态变化Fig.5 Representative images of LoVo cells treated with chlorambucil-Pt (1.0 μM)
为进一步说明二氯二苯丁酸氮芥二氨合铂(IV)在癌细胞中的作用机制,在LoVo细胞中进行膜蛋白V-FITC/PI凋亡测定,并通过流式细胞仪进行分析[15].Annexin V-FITC是一种荧光标记的磷脂结合蛋白,可以与早期凋亡细胞外翻的磷脂酰丝氨酸结合.碘化丙啶(propidine iodide,PI)是一种核酸染料,不能渗透到正常细胞和早期凋亡细胞中,但可以渗透到晚期凋亡和坏死细胞中.用1.0 μM的二氯二苯丁酸氮芥二氨合铂(IV)分别处理LoVo细胞0 h、24 h和48 h后,早期凋亡细胞的总数分别为6.0%、54.0%和94.2%(图6),几乎没有观察到晚期凋亡和坏死细胞(PI阳性,坏死),其种群少于5.4%.由此表明,二氯二苯丁酸氮芥二氨合铂(IV)作用细胞后,主要通过凋亡方式诱导细胞死亡.

图6 二氯二苯丁酸氮芥二氨合铂(1.0 μM)作用LoVo细胞后的细胞凋亡分布情况Fig.6 Cell apoptosis in response to treatment with chlorambucil-Pt (1.0 μM)
细胞周期的停滞是细胞凋亡的一个主要原因.带负电荷的核酸(DNA)是铂类药物的主要靶点[16].用1 μM的顺铂和二氯二苯丁酸氮芥二氨合铂(IV)分别处理LoVo细胞24 h后,收集细胞并通过流式细胞仪进行分析,未处理的细胞显示出正常的周期分布百分比,G1期为42.98%、S为19.07%、G2/M期为37.94%(图7(a)).在顺铂的作用下,在G1期A2780细胞数增加至51.65%,在S期和G2/M期的A2780细胞数分别减少至16.59%和31.75%(图7(b)).在相同浓度的二氯二苯丁酸氮芥二氨合铂作用下,在G1期A2780细胞数增加至61.66%,在S期和G2/M期A2780细胞数分别减少至14.16%和24.18%(图7(c)).顺铂和二氯二苯丁酸氮芥二氨合铂(IV)在G1期都显示出明显的阻滞作用.G1期是DNA的预合成期,当细胞周期停滞在该阶段时,细胞的增殖被抑制,细胞周期从G1期转为S期和G2/M期的速度降低,最终诱导细胞膨胀和凋亡.
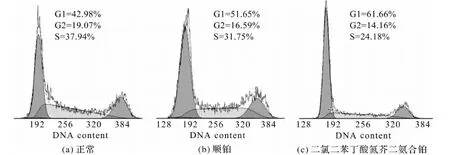
图7 药物(1.0 μM)孵育LoVo癌细胞24 h后细胞周期的分布情况Fig.7 Cell cycle distribution of LoVo cancer cells exposed to chlorambucil-Pt and cis-Pt (1.0 μM)
3 结 论
本文在二氯二羟基二氨合铂(IV)的轴向羟基基团上通过酯化反应引入药物苯丁酸氮芥,合成一种有前途的四价铂前药二氯二苯丁酸氮芥二氨合铂(IV),并通过核磁共振和质谱分析确认二氯二苯丁酸氮芥二氨合铂(IV)的结构.研究表明,在二氯二羟基二氨合铂(IV)轴向引入苯丁酸氮芥,能有效提高药物的抗肿瘤活性.在细胞周期实验中,二氯二苯丁酸氮芥二氨合铂(IV)表现出与顺铂相同的G1期阻滞作用,从而引起细胞凋亡.鉴于二氯二苯丁酸氮芥二氨合铂(IV)表现出的协同作用方式和较强的抗癌活性,该化合物可能会成为一种潜在的抗肿瘤药物,值得进一步研究.

