多肉植物抖抖玉露组培快繁技术研究
周陆平,孔雪迪,陈建中,田传玉,梁桂平,杨 帆
(湖州师范学院 生命科学学院,浙江 湖州 313000)
玉露(Haworthiacooperi)为百合科十二卷属多年生肉质草本植物[1].玉露植株玲珑小巧,叶片呈莲座状紧凑排列,叶色晶莹剔透,具有极高的养殖和观赏价值,深受广大园艺工作者和消费者的喜爱,具有良好的市场前景和极大的经济效益[1-2].玉露植株的传统繁殖方式多为分株繁殖,繁殖系数低、速度慢,不能满足日益增长的市场需求.因此,建立高效的玉露组培快繁体系具有重要的现实意义,也可为十二卷属植物的种质资源保存提供理论基础.虽然近年来已有一些玉露组培快繁方面的研究报道[2-8],但少见有文献报道抖抖玉露的组织培养和快速繁殖.已有研究[3]表明不同品种玉露的离体快繁方法差异较大.本文采用植物组织培养方法对抖抖玉露的快速繁殖进行研究,为建立抖抖玉露组培苗工厂化生产体系提供技术支撑,从而更好地满足市场对名贵多肉植物优良商品苗的需求.
1 实验材料与方法
1.1 实验材料
抖抖玉露无菌苗由湖州师范学院植物组织培养实验室提供.
1.2 实验方法
1.2.1 抖抖玉露无菌苗的增殖培养
将大小一致的抖抖玉露无菌芽接入如下增殖培养基中,P1: MS+6-BA 0.5 mg/L+NAA 0.1 mg/L;P2: B5+6-BA 0.2 mg/L+NAA 0.1 mg/L;P3: B5+6-BA 0.5 mg/L+NAA 0.1 mg/L;P4: B5+6-BA 1.0 mg/L+NAA 0.1 mg/L;P5: B5+6-BA 1.0 mg/L+NAA 0.2 mg/L;P6: B5+6-BA 2.0 mg/L+NAA 0.2 mg/L.接种后置于培养室培养,培养室温度为25 ℃,光照强度为2 500 lx,光暗周期比为12 h∶12 h.
1.2.2 抖抖玉露无菌芽的生根培养
将大小一致的抖抖玉露无菌芽接入如下生根培养基中,R1: 1/2MS+IBA 0.1 mg/L+NAA 0.1 mg/L;R2: 1/2MS+NAA 0.1 mg/L;R3: 1/2MS+NAA 0.2 mg/L;R4: 1/2MS+NAA 0.5 mg/L;R5: 1/2MS+IBA 0.2 mg/L;R6: 1/2B5+NAA 0.2 mg/L.接种后置于培养室培养,培养条件同抖抖玉露无菌苗的增殖培养.
增殖培养和生根培养的培养基所用的琼脂均为5 g/L、蔗糖为20 g/L、pH5.5.每项处理配制10瓶培养基,每瓶接种4个抖抖玉露无菌芽,重复3次.接种培养60 d后对抖抖玉露的芽鲜重、芽高、增殖系数,以及不定根的长度、鲜重和数量分别进行统计、测量.
1.3 数据分析
应用Excel 2007软件进行数据处理,利用SPSS 19.0软件对数据进行单因素方差分析.
2 结果与讨论
2.1 培养基配方对抖抖玉露芽鲜重的影响
如图1所示,以B5为基本培养基,NAA浓度为0.1 mg/L时,随着细胞分裂素6-BA浓度的增加(P2~P4培养基处理),抖抖玉露芽鲜重逐渐减小,经1.0 mg/L 6-BA处理(P4)的芽鲜重显著低于经0.2 mg/L 6-BA处理(P2)的芽鲜重(P<0.05).当6-BA浓度为1.0 mg/L时,提高生长素类物质(NAA)的浓度,即由P4处理的0.1 mg/L NAA提高到P5处理的0.2 mg/L后,芽鲜重显著增加.当NAA浓度为0.2 mg/L时,6-BA浓度由P5处理的1.0 mg/L提高到P6处理的2.0 mg/L,对芽鲜重无显著影响.不同的基本培养基MS(P1处理)和B5(P3处理)也未引起芽鲜重显著差异.
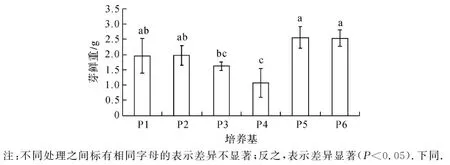
注:不同处理之间标有相同字母的表示差异不显著;反之,表示差异显著(P<0.05).下同.图1 培养基组成分对抖抖玉露芽鲜重的影响Fig.1 Effect of medium composition on fresh weight of Haworthia cooperi shoots
2.2 培养基配方对抖抖玉露芽高的影响
由图2可知,随着细胞分裂素类物质6-BA浓度的增加(P2~P4处理),抖抖玉露的芽高呈下降趋势,但无显著差异;经0.2 mg/L NAA处理(P5)的芽高显著高于经0.1 mg/L NAA处理(P4)的芽高;当NAA浓度为0.2 mg/L时,经2.0 mg/L 6-BA处理(P6)的芽高与经1.0 mg/L 6-BA处理(P5)的芽高没有显著差异.基本培养基MS(P1)与经B5(P3)处理的芽高无显著差异.
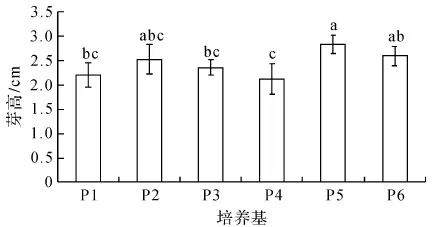
图2 培养基组成分对抖抖玉露芽高的影响Fig.2 Effect of medium composition on plantlet height of Haworthia cooperi shoots
2.3 培养基配方对抖抖玉露试管苗增殖的影响
图3表明,经1.0 mg/L 6-BA处理(P4)的增殖系数显著高于经0.2~0.5 mg/L 6-BA处理(P2和P3)的增殖系数;提高NAA浓度,即从P4处理的0.1 mg/L增加到P5处理的0.2 mg/L,组培苗的增殖系数显著降低;当NAA浓度为0.2 mg/L时,经2.0 mg/L 6-BA处理(P6)和经1.0 mg/L 6-BA处理(P5)的增殖系数无显著差异.经基本培养基MS处理(P1)的增殖系数显著高于经基本培养基B5处理(P3)的增殖系数.

图3 培养基组成分对抖抖玉露试管苗增殖系数的影响Fig.3 Effect of medium composition on proliferation coefficient of Haworthia cooperi shoots
综合分析图1至图3发现,在一定浓度范围内提高增殖培养基中细胞分裂素类物质6-BA的浓度,抖抖玉露组培苗的增殖系数得到提高,但组培苗的鲜重和高度下降;提高生长素类物质NAA浓度,有利于组培苗的生长,其鲜重和高度也显著增加,但其增殖系数显著降低.这些研究结果与其它的玉露品种[2-8]和植物种类[5,9-10]的组织培养研究结果基本一致.基本培养基MS比B5更有利于抖抖玉露组培苗的增殖,但两种基本培养基对组培苗的生长(鲜重和高度)无显著差异.
2.4 培养基配方对抖抖玉露试管苗生根的影响
由图4A可知,以基本培养基为1/2 MS时,经0.2 mg/L NAA处理(R3)的根鲜重显著低于经0.1 mg/L NAA处理(R2)和经0.5 mg/L NAA处理(R4)的根鲜重;经0.2 mg/L IBA处理(R5)的根鲜重与经0.2 mg/L NAA处理(R3)的根鲜重无显著差异;经0.1 mg/L IBA +0.1 mg/L NAA处理(R1)的根鲜重显著高于经0.2 mg/L NAA处理(R3)和经0.2 mg/L IBA处理(R5)的根鲜重.基本培养基1/2B5(R6)和1/2 MS(R3)对根鲜重的影响无显著差异.R5培养基中试管苗的生根率最高,R4培养基中试管苗的生根率最低.
如图4B所示,随着NAA浓度的增加(R2~R4处理),不定根根长逐渐减小,经0.2 mg/L NAA处理(R3)和经0.5 mg/L NAA处理(R4)的根长均显著低于0.1 mg/L NAA处理(R2)的根长;经0.2 mg/L IBA处理(R5)与经0.2 mg/L NAA处理(R3)相比,其根长无显著差异;经0.1 mg/L IBA +0.1 mg/L NAA处理(R1)与经0.2 mg/L NAA处理(R3)和经0.2 mg/L IBA处理(R5)的根长也无显著差异.经1/2B5基本培养基(R6)与1/2MS(R3)处理相比,其根长无显著差异.R5培养基中试管苗产生的不定根数最多,R6培养基中试管苗产生的不定根数最少.

图4 培养基组成分对抖抖玉露试管苗生根的影响Fig.4 Effect of medium composition on rooting of Haworthia cooperi shoots
高越等[2]研究表明,适宜毛玉露试管苗的生根培养基为1/2MS+NAA 0.5 mg/L.高天舒[6]研究认为,培养基MS+IAA 0.2 mg/L适宜黑肌玉露的生根培养.郭生虎等[4]研究表明,冰灯玉露和黑肌玉露组培苗的最佳生根培养基为1/2MS+IBA 0.5 mg/L+NAA 0.1 mg/L+AC 0.5 g/L.以1/2MS+IBA 0.2 mg/L+AC 3 g/L为玉露组培苗生根培养基时,大窗玉露的生根率为95.56%,黑肌玉露的生根率为94.45%,宫灯玉露的生根率为81.27%,姬玉露的生根率为90%,冰灯玉露的生根率为85.56%[3].这些研究结果表明,不同玉露品种组培苗的最适生根培养基不同.本研究结果表明,抖抖玉露组培苗的最佳生根培养基为1/2MS+IBA 0.2 mg/L.
3 结 论
本文利用离体培养方法研究了不同的基本培养基和植物生长调节物质对多肉植物抖抖玉露组培苗生长、增殖和生根的影响,为建立高效的抖抖玉露组培快繁体系奠定了基础.研究结果表明,抖抖玉露组培苗的增殖培养基以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L最为适宜,增殖系数为5.1;生根培养基以1/2MS+IBA 0.2 mg/L为最佳,平均生根数为3.1.

