喉小细胞神经内分泌癌一例并文献复习
袁波,王荟,张治军
上海中医药大学附属曙光医院耳鼻咽喉科1、病理科2,上海 201203
喉神经内分泌癌是一种恶性程度很高的肿瘤,仅占所有喉部肿瘤的0.5%~1%,喉小细胞神经内分泌癌作为其中一种亚型,临床上极为罕见,易发生全身转移,预后较差[1]。本文报道1 例喉小细胞内分泌癌病例,并对其临床及病理学特点、诊治经过等进行总结分析,为临床医师提供参考,加强对本病的认识。
1 病例简介
患者,男性,51 岁。因“声音嘶哑2 年,加重20 d”于2016 年6 月7 日收治入院。现病史:患者自诉2 年前无明显诱因下出现声音嘶哑,于当地社区医院进行治疗后可好转,时有反复,一直未予重视。20 d前再次出现声音嘶哑,呈进行性加重,继而出现喉痛、痰中带血,偶有进食不畅,呼吸稍有困难,病程中无发热、咳嗽、张口受限。外院治疗后未见明显好转,纤维电子喉镜提示:喉部新生物(具体报告未见)。入院后再次行喉镜检查提示(图1):喉镜下见右侧喉室新生物,色暗红,声带、室带增生肥厚。喉部MRI提示(图2):两侧声带增厚,伴颈部多发肿大淋巴结,考虑喉癌伴淋巴结转移可能大。为明确诊断,于2016 年6 月8 日全麻下行支撑喉镜下喉肿瘤活检术,术中见:双侧声带、室带增生肥厚,表面黏膜增生,色暗红,质脆,易出血,附有黑褐色坏死组织,右侧喉室膨隆。
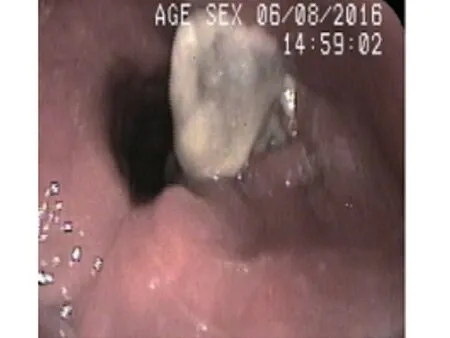
图1 术前喉镜:右侧喉室新生物,色暗红,声带、室带增生肥厚
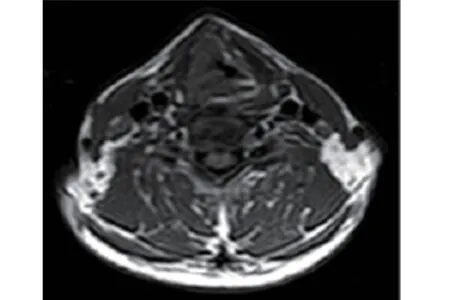
图2 术前MRI:两侧声带增厚,伴颈部多发肿大淋巴结
病理诊断为喉小圆细胞恶性肿瘤,待免疫组化证实。患者有糖尿病史10 年,未规律服药,入院时血糖稍高;有吸烟史30年。术前控制血糖、排除手术禁忌,于2016年6月21日在全麻下行气管切开术+环状软骨上喉切除+环舌骨固定术+颈淋巴结清扫术(择区性)。术中对喉部右侧区域性颈清扫,切除Ⅱ~Ⅳ区淋巴结及其周围结缔组织、脂肪组织,沿颈白线自上而下切开筋膜,直达甲状软骨及环状软骨,沿甲状软骨板切断并分离舌骨下带状肌、咽缩肌,显露右甲状软骨侧缘及其上下角、环甲膜,剪断甲状软骨上下角,环甲动脉、喉上动脉超声刀止血;横行切开环甲膜,上提甲状软骨暴露肿瘤,沿甲状软骨后缘分离暴露梨状窝内壁黏膜,清楚显露肿瘤范围,距肿瘤边缘0.5 cm 以上切除瘤体(包括双侧声带、室带、喉室、会厌根部、右侧勺状软骨,保留左侧披裂)。术后病理及免疫组化结果提示(图3、图4):眼观可见部分喉切除标本一个,大小5 cm×3 cm×1.5cm,距上切缘0.5 cm、下切缘0.7 cm处可见一隆起,大小1.3 cm×1.2 cm×1 cm;另送喉前淋巴结样组织一枚,直径1 cm;颈部2B区淋巴结2枚,直径分别为0.9 cm 和1.2 cm;颈部3 区淋巴结7 枚,直径0.3~3 cm;镜检下见肿瘤组织特征性的“压碎的”人工改变,细胞小,胞浆少,细胞核呈圆形、卵圆形或梭形;染色质致密,无核仁,淋巴结中见肿瘤细胞浸润;(免疫表型)肿瘤细胞CD56、神经元特异性烯醇化酶(neuron-specific enolase,NSE)均(+),角蛋白(Cytokeratin,CK)、角蛋白5/6(cytokeratin 5/6,CK5/6)、上皮膜抗原(epithelial membrane antigen,EMA)、淋巴细胞共同抗原(lymphocyte common antigen,LCA)、CD20、CD30、甲状腺转录因子1 (thyroid transcription factor-1,TTF-1)、B 淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)均-,细胞增殖核抗原 Ki-67 (nuclear proliferation associated-antigen Ki-67,Ki-67)增殖指数90%(+);最后病理诊断为喉神经内分泌癌(小细胞型)。
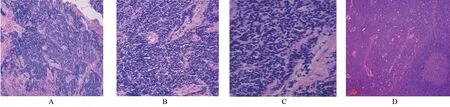
图3 术后病理检查
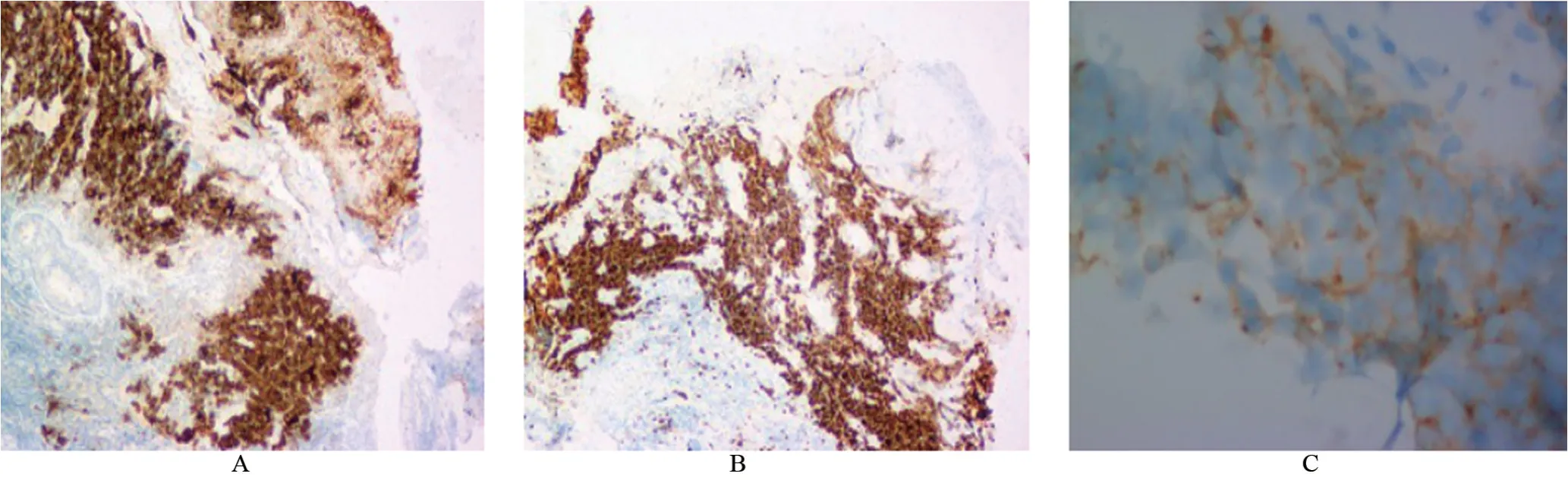
图4 术后免疫组化染色
患者术后伤口愈合好,呼吸困难及吞咽不畅症状消失。该患者拒绝放化疗,仅中药口服维持治疗。随访9个月后,本例患者因肿瘤复发转移死亡。
2 讨论
神经内分泌癌是一种起源于肽能神经元和神经内分泌细胞、能合成和分泌胺及多肽激素的异质性恶性肿瘤。该病可发生于全身多个器官和组织,最常见于肺部、胃肠道和胰腺、支气管,喉神经内分泌癌少见发生[2]。2017 年世界卫生组织(WHO)发布的指南中,将神经内分泌肿瘤分类为3 种亚型:分化差的神经内分泌癌(小细胞神经内分泌癌和大细胞神经内分泌癌)、中分化型(非典型类癌)、高分化型(典型类癌)[3]。其中小细胞神经内分泌癌最常发生于肺部,肺外小细胞神经内分泌癌细胞分化差,恶性程度高,发生率低,仅占约其中的3.5%[4],而首发于喉部的更是极其罕见,虽然如此,颈项部小细胞神经内分泌癌的发生率有逐年升高的趋势[5],应引起临床医生足够重视。
该病男女发病比例为3:1,多见于50 岁以上的老年男性[6]。本病的发生原因尚未完全明确,与饮酒、吸烟、辐射、病毒感染、慢性炎症等多种因素有关。吸烟无疑是其中相关性最高的因素,有研究者统计,约95%喉癌患者均有10 年以上吸烟史,其可能的机理与长期吸烟导致的p53 抑癌基因突变过度表达有关[7],本例患者为老年男性,且存在长期吸烟史,与之相符。
喉小细胞神经内分泌癌几乎可以发生于喉部的任何部位,最为常见的发病部位是富含神经内分泌细胞的声门上区[8]。该病临床特征与肿瘤的生长部位、体积密切相关,多以声音嘶哑、颈部包块为首发症状,可伴随喉痛、呼吸及吞咽困难,甚至肉眼可见肿物表面粗糙伴溃疡坏死,由于本病恶性程度极高、发展迅速,早期即可侵犯周围组织或发生远处转移,有报道显示,约50%的患者在发现原发灶时已有远处转移,最常见的转移部位为颈部淋巴结、骨髓、肝、肺[9],故对本病的早期诊治显得至关重要。
本病临床诊断主要依赖于对病史的详细询问及相关的体格检查,应与喉部鳞癌、黑素瘤、神经母细胞瘤、骨外尤文肉瘤、转移癌等相鉴别[10];实验室检查需完善喉镜、喉部CT、组织活检,如怀疑远处转移,有条件的情况下建议行全身PET-CT 检查,其中组织病理检查及免疫组织化学检查为本病确诊的两个重要手段。本病主要病理特征为:肿瘤细胞小,类圆形或圆形,呈弥漫排列,染色质为细颗粒状,核仁不明显,常见核分裂相,胞浆稀少。免疫组织化学方面,目前还未找到该病独有的标志物来进行判断,需选择一组标志物共同分析以明确诊断,常见的标志物有角蛋白(CK)、CD56、Ki67、嗜铬素A(CGA)、突触素(SYN)可呈阳性,近年来,胰岛素瘤相关蛋白作为一种新的对神经内分泌分化肿瘤特异性及敏感性俱佳的转录因子逐渐受到人们的关注,其在约95.8%高级别神经内分泌癌中表达呈阳性[11],另一种转录因子ASH1 作为分化差的神经内分泌癌的标志物开始被更多人应用于对该病的确诊中[12]。除此之外,电镜也可作为对该病的重要辅助检查手段,电镜下可见神经内分泌颗粒,直径为50~200 nm,多位于外周细胞质[13]。
小细胞神经内分泌癌至今尚无明确的治疗方案,建议根据临床分期、是否发生远处转移等情况进行综合评估后给予治疗。目前最被临床医生推崇的是手术切除联合放化疗的方案,力求在清除病灶的情况下,利用放化疗控制后期病情发展,特别是化疗,因该病早期就容易发生远处转移,有研究者提出在确诊后应积极采用化疗手段控制疾病发展[14]。本病恶性程度极高,生存率差,平均生存率仅为5%,美国癌症协会的一项大数据研究显示,中位生存期仅为17个月,2年生存率仅有40.9%[15],更有报道指出,将近73%的患者死于肿瘤远处转移[16]。本例患者因术后未行放化疗,在随访9个月后即因肿瘤转移死亡。
综上所述,喉小细胞神经内分泌癌临床罕见、恶性程度极高、预后差、易发生肿瘤转移,应早诊断、早治疗,从而提高患者生存时间。

