基于生物信息学方法分析EGLN1在肾透明细胞癌中的表达及意义
姚宇同,刘 岩,戴 露,夏彬彬
(锦州医科大学附属第一医院泌尿外科,锦州 121000)
肾细胞癌(renal cell carcinoma,RCC)是全世界范围内常见的泌尿系统恶性肿瘤之一。2018 年的癌症统计数据显示,全年新诊断为RCC 的患者约40 万人,其中约17.5 万人死亡[1]。其中肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是RCC中最常见的一种病理类型,占全部RCC 的65%~85%。由于RCC 对放疗及化疗不敏感,故目前仍以手术治疗为主。RCC 早期多无明显的临床表现及体征,往往就诊时已经发生转移,而转移性RCC 手术难度大且预后较差,因此,研究RCC 的关键基因对RCC 的诊断、治疗及提示预后具有重大价值。
egl-9 家族缺氧诱导因子1(egl-9 family hypoxia inducible factor 1,EGLN1,又称PHD2)是一种存在于生物机体中的氧敏感因子,通过感知细胞组织内的氧含量的情况调控其下游基因的表达,进而影响如葡萄糖摄取、代谢调节、血管生成、细胞周期等重要生理过程[2]。有研究表明,EGLN1的表达情况与大肠癌[3]、子宫内膜癌[4]、乳腺癌[5]、肺癌[6]等多种恶性肿瘤事件的发生及预后具有密切关系。目前ccRCC 中EGLN1表达的临床意义尚不明确,本文应用生物信息学的方法,综合分析EGLN1在ccRCC中的表达情况,为临床中ccRCC 的诊断、治疗及预后评估提供新的方向。
1 材料与方法
1.1 数据来源和方法
基于癌症基因组图谱(The Cancer Genome Atlas,TCGA,https://portal.gdc.cancer.gov),下载ccRCC患者的基因表达数据[530 例,癌组织样本539 例(存在1 枚病理提取数条样本的可能),癌旁正常肾组织样本72 例]。从该数据中提取全部EGLN1基因的表达情况并进行整理分析,使用R(v3.6.1)中limma及beeswarm程序包绘制EGLN1表达散点差异图。
使用在线分析平台UALCAN(http://ualcan.path.uab.edu/index.html)分析ccRCC 中EGLN1基因在病理分期、肿瘤分级、患者年龄、淋巴结转移状态、组织亚型等角度的表达情况。
基于TCGA 数据库中ccRCC 的临床信息数据(537 例,表1)中EGLN1基因的表达情况进行其与总生存率的相关性单因素及多因素Cox分析。
基因富集分析(gene set enrichment analysis,GSEA)是一种针对全基因组表达谱芯片数据的分析方法。以京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)为背景,根据EGLN1所有的基因表达量进行统计分析,了解EGLN1在各个代谢通路中的高低表达组中的差异。

表1 TCGA ccRCC患者的特征Tab. 1 Characteristics of ccRCC patients in TCGA
功能蛋白互作网络(STRING,https://string-db.org/)[7]是包含已知和预测的蛋白质相互作用的数据库,包括从基因组分析、高通量试验及共表达研究中获得的物理和功能的关联。应用STRING(v11.0)数据库获取EGLN1 来自智人(Homo sapi-ens)的蛋白质互作网络图,并了解EGLN1存在的共表达基因,通过在线平台基因表达谱交互式分析网站(Gene Expression Profiling Interactive Analysis,GEPIA,http://gepia.cancer-pku.cn/)进行相关分析。
1.2 统计学分析

图1 EGLN1在TCGA数据库中的基因表达情况Fig. 1 EGLN1 gene expression in the TCGA database
应用R(v3.6.1)对ccRCC临床病例数据中EGLN1的表达量与总生存期进行单因素及多因素Cox 回归分析。统计检验采取双边检验,P<0.05 为差异具有统计学意义。GSEA中符合|NES|>1、NOM p-val<0.05及FDR q-val<0.25 的富集结果为差异具有统计学意义。(NES为标准化富集分数;NOM p-val为标准化显著性水平;FDR q-val为矫正多重假设检验)。
2 结果与分析
2.1 EGLN1 的表达差异
使用R(v3.6.1),安装limma和beeswarm程序包,于TCGA 数据库下载截止于2019 年8 月ccRCC 数据中的EGLN1基因表达样本(530 例,癌组织样本539例,癌旁正常肾组织样本72例)。应用UALCAN在线分析平台分析ccRCC中EGLN1在患者年龄、病理分期、肿瘤分级、淋巴结转移状态及组织亚型等角度的表达情况(图1)发现,在所有样品中,EGLN1在ccRCC组织中的表达明显高于癌旁正常组织。另外,EGLN1 的表达量随年龄的增长而增加。同时,EGLN1 的表达量与肿瘤的分级和分期成反比,这表明EGLN1基因可能对肿瘤的恶性进展有抑制作用。
2.2 生存分析
提取TCGA数据库中所有ccRCC样本中(537例,表1)EGLN1基因的表达数据,根据表达差异分为高表达组和低表达组,应用R(v3.6.1)对罹患ccRCC患者的生存率进行描绘(图2)。可见EGLN1高表达组患者生存率高于低表达组,且P<0.05,差异具有统计学意义。

图2 EGLN1在ccRCC患者高低表达组的生存差异Fig. 2 Survival difference of EGLN1 between high and low expression groups of patients with ccRCC
2.3 EGLN1 表达量与总生存期相关Cox分析
将ccRCC 患者临床数据样本中EGLN1的表达量与总生存期进行单因素及多因素Cox 回归分析发现,ccRCC 患者癌组织中EGLN1的表达量是患者生存期的独立风险因素。由表2 和图3 可知风险比(hazard ratio,HR)为0.93,95%置信区间(95% confidence interval,95%CI)为0.90~0.97,P为0.000 08。
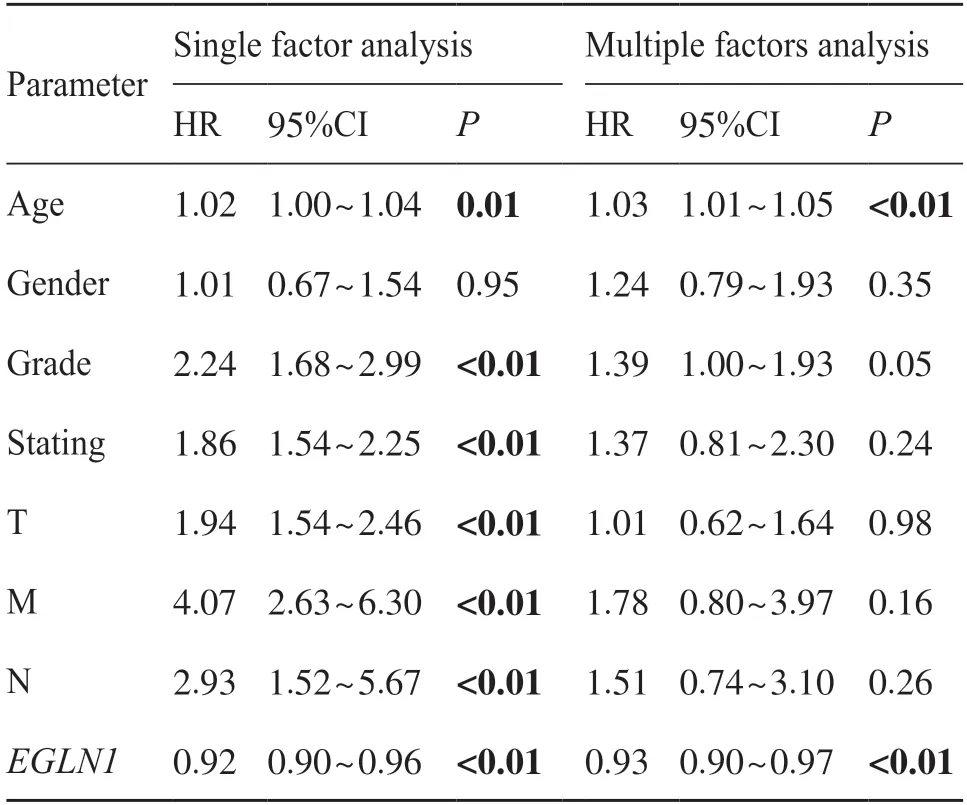
表2 ccRCC患者EGLN1表达量与总生存期相关性的单因素及多因素Cox回归分析Tab. 2 Univariate and multivariate Cox regression analysis of the correlation between EGLN1 expression and overall survival in patients with ccRCC

图3 ccRCC患者EGLN1表达量与总生存期多因素Cox分析Fig. 3 Multivariate Cox analysis of EGLN1 expression and overall survival in patients with ccRCC
2.4 基因GSEA 富集分析
为了解EGLN1基因在ccRCC 中参与的生物过程和信号通路,本研究将539 例癌组织样本按EGLN1表达量的中位值[每千个碱基的转录每百万映射读取的碎片(fragments per kilobase of exon model per million mapped fragments,FPKM)=19.725]分为高表达组及低表达组进行基因GSEA 富集分析(number of permutations:1 000,|NES|>1,NOM p-val<0.05,FDR q-val<0.25)。结果显示,EGLN1的高表达与前列腺癌、子宫内膜癌、胰腺癌、RCC、小细胞肺癌、甲状腺癌、大肠癌等恶性肿瘤密切相关,同时在癌症途径、泛素介导蛋白水解途径、细胞凋亡通路中也呈高表达型(图4、5)。此外,EGLN1在心肌收缩通路中呈低表达型。
2.5 构建蛋白质互作网络
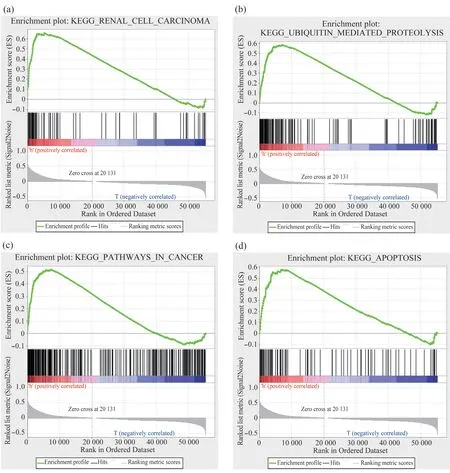
图4 EGLN1在各途径的表达情况Fig. 4 The expression of EGLN1 in each pathway
为进一步了解基因EGLN1在人体内的功能机制,本研究应用STRING 数据库构建了EGLN1 相关功能蛋白质互作网络。由图6 可知,共有20 种预测的功能蛋白与EGLN1 相互作用。其中有4 种相关蛋白基因已被证实与ccRCC 的发生和进展有关。von Hippel-Linda 肿瘤抑制因子(von Hippel-Lindau tumor suppressor,VHL)具有泛素连接酶E3 活性,参与缺氧诱导因子(hypoxia inducible factor,HIF)的泛素化及降解,进而影响其下级通路[如血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)等转录的增加],由此促进恶性肿瘤的进展[8]。已有研究表明,绝大多数ccRCC 中均发生了VHL 的失活[9]。低氧诱导因子1A 亚基(hypoxia inducible factor 1 subunit alpha,HIF1A)的过表达会激活多种致癌信号通路,或使肿瘤抑制因子失活,其升高多发生在癌症早期,通常与肿瘤的恶性进展、预后差及对放化疗的低敏感度有关[10]。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的过度表达可能促进肾脏癌变,其所存在的mTOR 通路的过度激活被认为是RCC 发生的标志[11]。同时,mTOR 的过表达也被认为是多种癌症的不良预后因素[12]。叉头盒O3(forkhead box O3,FOXO3)被认为是一种抑癌基因,参与细胞增殖、细胞程序性死亡等细胞生理过程的调节[13]。在RCC 组织中,miR-122 可直接靶向FOXO3以起到促进肿瘤生长的作用[14]。通过在线网站GEPIA 分析发现EGLN1与VHL、HIFIA、mTOR、FOXO3 的表达均呈正相关(P<0.05)(图7)。

图5 EGLN1基因相关富集分析(细胞凋亡、心机收缩通路、大肠癌、子宫内膜癌、胰腺癌、癌症通路、前列腺癌、RCC、小细胞肺癌、甲状腺癌、泛素介导蛋白水解途径)Fig. 5 EGLN1 gene-related enrichment analysis (apoptosis, cardiac muscle contraction pathway, colorectal cancer, endometrial cancer,pancreatic cancer, pathway in cancer, prostate cancer, RCC, small cell lung cancer, thyroid cancer, ubiquitin-mediated proteolytic pathway)

图6 构建EGLN1相关蛋白质互作网络Fig. 6 Construction of EGLN1 related protein interaction network
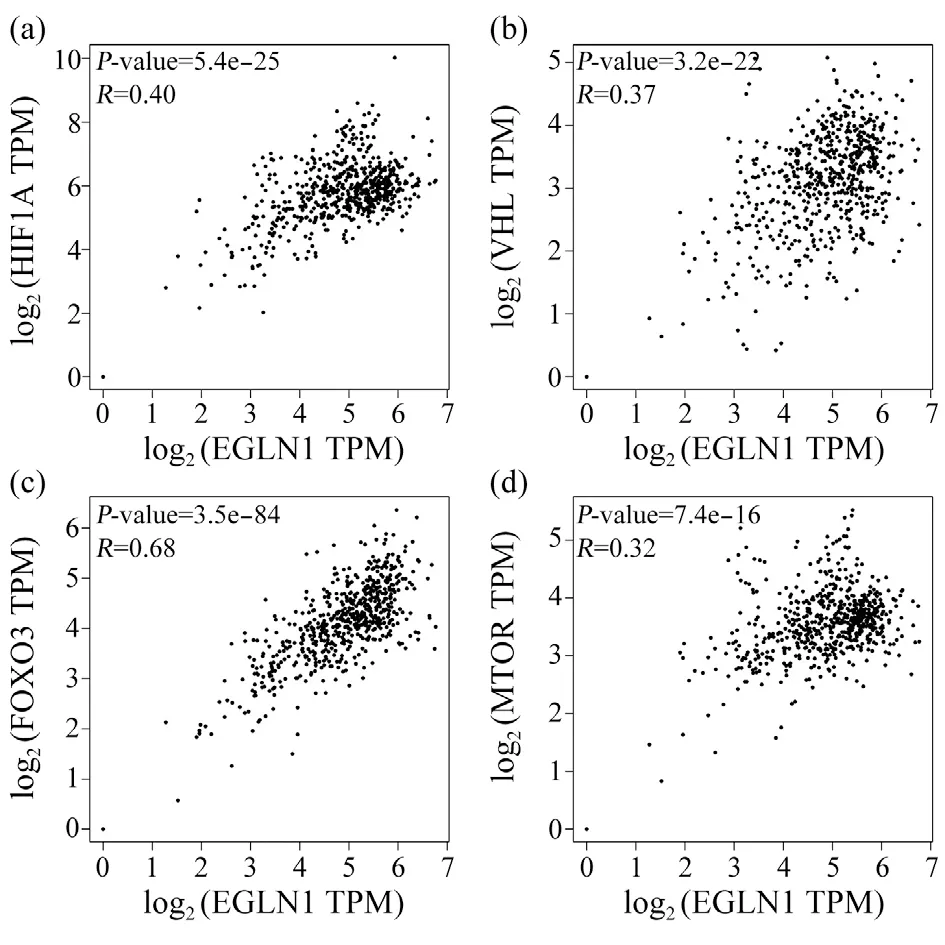
图7 EGLN1相关性分析Fig. 7 EGLN1 correlation analysis
3 讨论
缺氧环境发生于多种实体恶性肿瘤事件这一发现已成为国内外研究的焦点。肿瘤细胞会根据缺氧环境发生一系列生物学变化来应对组织缺氧,如凋亡受限、血管的异常增殖、耐药等。EGLN 家族属于亚铁和2-氧戊二酸双加氧酶家族,作为生物细胞组织中的氧感受器调节着生物机体内的氧稳态。其家族之一的EGLN1 的主要作用即在常氧情况下将HIF1A 羟基化,并通过募集VHL 将其靶向降解[15]。而在乏氧时,EGLN1 活性降低,HIF1A 降解受限并不断积蓄,导致了控制血管生成、葡萄糖代谢、增殖、侵袭及转移等基因的转录[16]。由此可见,EGLN1的表达情况很有可能潜移默化地影响着肿瘤的发生及进展。
EGLN1在不同的癌组织中的作用不尽相同,甚至其表达水平会出现截然相反的情况。在宫颈癌的相关研究中,EGLN1在宫颈上皮内瘤变组织和癌变组织中的阳性表达呈升高趋势[17]。相关试验证明,随着宫颈病变程度的增加,EGLN1 蛋白和其mRNA 水平上调,这表明EGLN1表达高低与宫颈病变严重程度呈正相关。在乳腺癌中,EGLN1 与表皮生长因子受体(epidermal growth factor receptor,EGFR)在低氧环境中的相互作用可能增强了肿瘤的进展和转移[18]。而最近也有研究表明,EGLN1低表达水平的乳腺癌患者的生存时间明显缩短,表明该基因可能存在抗肿瘤作用[18]。同样,肝细胞癌中EGLN1 的高水平与肿瘤分期更高、肿瘤尺寸更大以及患者总体生存状况较差有关[19]。EGLN1 高表达的肺腺癌患者的总生存期(overall surviva,OS)及无复发生存期(relapse free survival,RFS)显著缩短,提示预后不良[20]。Di 等[3]研究发现,在缺氧状态下,mTOR 通路会抑制P70S6K 的活性,进而释放PP2A/B55α 信号,P70S6K 的下调以及PP2A /B55α 磷酸酶活性的相互上调导致EGLN1 的去磷酸化及部分失活,最终促进HIF1A 的稳定。
本研究整理TCGA 数据库发现,EGLN1 在ccRCC中高表达,这与EGLN1 在多种其他恶性肿瘤中的表达相一致。在整理分析EGLN1 表达情况与病理结果时发现,该基因的表达量随年龄的增长而增加,结合多因素Cox 回归分析结果,提示老龄是罹患ccRCC 的高危风险之一。同时,在较高分期及分级的病理组织中,EGLN1 的表达量反而呈下降趋势。其影响ccRCC 恶性程度的机制可能是:在肿瘤组织内,EGLN1 表达下调及HIF1A 的上调加剧了缺氧微环境,激活了血管生成相关刺激因子[21],大量异型血管形成,为肿瘤组织提供了丰富血供的同时也促进了肿瘤的生长和侵袭。此外,低氧环境亦可通过PHD2-HIF1A 驱动机制调节癌症相关成纤维细胞(cancer associated fibroblast,CAF)诱导的基质重塑和癌细胞侵袭[22]。这也间接说明EGLN1 的高表达可能对肿瘤的恶性进展有着抑制作用。多因素Cox 分析显示,EGLN1 的表达量是ccRCC 患者的独立风险因素,提示EGLN1 的表达水平可能会影响ccRCC 患者的预后情况。将TCGA 数据库中ccRCC 患者总体生存率与EGLN1 高低表达进行分析,发现EGLN1 低表达的患者生存率较差,这使得EGLN1 有望成为我们评估ccRCC 的预后指标。我们利用STRING 构建EGLN1 蛋白功能互作网络预测出20 种功能蛋白与EGLN1 相互作用,其中的4 种与ccRCC 的发生与进展相关。进一步应用GEPIA 数据库对它们进行Spearman 分析发现,EGLN1与HIF1A、VHL、mTOR、FOXO3 的表达情况可能相互作用推动着ccRCC 的发生进展。通过富集分析发现,EGLN1 在RCC、癌症途径、泛素介导的蛋白水解途径及细胞凋亡通路中均呈高表达型。同时结合UALCAN 分析平台分析ccRCC 发现,随着肿瘤分期及分级的升高,EGLN1 的表达量呈下降趋势,提示EGLN1 在ccRCC 中可能抑制着肿瘤的恶性进展。Liu 等[23]研究发现,EGLN1 的缺失会导致AKT-mTOR 信号通路的激活,并与致癌性B-Raf 原癌基因(B-Raf proto-oncogene,BRAF)的协同作用可增加原发性皮肤黑色素瘤(skin cutaneous melanoma,SKCM)的淋巴结转移能力。
本研究利用TCGA 数据库样本及生物信息学方法分析验证了EGLN1在ccRCC 临床样本中的表达情况,随后进行ccRCC 患者生存分析及总生存期相关Cox 分析,提出EGLN1可能是ccRCC 中潜在的抑癌因素。生物信息学分析是使用计算机系统收集和分析大量生物数据的技术,缺少试验数据支持验证,存在一定的局限性。未来可以从临床角度对EGLN1与肿瘤病理类型、肿瘤病理分级、术后预后的关系进行分析验证,也可以从基础的角度敲低EGLN1后研究ccRCC 细胞系的侵袭迁移情况。EGLN1在ccRCC 发生与进展中的具体机制及生物学作用仍等待进一步研究。

