过表达TNFAIP1促进替莫唑胺对人脑胶质瘤细胞U251迁移和侵袭的抑制作用
许斐钰,陈 果,龙胜文,魏晨曦
(湖南师范大学生命科学学院,长沙 410081)
关键字:人脑胶质瘤;TNFAIP1;TMZ;细胞侵袭;EMT
人脑胶质瘤是中枢神经系统中最常见的肿瘤,其发病率占全部原发脑肿瘤的40%以上,且具有很强的侵袭性和破坏性,预后差,复发率高,治疗方法有限[1-2]。人脑胶质瘤患者的治疗模式包括手术后联合放疗和化疗。替莫唑胺(temozolomide,TMZ)是一种烷化剂抗肿瘤药物,能使DNA 的核苷酸甲基化并导致甲基鸟嘌呤-DNA 甲基转移酶(O-6-methylguanine DNA methyltransferase,MGMT)异常,致使细胞中DNA 错配修复系统无法正常作用,故常被用于辅助治疗脑胶质瘤。然而TMZ 通常只对缺乏MGMT 的患者有益,并且脑胶质瘤标准治疗后复发往往不可避免,最终导致胶质瘤患者的死亡率很高,这对医生和患者来说是一个不容乐观的现实[3-6]。TMZ 虽然对治疗脑胶质瘤有一定的作用,但是也伴随耐药的发生。上皮-间质转化(epithelial-mesenchymal transition,EMT)是最初在胚胎发育过程中观察到的一个过程。在此过程中,细胞失去上皮特征而获得间充质特性,从而增强了迁移性和侵袭性,这一过程在肿瘤的进展和转移中也很重要[7]。最近的研究表明,EMT 与化疗耐药密切相关,阻断EMT 通路可消除肺癌对抗叶酸化疗的耐药性[8]。在结肠直肠癌和胰腺癌中也发现了同样的结果[9-10]。因此,阐明胶质瘤细胞中迁移和侵袭的分子机制和发现新的靶点可能是了解胶质瘤对TMZ耐药的关键。
肿瘤坏死因子α 诱导蛋白1(tumor necrosis factor α-induced protein 1,TNFAIP1)也被称为B12 或BACURD2,最早在脐静脉内皮细胞中被发现,可被肿瘤坏死因子α(tumor necrosis factor alpha,TNFα)和脂多糖(lipopolysaccharide,LPS)诱导表达[11],其氨基酸序列含有保守的BR-C、TTK、BTB/Pox virus、zinc finger (POZ) domain 及增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)结合位点[12]。大量研究表明,TNFAIP1 对细胞的迁移、侵袭、凋亡和免疫应答都有影响,且TNFAIP1 的异常表达与多种疾病的发生相关,包括乙型肝炎病毒感染、神经性疼痛、阿尔茨海默症(Alzheimer’s disease,AD)等[13-17]。最新研究表明,TNFAIP1 的异常表达在药物引起的神经毒性[18]和肝癌细胞的转移和致瘤性[19]中起关键性作用,然而TNFAIP1 在人脑胶质瘤中的作用和潜在机制却暂无报导。因此,本研究在U251 细胞中过表达TNFAIP1 后,联合TMZ 处理,观察U251细胞的迁移和侵袭能力的变化,并初步探讨其机制,为临床治疗人脑胶质瘤提供新的策略和思路。
1 材料与方法
1.1 材料
人脑胶质瘤细胞系U251 和大肠杆菌菌种E.coliTOP 10 由本实验室保存;pCMV-Myc 质粒(Clone-tech 公司,美国);pCMV-Myc-TNFAIP 1 表达载体由实验室构建保存。TMZ(Sellect公司,美国);RNA Trizol 提取试剂(Takara 公司,日本);用于内参检测的微管蛋白Tubulin、甘油醛-3-磷酸脱氢酶蛋白(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Sigma公司,美国);Myc-Tag抗体(武汉三鹰公司);TNFAIP1、Vimentin、E-cadherin、N-cadherin和Snail 抗体(ABclonal 公司,美国);辣根过氧化物酶偶联的羊抗兔、羊抗鼠二抗(KPL Technologies 公司,美国)。
1.2 方法
1.2.1 细胞培养
细胞培养液为含10%胎牛血清和1%青霉素/链霉素的高糖培养基(Dulbecco’s modified eagle medium,DMEM)培养液。细胞于10 cm 的皿中培养,并置于条件为37℃、5%CO2、饱和湿度恒温的细胞培养箱中,长至对数生长期时用于试验。
1.2.2 脂质体转染
根据LipofectamineTM2000 转染试剂说明书操作,本试验以6 孔板为例,待细胞长至 70%~80%开始转染,吸掉旧培养液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗1次,加入2 mL DMEM,放入37℃细胞培养箱中。分别取100 μL opti-MEM稀释脂质体和质粒DNA(脂质体和质粒DNA 的体积比例为2∶1),室温静置5 min。将稀释好的DNA在涡旋振荡器上滴加到脂质体中,振荡10 s 后室温静置30 min。将200 μL DNA/脂质体混合物滴加到事先饥饿处理的细胞中,前后左右轻轻晃动培养板,混合均匀后放入37℃细胞培养箱,4 h 后,换成含有血清和抗生素的培养液继续培养24 h。
1.2.3 药物处理
细胞在10 cm 培养皿中长至90%以上后,以细胞数量为2×106个铺板于6 孔板中,每孔加2 mL细胞培养液。15~24 h 后,待细胞在6 孔板中长至90%以上时吸去旧培养液,开始加药。设置对照组0.01%的二甲亚砜(dimethyl sulfoxide,DMSO),试验组分别加 0.1、0.2、0.3 mmol/L TMZ(为避免血清的干扰,药物处理时培养基均不含血清),处理36 h。
1.2.4 细胞划痕试验
将细胞接种至6 孔板中,长至90%时吸去旧培养液,按1.2.2 脂质体转染和1.2.3 药物处理的步骤对细胞进行处理。药物处理36 h 后用纯DMEM 洗净旧培养液,进行划痕试验。用10 μL 枪头划痕,枪头垂直于孔板平面,力度一样,目的是为了让伤口宽度保持一致。1 个6 孔板可沿直径划2 次。划痕完后用纯DMEM 洗净漂浮的细胞3 次,后加入2 mL细胞培养液放入细胞培养箱中继续培养,48 h 后取出,再用纯DMEM 洗2 次后拍照,统计划痕伤口愈合情况并分析其迁移率。
1.2.5 Transwell细胞侵袭试验
将细胞铺至6 孔板中,长至70%~80%时按1.2.2 脂质体转染和1.2.3 药物处理的步骤对细胞进行处理。药物处理36 h 后用0.2%胰酶对细胞进行消化,取2×104个细胞铺于事先放置在24 孔板的小室的上室中(体积总量为200 μL),下室加入600 μL 含15%胎牛血清(fetal bovine serum,FBS)的培养基,每个组设置3 个重复。置于细胞培养箱中培养48 h 后,将小室从24 孔板中取出,PBS 洗2 次,用干净的棉签轻轻地刮去小室内部的细胞。注意避免接触小室下部,防止拭去侵袭过去的细胞。随后用4%的多聚甲醛固定30 min,PBS 洗3 次。最后用0.5%结晶紫染色液染色20 min,用PBS 轻轻淋洗小室数次至结晶紫染液洗净,置于室温干燥后在显微镜下拍照,统计从上室侵袭至下室的细胞个数并分析其侵袭率。
1.2.6 Western blot
用0.2%胰酶消化收集细胞,视细胞的量加入细胞裂解液RIPA lysis buffer(6 孔板每孔细胞加150 μL 裂解液),于冰上放置30 min 进行裂解,1 400 r/min 离心5 min 之后抽提细胞全蛋白,用5%的浓缩胶和12%的分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后将蛋白转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,5%脱脂牛奶室温封闭1 h,三乙醇胺缓冲液盐水溶液-吐温-20(triethanolamine buffered saline solution-Tween-20,TTBS)洗4 次,每次10 min,分别加入TNFAIP1、Vimentin、E-cadherin、N-cadherin、Snail、Tubulin 和GAPDH 抗体,4℃孵育过夜。次日,TTBS 洗4 次,每次10 min,后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔或羊抗鼠二抗,室温孵育1 h 后TTBS 洗4 次,每次10 min,加ECL(electrochemiluminescence)显影液,在全自动凝胶成像系统中曝光显影。
1.3 试验数据统计分析
采用Image J 及Graph Pad Prism6 软件分析作图。试验数据用统计软件IBM SPSS 22 进行分析,以平均值±标准差表示,两组间比较采用单因素方差分析和t检验来确定组间差异的显著性,P<0.05为有差异统计学意义。
2 结果与分析
2.1 TMZ抑制U251 细胞的迁移与侵袭
为了研究TMZ 对U251 细胞迁移与侵袭的影响,本试验用0.1、0.2、0.3 mmol/L TMZ 处理U251 细胞36 h,采用细胞划痕法及Transwell 试验分别检测药物处理后U251细胞迁移与侵袭能力的变化,发现TMZ 以剂量依赖的方式抑制了U251 细胞的迁移和侵袭,如图1a~1d 所示。这些数据表明,TMZ 具有以剂量依赖的方式抑制U251 细胞的迁移和侵袭的能力。
2.2 TMZ上调U251 细胞TNFAIP1 的表达
为确定TMZ 是否会影响U251 细胞内TNFAIP1的表达,本试验分别用0.1、0.2、0.3 mmol/L 的TMZ处理U251 细胞36 h,然后分别提取总RNA 和总蛋白。半定量PCR 试验结果表明,随着TMZ 浓度的升高,TNFAIP1 的mRNA 表达上调,如图2b 所示。Western blot 试验进一步表明,随着TMZ 浓度的升高,TNFAIP1 的蛋白表达量上调,如图2a 所示。这说明用TMZ 处理U251 之后上调了内源TNFAIP1 的表达。
2.3 过表达TNFAIP1促进TMZ对U251细胞迁移与侵袭的抑制作用
为了探讨TNFAIP1 是否参与TMZ 对U251 迁移与侵袭的抑制,本试验把转染空载质粒pCMVMyc 组设为对照组,把过表达TNFAIP1 组(Myc-TNFAIP1)、添加TMZ 0.3 mmol/L组(pCMV-Myc+TMZ 0.3 mmol/L)、TMZ 0.3 mmol/L +过表达TNFAIP1 组(Myc-TNFAIP1+TMZ 0.3 mmol/L)设为试验组。过表达TNFAIP1 及0.3 mmol/L TMZ 单独处理均可抑制U251 的迁移与侵袭,但TMZ 0.3 mmol/L +过表达TNFAIP1 联合作用对U251 迁移与侵袭的抑制显著大于过表达TNFAIP1和0.3 mmol/L TMZ单独处理组,如图3a~3d所示。这说明TNFAIP1可促进TMZ对脑胶质瘤的杀伤作用。
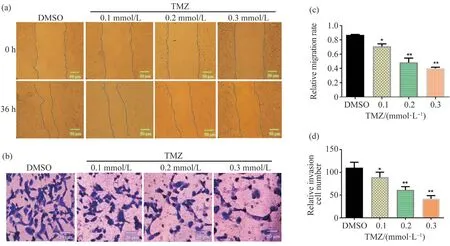
图1 不同浓度TMZ 对U251 细胞迁移和侵袭能力的影响Fig. 1 Cell migration and invasion levels in U251 cells exposed to different concentration of TMZ
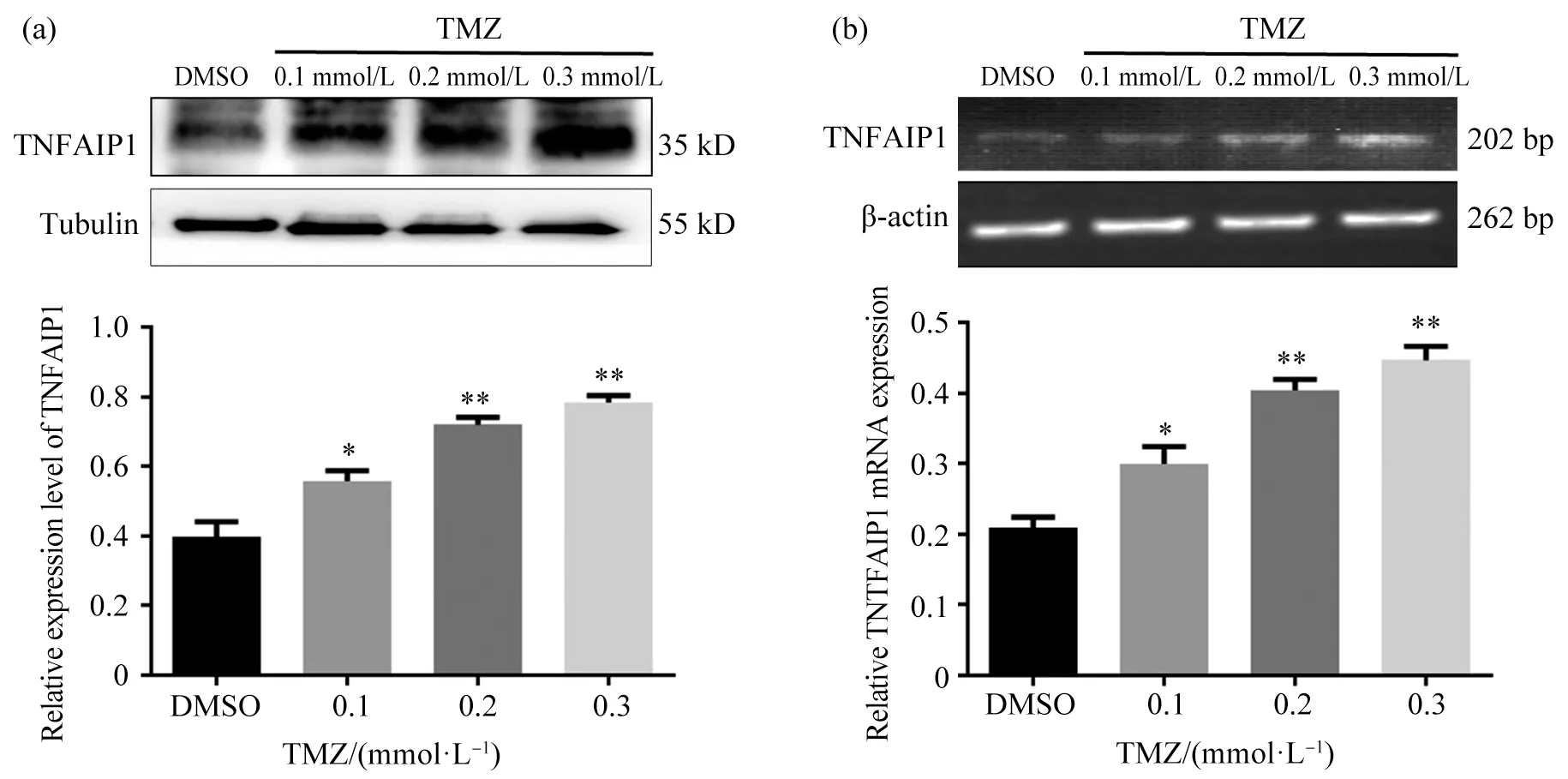
图2 不同浓度的TMZ 对TNFAIP1表达影响的分析Fig. 2 TNFAIP1 expression in U251 cells exposed to different concentration of TMZ
2.4 TNFAIP1 通过EMT 通路抑制U251 细胞的迁移与侵袭
试验最后研究了TNFAIP1 是否通过EMT 通路抑制U251 细胞的迁移与侵袭。当在U251 细胞中过表达TNFAIP1 和用0.3 mmol/L 的TMZ 单独处理时,与对照组相比,上皮分子标志物E-cadherin 的表达分别上调37.1%、31.6%(P<0.01);间质细胞分子标记物N-cadherin分别下调20.7%、33.7%(P<0.01);Vimentin 分别下调4.5%(P<0.05)、34.6%(P<0.01);Snail 分别下调3.5%(P<0.05)、19.3%(P<0.01)。而在过表达TNFAIP1 及添加0.3 mmol/L TMZ 联合作用组中,上皮分子标记物E-cadherin 的蛋白表达比较于对照组上调46.4%(P<0.01),间充质细胞分子标记物N-cadherin、Vimentin、Snail 的表达则分别下调44.3%、52.9%、33.4%(P<0.01),具体如图4a~4c所示。这表明TNFAIP1 能通过EMT 通路参与TMZ对U251 细胞迁移与侵袭的抑制作用,从而减缓肿瘤恶化的发展速度。
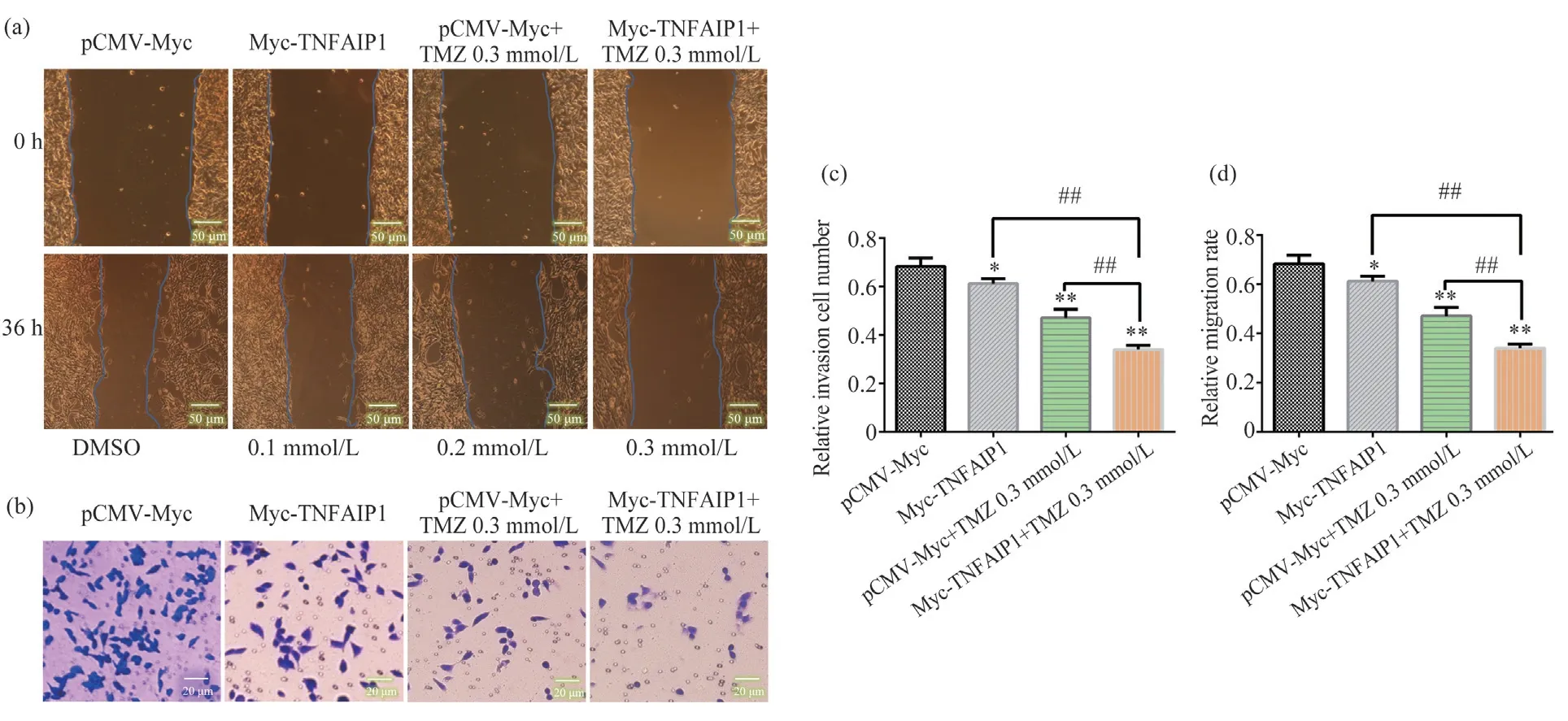
图3 过表达TNFAIP1促进TMZ 对U251细胞迁移和侵袭的抑制Fig. 3 Changes in the effects of TMZ on U251 migration and invasion before and after TNFAIP1 overexpression

图4 Western blot检测过表达TNFAIP1对EMT信号通路的影响Fig. 4 Effect of TNFAIP1 over-expression on EMT signaling pathway detected by Western blot
3 讨论
人脑胶质瘤,特别是级别高的人脑胶质瘤患者的预后通常很差,传统治疗方法已无法有效提高其治愈率和存活率。目前治疗方案主要是以手术治疗为主,术后辅助放疗和化疗,其常用化疗药物为TMZ。TMZ 虽然目前被认为是在开发新的临床神经胶质瘤靶向药物之前最为有效的治疗剂,但是用其治疗后的高复发率及患者预后不良等局限性仍不容小觑。人脑胶质瘤的化疗耐药是一个复杂的过程,必须从多因素、多基因、多机制中共同探讨其潜在的耐药机制[20-22]。TNFAIP1 在人类、小鼠、大鼠和线虫中都有一个极其进化保守的单拷贝基因,且其在DNA 合成和细胞凋亡过程中的重要作用、在AD 尸检患者的大脑中的上调表达、异常表达对小鼠来源神经瘤母细胞(mouse neuroblastoma N2a cells,N2A)的影响等报导比比皆是[23-28],证明了其在神经性胶质瘤中可能存在重要作用。但TNFAIP1在人脑胶质瘤的TMZ耐药性中的作用却尚无报导。
为了探索TNFAIP1 是否在TMZ 抑制人脑胶质瘤迁移及侵袭过程中存在作用,本试验用TMZ对U251 细胞进行药物处理。与已发表的研究相似,TMZ 具有以剂量依赖的方式抑制U251 细胞的迁移和侵袭的能力[1,5,20]。之后,我们提取药物处理U251 细胞后的总RNA 及总蛋白,分析发现TNFAIP1 的转录及蛋白表达水平均呈现上调趋势。这表明TNFAIP1 可能参与了TMZ 对U251 细胞迁移及侵袭抑制的过程。此前我们实验室已经证明TNFAIP1是一个抑癌基因[18-19,26,28],而TMZ 上调U251细胞中TNFAIP1 的表达,所以我们选择过表达TNFAIP1。试验数据表明,相较于只用TMZ和只过表达TNFAIP1,过表达TNFAIP1 联合TMZ 对U251 细胞迁移及侵袭的抑制作用明显增强。这说明过表达TNFAIP1 能联合TMZ 促进对人脑胶质瘤迁移和侵袭的抑制作用。
临床上认为癌细胞的侵袭转移是肿瘤不良预后的主要原因,大量文献报导,EMT 是肿瘤细胞获得强侵袭及转移能力的重要进程之一。EMT 是上皮细胞失去极性而重组细胞骨架,进而转变成具有迁移能力的间质表型的过程。该过程与多种上皮和间充质基因的转录水平改变有关。且有研究表明,化疗药物常抑制EMT 的进展[29-32]。EMT 也被认为是卵巢癌、肝癌等肿瘤侵袭和转移的中心机制[33-34]。EMT 中上皮分子标志物E-cadherin 的下调是关键环节,已有研究发现了一些能够抑制E-cadherin 表达的转录因子,包括Snail、Slug、Twist 及E47蛋白[35]。且EMT 中间充质标志物蛋白的表达增加能使上皮细胞表现出多种间充质细胞的特质,从而导致细胞的运动能力和侵袭性增加[33,36]。试验数据表明,相较于只用TMZ 和只过表达TNFAIP1,过表达TNFAIP1 联合TMZ 使EMT 的过程受到抑制,表现为上皮分子标志物E-cadherin 表达上调,间质细胞分子标记物N-cadherin、Vimentin 和Snail 表达下调,这表明TNFAIP1 能通过EMT 通路抑制U251 细胞的迁移与侵袭。
综上所述,我们的研究说明TMZ 不仅能抑制U251 的迁移与侵袭能力,同时能升高TNFAIP1 的表达。过表达TNFAIP1 可以促进TMZ 对人脑胶质瘤细胞U251 迁移与侵袭的抑制,表明TNFAIP1作为一个抑癌基因在TMZ 抑制U251 迁移、侵袭过程中发挥了重要作用,因此TNFAIP1 可以作为临床治疗人脑胶质瘤耐药的潜在生物标志物和潜在的药物靶点。但TNFAIP1 参与U251 对TMZ 耐药的具体过程及分子机制仍需进行更深入的研究。

