不同分子质量菊芋菊糖益生元特性及其益生菌微胶囊稳定性研究
杨立娜,黄靖航,李燕红,佟 彤,王胜男,何余堂,刘 贺,朱丹实*
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 辽宁省粮谷类食品生物高效转化工程研究中心 辽宁锦州121013)
人体消化道内的细菌多达500~1 000 种,人体的生理、免疫、消化和抗衰老等都离不开肠道微生物群[1]。维护肠道微生态平衡,益生菌功不可没。而裸露的益生菌对外界不利环境非常敏感,大部分难以抵抗胃液的酸性环境到达肠道发挥作用。通过微胶囊技术可以将益生菌包裹在微小且封闭的胶囊中,这不仅提高益生菌在胃液中的存活率,还能促进其在肠道中的释放[2-3]。熊涛等[4]发现脱脂乳和海藻酸钠为壁材具有良好的耐酸性,用其包埋的植物乳杆菌NCU116 在人工胃液中处理3 h后,微胶囊中的活菌数仍可达8.79×109CFU/g。赵伟丽等[5]以海藻酸钠、大豆分离蛋白和低聚果糖为壁材包埋植物乳杆菌,经胃、肠液处理后微胶囊活菌数显著高于未包埋的活菌数。天然菊糖具有降血脂,改善肠道环境,促进有益菌增殖,预防肥胖,改善糖尿病等功效[6-8]。然而,天然菊糖的分子质量跨度大,严重影响其凝胶特性、流变学特性和营养学特性等功能,因此不同分子质量的菊糖作为壁材,对益生菌微胶囊的稳定性也会产生影响。
本研究采用乙醇分级天然菊糖,通过体外模拟消化环境考察不同分子质量菊糖的消化特性,测定在益生菌作用下消化液pH 值、OD 值、流变特性和短链脂肪酸(Short-chain fatty acid,SCFA)的变化。选取益生效果最佳的菊糖为壁材,益生菌为芯材,通过挤压法制备1 款菊糖益生菌微胶囊,同时检测微胶囊的包埋率、消化稳定性、溶解性和贮藏稳定性等指标。
1 材料与方法
1.1 菌种、培养基与材料
植物乳杆菌(Lactobacillus plantarum),北京川秀科技有限公司;MRS 肉汤培养基,青岛高科园海博生物技术有限公司;褐藻糖胶,北京天和益生健康科技有限公司;菊糖,荷兰Sensus B.V 公司;胰酶,北京博奥拓达有限公司;2-乙基丁酸,上海源叶生物科技有限公司;其它试剂(分析纯级)均购自国药集团化学试剂有限公司。
1.2 仪器与设备
OA21002 型精密电子天平,上海舜宇恒平科学仪器有限公司;PHS-3C 型精密pH 计,上海雷磁仪器厂;TDL-5-A 低速离心机、LRH-150 恒温培养箱,上海一恒科学仪器有限公司;Allegra 64R高速冷冻离心机,美国贝克曼库尔特有限公司;LDZF-50KB 立式压力蒸汽灭菌器,上海申安医疗器械厂;UV-2550 紫外-可见分光光度计,日本岛津公司;DHR-1 流变仪,美国TA 公司;7890A-5975 气相色谱-质谱联用仪,美国安捷伦公司;Tis 显微镜,日本Nikon 公司。
1.3 菊芋菊糖体外模拟消化特性研究
1.3.1 模拟消化液配制与菌种活化 参考并改进胃液和肠液的配制方法[9],将2.0 g NaCl 溶解于200 mL 蒸馏水中,用0.1 mol/L 的HCl 溶液调节pH 值至1.2,加入5.0 g 胃蛋白酶后,搅拌均匀定容至1 L;取3.4 g KH2PO4,溶解于200 mL 蒸馏水中,用0.1 mol/L NaOH 溶液调节pH 值至6.8,加入5.0 g 胰酶后,搅拌均匀定容至500 mL。将模拟消化液过滤除菌后,放在4 ℃保存备用。
益生菌活化:取植物乳杆菌菌粉1.0 g 分别接种到已经灭菌过的MRS 肉汤培养基,37 ℃恒温培养条件下培养48 h 备用。
1.3.2 菊糖分级与体外模拟消化 采用分步分级法[10],称取天然菊糖配制菊糖饱和溶液,加入无水乙醇调配成体积分数80%和10%的乙醇溶液,4℃静置24 h 后,4 000 r/min 离心30 min,65 ℃烘干,得到2 种分子质量的菊糖。
将不同分子质量菊糖以1%添加量加到体外模拟消化液中,并接种体积分数1%的菌悬液,37℃恒温培养。试验分为4 组:空白组、天然菊糖组、10%乙醇沉淀的菊糖组(以下简称10%菊糖组)和80%乙醇沉淀的菊糖组(以下简称80%菊糖组)。
1.3.3 益生菌增殖与肠液酸化检测 取0,24,48,72 h 的体外模拟消化液,在波长650 nm 处测定OD 值,绘制益生菌生长曲线;同时,测定各时间点消化液的pH 值,绘制pH 值变化曲线。
1.3.4 肠液流变特性检测 分别吸取0,24,48,72 h 的不同体外模拟消化液,参考杨希娟等[11]的方法并改进,采用40 mm 平行板夹具,25 ℃下线性剪切,剪切速率为0.1~100 s-1,测定时间为180 s,连续测定180 个数据点,检测消化液表观黏度随剪切速率的变化情况。
1.3.5 短链脂肪酸(SCFA)检测 使用GC-MS 检测消化液在24 h 和48 h 两个阶段的SCFA 组成,采用外标法测定。取出1 mL 消化液放入2 mL 的离心管中,加入40 μL 10%H2SO4,涡旋混匀。向离心管中加入500 μL 乙醚,将酸化后的样品萃取到乙醚中。4 ℃,14 000 r/min 离心15 min,小心吸取上层乙醚相用于分析。GC 设置参数:色谱柱Rtx-WAX 色谱柱(30 m×0.25 mm×0.25 μm)。程序升温参数:初始温度60 ℃,以15 ℃/min 的速度上升至230 ℃后保持3 min,载气为氦气,流速1.5 mL/min,汽化室温度250 ℃,以10∶1 进样比分流进样。MS 的参数:离子源温度200 ℃;接口温度250℃;扫描的质荷比范围:2~100[12]。
1.4 益生菌微胶囊性能研究
1.4.1 益生菌微胶囊的制备 将活化后的菌悬液于2 000 r/min 离心10 min,收集沉淀,用生理盐水将沉淀悬浮。将悬浮液与2%菊糖混合,涡旋振荡10 s。微量注射器将混匀的溶液滴入无菌的3%CaCl2溶液中,静置5 min。将湿胶囊过滤,生理盐水冲洗3 次,备用。
1.4.2 微胶囊包埋率测定 取0.5 g 益生菌微胶囊,去离子水冲洗3 次后研磨、溶解。平板计数法测其内部活菌数为A(CFU/mL);再测定制备微胶囊时浓缩菌液中的活菌总数为B(CFU/mL),用此方法计算微胶囊的包埋率I(%),如公式(1)所示[13]:

1.4.3 微胶囊胃肠液消化稳定性测定 取1 g 微胶囊放入9 mL 人工模拟胃液或肠液中,将其置于摇 床(37 ℃,210 r/min),在0,20,40,60,80,100,120 min 时取样液于650 nm 处测定OD 值。将消化液以4 000 r/min 离心10 min,倒去上清液。用一定量的水将沉淀洗入已知质量的蒸发皿中,移入105 ℃干燥箱中烘至恒定质量。计算微胶囊在模拟胃肠消化液中的溶解率,如公式(2)所示[14]:

式中,M——样品质量(g);M1——蒸发皿质量(g);M2——蒸发皿和不溶物质量(g);A——样品含水量(%)。
1.4.4 微胶囊贮藏温度测试 将制备好的微胶囊加入到无菌生理盐水中,分别贮藏于4,25,37 ℃条件下,在0,1,3,7,14,21 d 时取样平板计数。
1.5 数据统计分析
每个试验重复3 次,采用Origin 9.1 软件作图,应用SPSS 19.0 软件进行方差分析,以P<0.05为显著性检验标准。
2 结果与分析
2.1 不同分子质量菊糖干预后益生菌的增殖情况
通过观察0~72 h 内发酵液的OD 值和pH 值变化,分析植物乳杆菌在不同分子质量菊糖干预下的增殖情况。OD 值的大小反映发酵液中菌群数量的多少,变化速率的大小反映菌群增长的快慢[15]。由图1可知,0~24 h,10%菊糖组的OD 值快速上升,变化速率高于其它组;24~48 h,除空白组以外,所有样品的OD 值变化速率均增大,10%菊糖组仍然最高;48~72 h,随发酵时间的延长,所有组的变化速率降低,OD 值逐渐趋于一致。与空白组相比,添加不同分子质量菊糖干预后的植物乳杆菌数量和增殖速度较高,表现出较好的增殖效果。虽然所有菊糖组都能促进植物乳杆菌的增殖,但是10%菊糖促进植物乳杆菌增殖效果最佳。因此,不同分子质量的菊糖对益生菌的增殖效果方面存在一定差异。刘丽莎等[16]研究表明白术中多糖成分对双歧杆菌和乳杆菌具有良好的促生长效果,且这种促生长作用与其添加浓度有关;Wang等[17]研究表明油菜籽多糖可以显著刺激双歧杆菌和乳酸菌的增殖、生长以及酸化活性;Chen 等[18]研究表明以竹笋多糖作为葡萄糖的替代碳源,对体外发酵双歧杆菌和乳酸菌的生长具有显著促进作用,以上结果与本研究一致。益生菌可利用的主要营养来自于碳水化合物,因此益生菌可以通过降解复杂的植物多糖获取能量和营养供自身生长繁殖[19]。
pH 值下降是菊糖体外模拟消化过程中的一个显著变化,主要由于植物乳杆菌有效利用菊糖,使其分解为乳酸、醋酸或其它有机酸,从而导致pH 值降低。pH 值的降低可以有效抑制杂菌生长。由图1可知,0~48 h,与空白组相比,天然菊糖、10%菊糖和80%菊糖组的pH 值下降更快,趋势基本一致;48~72 h,发酵液的酸化程度缓慢下降,而10%菊糖组pH 值最低。pH 值的变化趋势与OD值的变化趋势相互对应,说明植物乳杆菌对菊糖的利用程度越高,菌株数量越多,消化液的酸化程度越高。有研究表明,天然菊糖的分子质量在6 000 u 左右,10%菊糖的分子质量在1 900 u 左右,80%菊糖的分子质量在2 200 u 左右[20]。这说明植物乳杆菌对低分子质量菊糖的利用程度较高,产酸较多。李琬聪[21]研究菊芋中不同聚合度的菊糖对双歧杆菌的益生活性的影响,也得到了相似曲线趋势,双歧杆菌的生长状况基本与菊糖聚合度呈反比,即聚合度小的菊糖做碳源的培养基更有利于益生菌的生长,与本研究结果保持一致。
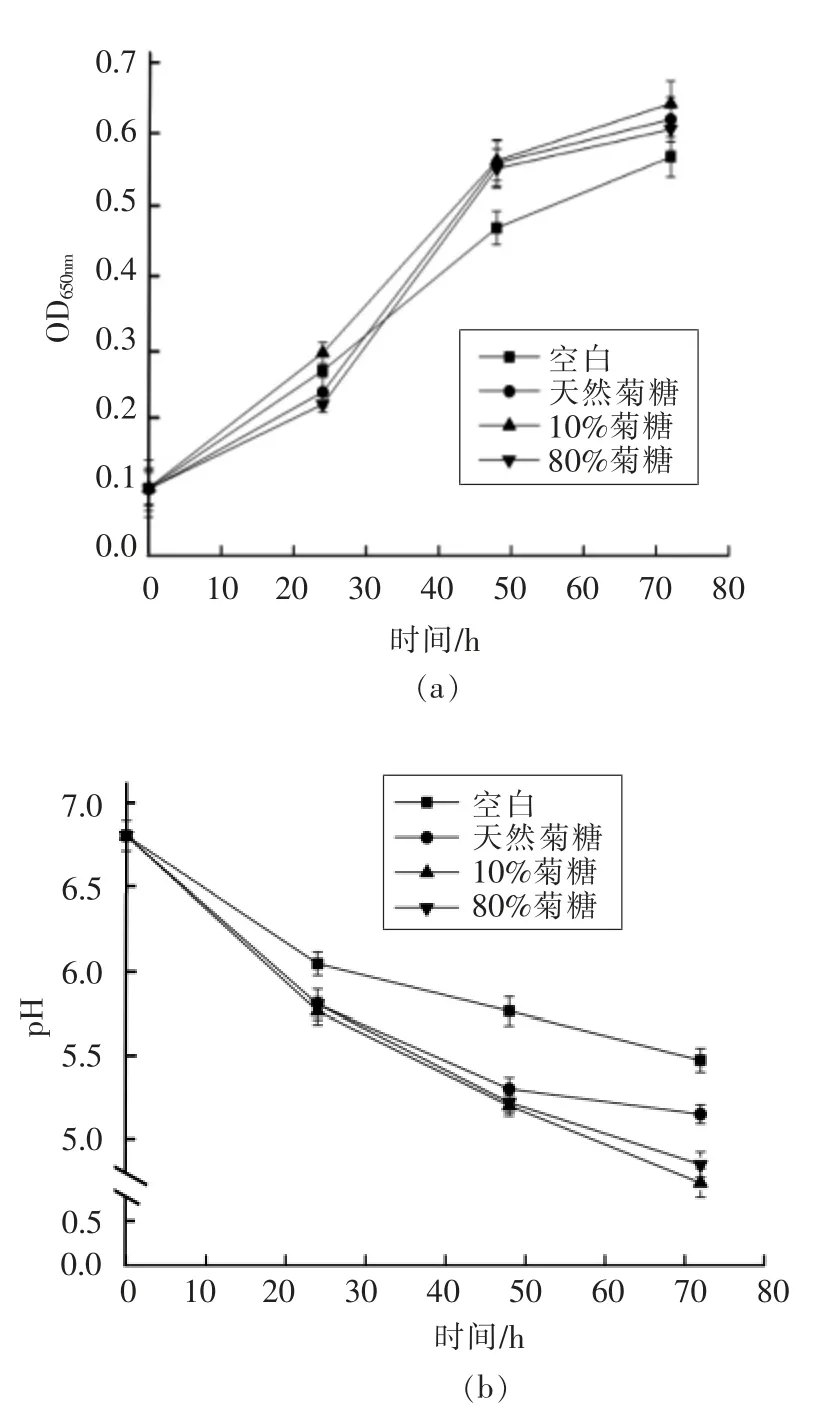
图1 植物乳杆菌生长曲线(a)和pH 值变化曲线(b)Fig.1 Compound probiotic growth curve (a)and pH value curve (b) of Lactobacillus plantarum
2.2 不同分子质量菊糖干预后发酵液的流变特性

图2 剪切速率对消化液表观黏度的影响Fig.2 Effect of shear rate on apparent viscosity of digestive juice
肠液流变性的变化通常会影响肠道菌群的定殖、分布与生长,进而影响益生菌对营养物质的吸收效果[22]。在0~100 s-1的剪切速率下,测定不同分子质量菊糖的益生菌模拟消化液的表观黏度。结果如图2所示,在0~20 s-1的剪切速率下,0,24,48,72 h 各组的表观黏度均随剪切速率的增加而迅速降低,呈剪切稀化的流动特征,因为在应力的剪切下,发酵液的结构被破坏,表观黏度呈不断下降的趋势[23]。在20 s-1之后,发酵液的表观黏度不再随剪切速率的增大而下降,而是趋近一个常数,表现为恒定的理想牛顿流体行为,这种剪切稀化和凝固特性的规律更类似于人体肠道黏液实际的流变学特性[24]。Wang 等[25]、Marie 等[22]研究也发现了类似的结果。而且通过比较发现,0~48 h 时10%菊糖组的表观黏度较高,然而随着发酵时间的延长,在48 h 时,10%菊糖组的表观黏度略有降低。由于0~24 h 内肠道菌群快速利用菊糖,产生的代谢产物改变了发酵液的表观黏度;在72 h 后,含有菊糖的消化液的表观黏度趋于一致,主要因为益生菌发酵接近终点,发酵终产物差异较小。
2.3 短链脂肪酸的GC-MS 分析
短链脂肪酸(SCFA)主要由双歧杆菌、乳酸菌等代谢碳水化合物产生,参与机体重要的生理代谢过程,为结肠黏膜细胞提供主要能量,维持肠道的正常功能[26]。如表1所示,植物乳杆菌发酵24 h时,10%菊糖组产生甲酸、乙酸和丁酸3 种SCFA,其中乙酸含量最高;天然菊糖组和80%菊糖组只产生乙酸和丁酸2 种SCFA,且含量较低;空白组未产生SCFA。植物乳杆菌发酵48 h 时各组产生SCFA 继续累积,且变化规律与发酵24 h 时保持一致。不同分子质量菊糖均能被益生菌降解代谢产生SCFA,并且对10%菊糖的利用度更高。10%菊糖的分子质量较80%菊糖和天然菊糖的分子质量更低,更容易被植物乳杆菌所利用。谢洁玲等[27]研究也发现,肠道菌群体外降解岩藻聚糖硫酸酯寡糖和低分子质量组分更彻底,而对高分子质量岩藻聚糖硫酸酯的降解和利用度很低。

表1 不同时间消化液中短链脂肪酸含量(μg/mL)Table 1 Short-chain fatty acid content in digestive juices at different times (μg/mL)
综上,根据不同分子质量菊糖对植物乳杆菌增殖能力、发酵液流变特性以及代谢产物SCFA含量的影响,选取益生效果最佳的10%菊糖作为微胶囊主要壁材,做下一步研究。
2.4 微胶囊的包埋率及模拟胃、肠液中的稳定性
包埋率是微胶囊进行工艺优化的主要指标,也是评价微胶囊质量好坏的重要指标,因此包埋率是制造微胶囊产品首要考虑的因素[28]。本研究结果显示微胶囊内部活菌数和包埋率分别为97.6 CFU/mL 和71.98%。常柳依等[29]采用藻酸盐寡糖包裹长双歧杆菌的包埋率为71.98%;Krasaekoopt等[30]采用低聚半乳糖和菊粉包裹嗜酸乳杆菌的包埋率为79.4%;吴军林等[31]采用菊粉和海藻酸钠包埋副干酪乳杆菌R8 的包埋率为77.6%。糖类物质包埋益生菌的包埋率大部分在70%~80%之间,本研究的微胶囊包埋率也符合这个规律。
由图3可知,微胶囊在人工模拟胃液中随着时间的延长逐渐溶解,至40 min 时达到最大值,40 min 后微胶囊几乎不再溶解,趋于稳定。经过计算,微胶囊溶解率为12.41%,该结果表明经过包埋的植物乳杆菌在经过胃液消化时,少量微胶囊出现溶解释放益生菌的现象。李伟等[32]研究表明海藻酸钠/壳聚糖双层合生元微胶囊在体外模拟胃液中的溶解率可达10%,甚至更低;陈虎等[33]研究表明以两亲性青稞β-葡聚糖酯为壁材,花青素微胶囊在模拟胃液中的溶解率为19.6%。单层菊糖包埋的微胶囊虽不如双层微胶囊在胃液中稳定,但相较于大部分单层包埋微胶囊而言,菊糖微胶囊在模拟胃液中的溶解性更低,稳定性更好。
由图3可知,微胶囊在人工模拟肠液中0~60 min 溶解速度较快,60 min 后溶解速度变慢,微胶囊溶解释放逐渐稳定。消化液中无明显颗粒存在,微胶囊溶解率接近100%,这说明植物乳杆菌微胶囊进入肠道后,在60 min 内几乎全部崩解,释放出包埋在内的植物乳杆菌,使其在肠道发挥作用。Gebara 等[34]研究表明嗜酸乳杆菌La5 微胶囊在肠道中完全释放为300 min;刘欢[35]研究表明乳酸菌微胶囊在模拟肠液中完全释放需要120 min,在猪肠消化物中益生菌需要60 min 完全释放;李军等[36]研究表明动物双歧杆菌RH 微胶囊在模拟肠液中120 min 完全崩解。大部分以其它原料作为壁材的微胶囊,在人工模拟肠液中完全溶解通常是在服用100 min 后[37],菊糖益生菌微胶囊在人工模拟肠液中的溶解速度相较于其它微胶囊更为迅速,作用时间更长。而与胃中的溶解释放相比,肠液中的溶解释放速率更快,可能因为肠液中含有胰淀粉酶,所以加速了微胶囊的破壁,加速了益生菌的释放。
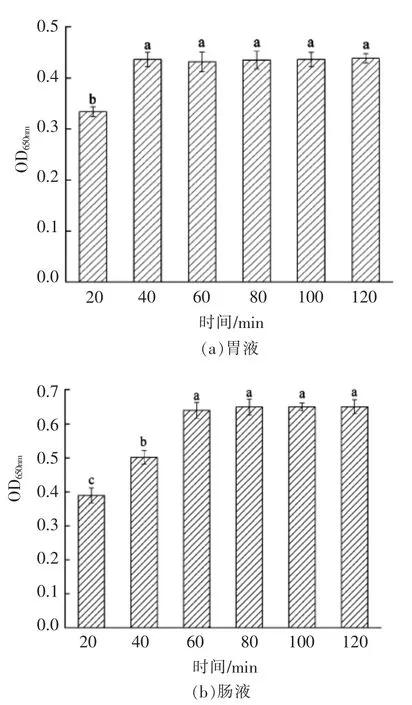
图3 人工模拟胃肠液中微胶囊的稳定性Fig.3 Artificial simulation of the stability of microcapsules in gastric and intestinal juice
2.5 微胶囊的贮藏稳定性
由图4可知,4 ℃和25 ℃贮藏条件下,微胶囊稳定性较好,而37 ℃条件下微胶囊的贮藏稳定性降低。同时,4 ℃条件下贮藏21 d,微胶囊溶解速度相对最缓慢,稳定性更好(P<0.05),损失较少。因此4 ℃为微胶囊的最佳贮藏温度,微胶囊对包埋在内的益生菌保护效果最好。廖霞等[38]研究也发现较低温度下有利于槲皮素微胶囊的贮存和使用,与本研究结果一致。
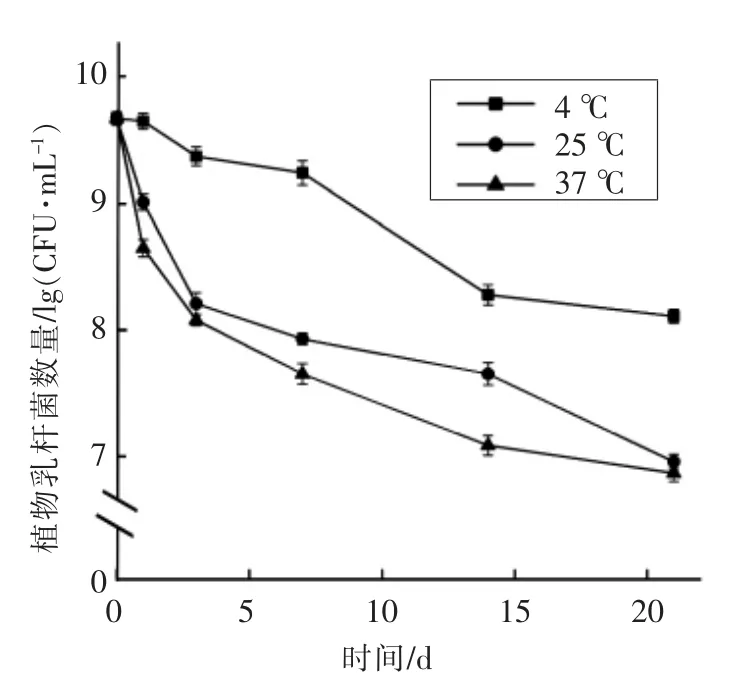
图4 不同温度对微胶囊贮藏稳定性的影响Fig.4 Effect of different temperatures on the storage stability of microcapsules
3 结论
不同分子质量的菊糖在体外模拟消化中都能促进植物乳杆菌增殖,改变发酵液的流变学特性,产生SCFA,其中10%乙醇醇沉的小分子质量菊糖的益生效果最佳。以10%菊糖作为壁材的益生菌微胶囊包埋率达到71.98%;在模拟胃液中较稳定,溶解率为12.41%;在模拟肠液中溶解率接近100%。低温4 ℃和常温25 ℃条件下微胶囊贮藏稳定性较37 ℃好,且4 ℃条件下效果最佳。未来,小分子质量的菊糖在营养保健等领域具有良好的应用前景。

