硬脂酸修饰的燕麦多糖自聚集胶束的制备及其特性初探
杨维宇,张 艳,李芬芬,黄丹菲*
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047 2 江西省吉安市第一人民医院 江西吉安343000)
一些疏水性活性物质所具有的各种药理作用已被广泛认可,然而其溶解性及稳定性较低,限制了其在体内的生物利用率及实际应用[1]。为此,研究出简单易得又对生物体无毒害作用的疏水性活性物质的载体,成为食品行业亟待解决的关键性问题。近年来,众多研究表明,将疏水性活性物质包埋或接枝于两亲性聚合物中,可有效增加其溶解性,从而提高其生物利用率。天然活性多糖因具有特殊的结构,极好的功能特性,获得方法简单,易被降解等多项优点,成为主要关注对象[2]。如将天然多糖进行疏水化修饰,利用其分子间和分子内疏水基团的相互作用,形成核壳结构的自聚集胶束。疏水药物或者其它生物活性物质包裹在内核中,亲水多糖链外壳不仅能提升其溶解性,增加胶束的稳定性,还能适当延长其在体内的循环,增加其吸收利用率。有学者提出,两亲性聚合物进入体内后,可能会与其生命系统呈现出更优的兼容性,与机体内营养元素或者各种酶类物质产生更好的相互作用,提升机体对物质的利用[3]。两亲性多糖可在较低浓度下形成胶束结构,包载疏水性物质通过主动或被动运输方式,至病变部位,降低药物对正常组织的毒副作用[4]。葡聚糖作为非离子型多糖的一种,不仅溶于水,还能够溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)等有机溶剂中,使其在合成两亲性葡聚糖衍生物时更容易选择与葡聚糖和疏水分子相容的溶剂。与此同时,所合成的疏水化合物可以成为某些疏水性药物或活性物质的贮藏库,防止药物等过早降解和消除[5],有效提升这些疏水性活性物质的利用率,使其更好地发挥本身的多项功能。
本文利用硬脂酸对燕麦β-葡聚糖进行疏水化改性,得到两亲性燕麦β-葡聚糖,即燕麦β-葡聚糖硬脂酸酯(Oat β-glucan stearate ester,OGE),探究OGE 的基本特性,为其作为疏水性药物或生物活性物质的载体提供参考。
1 材料与方法
1.1 材料、试剂与仪器
燕麦β-葡聚糖(80%),张家口一康生物科技有限公司;硬脂酸(分析纯),上海国药集团;N,N’-羰基二咪唑(99%),阿拉丁试剂有限公司;异丙醇(分析纯)、无水乙醇(分析纯)、无水甲醇(分析纯),西陇科学股份有限公司;二甲基亚砜(分析纯),天津市大茂化学试剂厂;氘代二甲基亚砜(Methyl sulfoxide-d6,DMSO-d6,99.9%)、二甲基亚砜(色谱纯)、正庚烷(色谱级)、溴化钾(光谱纯)、甲醇钠(分析纯)、硬脂酸甲酯(≥99%),阿拉丁试剂有限公司;荧光探针芘(≥99%,色谱纯),美国Sigma-Aldrich 试剂公司;DMEM 高糖培养基、胎牛血清(Fatal bovine serun,FBS),索莱宝生物科技有限公司;Cell counting kit-8 (CCK-8 试剂盒),日本同仁化学研究所。
6890N 型气相色谱仪 (配有FID 检测器和Rev.A.10.02 色谱工作站),美国Agilent Technologies 公司;ALPHA 1-2 冷冻干燥机,德国Martin Christ 公司;Nicolet FT-IR 5700 型傅立叶红外光谱仪,美国Thermo Electron 公司;AL 104 电子天平,上海梅特勒-托利多仪器公司;旋转蒸发仪,上海申生科技有限公司;恒温磁力加热搅拌器,巩义市予华仪器有限责任公司;TDL-5 型离心沉淀机,上海飞鸽系列离心机厂;QL-861 涡旋振荡器,海门市其林贝尔仪器制造有限公司;Milli-Q Academic 超纯水系统,Millipore 公司;Bruker AV 600 MHz 核磁共振波谱仪,瑞士布鲁克公司;场发射扫描电镜带能谱仪,日本电子电器公司;生化培养箱,上海森信实验仪器有限公司;粒度和电位测量仪,英国马尔文仪器有限公司等;F-700 荧光分光光度计,日本日立公司。
1.2 试验方法
1.2.1 燕麦β-葡聚糖硬脂酸酯(OGE)的制备参照祝佩佩等[6]的方法,并稍做修改。称取不同摩尔质量的硬脂酸于25 mL DMSO 后,置于70℃恒温水浴中至完全溶解,加入等量N,N’-羰基二咪唑混匀,70 ℃条件下反应15 h 后,获得硬脂酸酰基咪唑活化液。称取1 g 燕麦β-葡聚糖,完全溶解于20 mL DMSO 中,分别加入不同体积、不同浓度的硬脂酸酰基咪唑活化液,70 ℃、300 r/min反应不同时间。待反应液完全冷却后,加入2 倍体积的异丙醇醇沉10 h,抽滤获得沉淀物质。将获得的沉淀物质完全溶解于80 mL 超纯水中,通过旋转蒸发仪减压蒸馏除去有机成分,将产物置于透析袋中,依次用自来水、蒸馏水和超纯水各透析24 h,冷冻干燥后备用。
1.2.2 OGE 取代度的测定
1.2.2.1 标准曲线的绘制 本试验采用的脂肪酸甲酯的气相色谱条件参考杨滢等[7]建立并验证的方法。准确称取一定量的硬脂酸甲酯标品溶解于正庚烷中,分别配制成质量浓度为3.20,1.60,0.80,0.40,0.20,0.10,0.05 mg/mL 的样液,利用气相色谱仪进样测定。记录出峰时间和峰面积,以出峰面积为纵坐标,硬脂酸甲酯的质量浓度(mg/mL)为横坐标绘制硬脂酸甲酯的标准曲线[8]。
色谱条件:CP-Sil88 型毛细管柱(100 m×0.25 mm×0.39 mm,0.20 μm,Varian Inc,USA),FID 检测器,检测器温度250 ℃,进样口温度250 ℃。
1.2.2.2 样品的取代度测定 取代度测定参照陈芳[9]的研究方法,称取一定量的OGE 于具塞试管中,加入0.50 mL DMSO 后使其完全溶解,加入1 mL 4 mg/mL 现配的甲醇钠甲醇溶液,置于80 ℃恒温水浴锅中密闭加热1 h,取出反应液。待反应液完全冷却后加入1 mL 正庚烷和1 mL 饱和氯化钠溶液,静置分层。取上层清液过0.22 μm 膜,利用气相色谱仪测定样品中硬脂酸甲酯的含量,进而计算出样品的取代度。取代度(DS)按公式(1)计算。
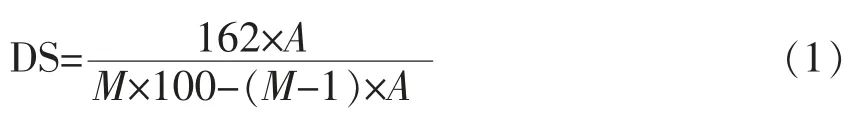
式中,A——酰基含量 (%);M——酰基的分子质量。
1.2.3 单因素试验设计
1.2.3.1 硬脂酸酰基咪唑活化液添加量对取代度的影响 在硬脂酸活化液的添加量分别为2.50,3.50,4.50,5.50,6.50 mL 时,固定条件:反应温度70 ℃,反应时间4.0 h。
1.2.3.2 反应温度对取代度的影响 在反应温度分别为70,80,90,100 ℃时,固定条件:硬脂酸活化液添加量4.50 mL,反应时间4 h。
1.2.3.3 反应时间对取代度的影响 在反应时间分别为3.0,3.5,4.0,4.5,5.0 h 时,固定条件:硬脂酸活化液添加量4.50 mL,反应温度70 ℃。
1.2.4 正交试验设计 在上述单因素试验的基础上,采用3 因素3 水平设计正交试验,以取代度的高低为基准探究OGE 的最佳制备条件。前期单因素试验结果作为参考,硬脂酸活化液添加量(A)选取4.50,5.50,6.50 mL;反应温度(B)选择70,80,90 ℃;反应时间(C)选择4.0,4.5,5.0 h,探讨正交设计下各试验取代度的值,确定OGE 的最佳制备条件。
1.2.5 OGE 的物理特性表征
1.2.5.1 扫描电镜外观形态分析 取少量冻干样品于样品台上,置于离子溅射仪中镀一层导电金膜,利用扫描电镜观察OGE 的外观形态,与燕麦β-葡聚糖的电镜图对比,在合适倍数下拍照记录[10]。
1.2.5.2 粒径大小分析 称取不同取代度的OGE 1.80 mg 于3 mL 超纯水中,加热至沸使其完全溶解,冷却至室温并补齐溶液至3 mL,室温下搅拌36 h,得到OGE 的自聚集溶液。将制备好的自聚集溶液在5 600×g 下离心10 min,取上层加入比色杯中,大约装至比色杯的1/3 处,置于粒度仪中测定其粒径大小及PDI 值。每个样品重复测定3次[11],并记录其平均值。
1.2.5.3 傅里叶红外光谱图分析 称取少量的样品于真空干燥机中干燥24 h。将干燥好的样品与光谱级溴化钾以1∶100 的比例混合,充分研磨,利用压片法测其红外光谱图[12]。同时测定未经改性的燕麦β-葡聚糖的红外光谱图,进行对比,得出新出现的峰,并分析其所对应的官能团。
1.2.5.4 氢核磁共振谱图分析 将少量样品完全溶解于0.60 mL 的DMSO-d6 中,通过一维氢谱图表征,与原燕麦β-葡聚糖的氢谱图进行对比,分析出由于改性而产生的化学位移,从而确定是否改性成功。
1.2.6 OGE 的临界聚集浓度(Critical aggregation concentration,CAC) 临界聚集浓度的测定利用荧光探针法,方法参照文献[13]并稍作修改。准备称取芘标准品配制浓度为3×10-4mol/L 的芘甲醇溶液。取10 mL 的具塞试管,每管中加入3×10-4mol/L 的芘甲醇溶液20 μL 后,用氮气将溶液中的甲醇吹干。选取不同取代度的OGE,再向每管中加入10 mL 不同取代度、不同浓度(0.0002~3 mg/mL) 的OGE 溶液,此时芘的最终浓度为6×10-7mol/L,室温下避光高速搅拌5 h 后,利用荧光分光光度计测定芘的发射光谱。测定条件:激发波长330 nm,发射和激发狭缝均为5 nm,发射光谱的扫描范围350~500 nm。记录I1(374 nm) 和I3(385 nm)处的荧光强度。以OGE 浓度的对数为横坐标,I1/I3的值为纵坐标绘制散点图,并进行曲线拟合后,求两拟合曲线交点处的横坐标,换算成浓度,此时的浓度即临界聚集浓度。
1.2.7 OGE 的溶解度 称取一定取代度的OGE,配制成2.0 mg/mL 的溶液,将溶液于100 ℃下加热15 min 后取出,离心20 min(3 000×g),收集上清液烘干称重,并记录,按式(2)计算其溶解度。

1.2.8 OGE 的细胞毒性分析 从液氮罐中取出装有Raw264.7 细胞的冻存管1 支,37 ℃水浴复苏、传代、定期换液等工作。试验开始前加入新鲜DMEM 高糖培养基(含10%FBS)制成细胞悬液,1 000×g 离心5 min 后,弃上清后,加入新鲜培养液,悬浮细胞计数。将细胞浓度调成3×104个/孔的密度,以100 μL/孔接种于96 孔细胞培养板中。置于37 ℃,5%CO2培养箱中过夜,使细胞充分贴壁,弃上清后,以100 μL/孔加入不同浓度(25,50,100,200 μg/mL)的OGE 溶液至各孔中,每组设置6 个重复孔[14-15]。在37 ℃,5%CO2培养箱中培养24 h 后,加入10 μL CCK-8 液,再放入细胞培养箱中培养2 h 左右,在波长450 nm 处测定吸光值(OD 值)[16]。

式中,A1——试验孔吸光值 (OD 值);A2——对照空吸光值(OD 值);A0——空白孔吸光值(OD值)。
1.2.9 数据处理 本试验各数据采用“平均值±标准偏差”表示。利用MestReNova 软件进行NMR 图谱数据处理,SPSS Statistics 24 统计学软件进行正交试验设计及结果分析,采用单因素方差分析进行各组间指标差异比较,P<0.05 为有统计学意义。
2 结果与分析
2.1 燕麦β-葡聚糖硬脂酸酯(OGE)的制备
2.1.1 硬脂酸活化液添加量对取代度的影响 有报道称,脂肪酸酯化多糖的反应是可逆的[17]。因此,硬脂酸酰基咪唑的增加促使该酯化反应向正方向不断进行。从图1可以清晰地看出,随着硬脂酸酰基咪唑添加量不断增加,产物取代度也不断增加。推测由于随着硬脂酸酰基咪唑添加量的增加,燕麦β-葡聚糖与酰基咪唑之间的碰撞频率也随之不断增大,使得整个体系中的酯化效率相应提高[18]。继续添加硬脂酸酰基咪唑时,硬脂酸酰基咪唑与燕麦β-葡聚糖中的羟基基团发生的反应也慢慢趋于饱和,反应速率减缓,取代度的增加趋势也变得较为缓慢。
2.1.2 反应温度对取代度的影响 图2是酯化反应温度对产物取代度的变化图,其中,当反应体系的温度从70 ℃升至80 ℃时,酯化产物的取代度从0.036 增加至0.057 后,继续升高体系的反应温度,对酯化反应的影响不是很大,取代度数值变化较小,并趋于平缓。可能由于温度升高,大分子链的活性也相应增强,促使反应体系中分子间的有效碰撞次数增加,取代度随之发生变化[19]。当反应体系中参与反应的分子达到饱和时,有效碰撞的次数不再增加,取代度的变化也趋于稳定。
2.1.3 反应时间对取代度的影响 根据酯化反应的理论分析结果,酯化反应会随着时间的延长逐渐达到一个极限值[20]。如图3所示,随着酯化反应时间的持续延长,取代度相应升高,燕麦β-葡聚糖的酯化反应也越充分。酯化反应在4.5 h 前,由于体系中生成的OGE 浓度较低,使得体系中的酯化反应能够持续进行。而当整个体系在反应进行到5.0 h 时,产物的取代度增长幅度变得缓慢,此时反应体系中的酯化反应与分解反应即将平衡。因此,反应时间并不能无限延长下去。
2.1.4 OGE 制备条件的优化 利用SPSS Statistics 24 软件进行正交试验设计,采用3 因素3 水平进一步研究硬脂酸活化液添加量(A)、反应温度(B)和反应时间(C)对OGE 取代度的影响,确定出OGE 的最佳制备条件。
从表1中可以清楚的得到此反应中OGE 的最佳制备条件,即当硬脂酸酰基咪唑添加量为6.50 mL,反应温度为90 ℃,反应时间为5.0 h 时,有最大取代度,为0.133。
2.2 OGE 的外观形态及粒径

图1 酸活化液添加量与取代度的关系Fig.1 The relationship between the amount of acid activator and degree of substitution

图2 反应温度与取代度的关系Fig.2 The relationship between reaction temperature and degree of substitution
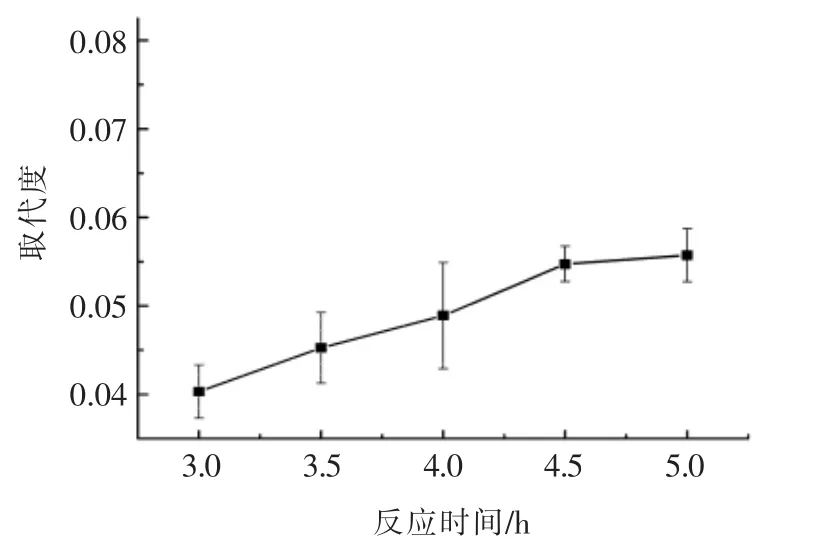
图3 反应时间与取代度的关系Fig.3 The relationship between reaction time and the degree of substitution
分别配制1 mg/mL 的燕麦多糖溶液和同质量浓度的OGE 溶液作对比可以看出,OGE 溶液更为浑浊,且上层有很多泡沫存在,而燕麦多糖溶液则清澈,且几乎无泡沫存在。推测是由于在原燕麦β-葡聚糖中接入了硬脂酸,硬脂酸本身具备乳化、稳定及润滑作用有可能也带入到OGE 中,使得OGE 液体上方出现诸多泡沫。

表1 燕麦β-葡聚糖硬脂酸酯制备条件正交结果Table 1 Orthogonal results of preparation conditions of oat beta-glucan stearate
据相关报道,两亲性多糖在较低浓度下能够形成壳核结构的自聚集胶束,纳米胶束的外观形态大多呈球状[21]。如图5所示,OGE 在扫描电镜下可以清晰地看出其外观形态为球形,较原燕麦β-葡聚糖的粒径更小,大小更为均一。原燕麦β-葡聚糖有干瘪状的球形,而经过改性后的两亲性多糖更加饱满。
大多数两亲性多糖形成的胶束的PDI 都非常窄。PDI 值越小表示粒径分布越窄,颗粒大小越均一[22]。有研究表明,当PDI>0.7 时,代表颗粒的粒径分布较宽[23]。正如表2所示,OGE 的PDI<0.7,可认为OGE 的粒径大小较为均一,与扫描电镜呈现的表观形态一致。然而在不同取代度下,OGE 的粒径大小也存在差异,随取代度的增加,OGE 的粒径大小反而降低。可能由于OGE 本身形成的胶束体系中,不同取代度下的比表面积和表面能的差异,导致自发的粒子聚集程度不同所致[24]。疏水改性后的多糖相比较原糖来说,即取代度为0 时,粒径更小,其PDI 值也越小。
2.3 傅里叶变换红外光谱图
从图6可以清晰地看到,经过硬脂酸疏水改性后的燕麦β-葡聚糖与原燕麦β-葡聚糖的红外光谱图最大的区别在于1 738.3 cm-1处出现了新的峰。1 738.3 cm-1处新出现的峰是由于酯羰基振动产生,且从图中可以看出,峰的强度随着反应时间的延长而变强,即随着取代度的增加峰强度增加,可以证明经过硬脂酸疏水改性后的燕麦β-葡聚糖引入了酯羰基,从而验证燕麦β-葡聚糖与硬脂酸之间确实发生了酯化反应[9,25]。

图4 燕麦β-葡聚糖溶液与OGE 溶液(质量浓度均为1 mg/mL)Fig.4 Oat β-glucan solution and OGE solution (1 mg/mL)

图5 扫描电镜下的燕麦β-葡聚糖和OGE 外观形态Fig.5 The appearance of oat β-glucan and OGE under scanning electron microscope
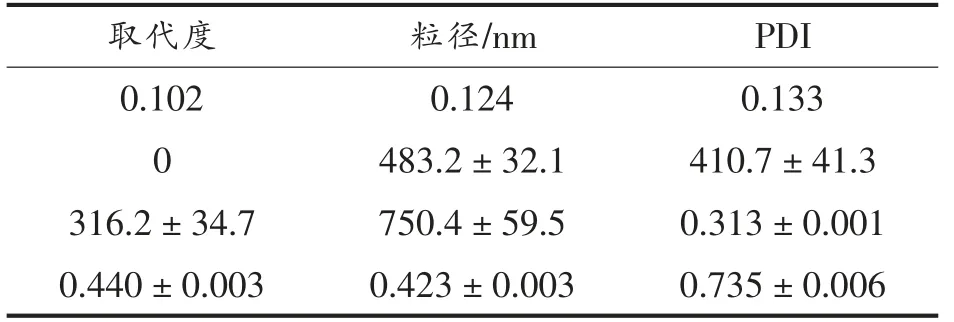
表2 取代度与胶束粒径大小Table 2 Substitution degree and micelle size

图6 不同取代度的燕麦β-葡聚糖酯与燕麦β-葡聚糖的红外光谱Fig.6 The infrared spectra of oat β-glucan ester with degree of substitution and oat β-glucan
2.4 氢核磁共振谱图
从图7可知,经过硬脂酸疏水改性后的燕麦β-葡聚糖与原燕麦β-葡聚糖的氢核磁图谱对比发现,燕麦β-葡聚糖酯的氢核磁图谱中出现4 个新峰。据相关文献报道,2.50 ppm 处为DMSO-d6的质子峰,3.31 ppm 处为水的质子峰[9,26]。其中,0.86 ppm 处的峰对应的是OGE 分子酰基链上的末端甲基的3 个氢[25];1.24 ppm 处对应于与终端甲基相连的4 个亚甲基的质子;2.33 ppm 处的峰对应酰基链上与羰基相连的亚甲基质子;1.40 ppm处出现的峰为紧随其后的亚甲基的质子[27]。由此可以得出,经过硬脂酸改性后的燕麦β-葡聚糖与原燕麦β-葡聚糖在结构上有很大区别,进一步证明了本试验中硬脂酸对燕麦β-葡聚糖的改性成功。

图7 燕麦β-葡聚糖硬脂酸酯的氢核磁表征Fig.7 Characterization of oat β-glucan stearate by hydrogen nuclear magnetic resonance
2.5 CAC 的测定结果
芘在330 nm 的激发波长下荧光光谱中会出现4 个振动峰,分别为I1(374 nm)、I2(380 nm)、I3(385 nm)和I4(394 nm)[27]。当聚合物的浓度较低时,其只以单链形式存在,荧光强度不发生变化,然而当浓度高于CAC 时,芘分子会进入到疏水内核并强烈发射,导致荧光强度增加,形成胶束[1]。I1/I3值的大小反映出溶液的极性大小,即数值越小,对应其极性也越小。当I1/I3的值出现急剧下降时,可以认为芘由水中逐渐转移至自聚集纳米颗粒的疏水内壳中,意味着自聚集体的正式形成[1,28-29]。在图8中可以发现,OGE 的DS 与CAC 成负相关,即随OGE 取代度的增加,临界胶束浓度越小。当DS=0.057,测得其CAC 为0.059 mg/mL;当DS=0.082 时,其CAC 为0.039 mg/mL;当DS=0.133时,其CAC 降至0.017 mg/mL。与文献[2]报道的两亲性多糖在低浓度下即可形成自聚集胶束的结论一致。
2.6 OGE 的溶解度
如表3所示,OGE 的溶解度较原燕麦β-葡聚糖的溶解度有不同程度的降低。随着OGE 取代度的增加,溶解度迅速下降。产生这种现象的主要原因是引入了硬脂酸这种疏水基团,取代度越高,引入的疏水集团越多,其溶解度相应越低。

图8 不同取代度的OGE 的临界聚集浓度Fig.8 The critical aggregation concentration of OGE with different degrees of substitution
2.7 OGE 的细胞毒性
当OGE 作用于正常的Raw264.7 细胞时,可以看出不同取代度下的OGE 质量浓度高低对Raw264.7 细胞有着不同的作用效果。总体来看,当OGE 质量浓度为200 μg/mL 时,细胞活力有所下降,然而均保留了99%以上的细胞存活率,可以认为在此质量浓度(20~200 μg/mL)范围内,改性后的两亲性多糖对细胞并无毒性。随着取代度的不断升高,对Raw264.7 细胞的活力也呈增强作用。分析图9可知,当OGE 质量浓度为100 μg/mL 时,不同取代度下的两亲性多糖对细胞活力均具有最好的作用效果。当取代度为0.057 时,与不加OGE 的细胞活力相比,质量浓度为50 μg/mL的OGE 可显著促进Raw264.7 细胞的增殖 (P<0.01),当OGE 质量浓度增加至100 μg/mL 时,对Raw264.7 细胞活力仍存在显著促进作用 (P<0.05);取代度为0.088 时,质量浓度为50 μg/mL和100 μg/mL 的OGE 均可显著促进Raw264.7 细胞的增殖(P<0.05);当取代度为0.102 时,OGE 质量浓度为25,50,100 μg/mL 时,对正常Raw264.7细胞的生长都具有极显著地促进作用(P<0.01)。

表3 不同取代度的OGE 的溶解度Table 3 Solubility of OGE with different degrees of substitution

图9 不同取代度的两亲性多糖对Raw264.7细胞活力的影响Fig.9 Effects of amphiphilic polysaccharides with different degrees of substitution on the viability of Raw264.7 cells
3 讨论
本文利用饱和脂肪酸硬脂酸对燕麦β-葡聚糖进行酯化改性后,通过OGE 的红外光谱图和氢核磁结构表征图能够得出改性后的两亲性燕麦β-葡聚糖与原糖结构具有一定区别,进一步证明试验中两亲性燕麦β-葡聚糖酯的成功制备。通过对制备条件的优化,得出当硬脂酸活化液添加量为6.50 mL、反应温度为90℃且酯化反应时间为5.0 h 时有最大取代度,可达0.133。OGE 能够在较低质量浓度之下形成胶束,且溶解度随取代度的增加而明显降低。在用改性后的两亲性燕麦β-葡聚糖在较低浓度下作用于正常Raw264.7 细胞时,细胞存活力均在99%以上,可以认为制备的OGE 在一定浓度范围内无细胞毒性。
有学者指出,两亲性多糖由于疏水性嵌段的存在,能够有效地荷载某些敏感性生物活性材料,防止这些物质快速崩解,使它们在到达目标位置时更加有效的释放[30]。本试验中两亲性多糖材料易得,且制备过程较为简单,对正常细胞不具有毒性,有望在荷载疏水性活性物质或者食品相关领域成为具有应用价值的载体,提高疏水性生物活性材料等的生物利用率。

