贪铜菌利用混合餐厨废油合成聚羟基丁酸酯
潘兰佳 李杰 林清怀 汪印
(1. 厦门产业技术研究院,厦门 361000;2. 中国科学院城市环境研究所 中国科学院城市污染物转化重点实验室,厦门 361021)
石油基塑料以其低廉的价格和优异的性能被广泛应用于医药、农业、工业等领域。然而,废弃塑料难降解,富含有毒有害成分,其大量堆积不仅影响环境美观,还易使土壤环境恶化,焚烧处理则会导致有毒气体排放,造成二次污染。因此,寻找可降解塑料以取代传统的石油基塑料已迫在眉睫。聚羟基脂肪酸酯(Polyhydroxyalkanoates,PHAs)是由微生物在碳源过剩和某些必需营养元素限制的条件下合成的一系列生物聚酯[1]。PHAs具有与聚丙烯塑料相似的材料学性质,如热塑性、弹性等,同时其独特的生物相容性和可降解性引起了广泛关注。这些聚合物在好氧条件下可被微生物降解为H2O和CO2,从而避免了在环境中的长期积累[2]。目前,PHAs的扩大生产主要瓶颈之一是成本较高,研究发现以有机废弃物作为微生物碳源可有效降低其生产成本[3-4]。
油脂是食物烹饪的重要组成部分。据估计,到2020年,我国食用油消费将呈指数增长,餐厨废油总量将超过10×107t。餐厨废油中含有铅、镉、砷等重金属及致癌物黄曲霉毒素等[5],如果处理不当,有害物质流入生态系统,不仅造成环境污染,还会危及人类健康。油脂的主要成分有脂肪酸、甘油、维生素等,可作为微生物的碳源。利用废油合成生物塑料不但可以解决废油处理不当造成的问题,而且有益于环境的可持续发展。
近年来,已有不少研究报道利用不同的单一油脂生物合成 PHAs,如菜籽油[6-8]、大豆油[9-11]、棕 榈 油[12]等。 贪 铜 菌(Cupriavidus necator,C.necator)是利用脂质类底物生产PHAs的常用菌株,Obruca等[7]以废弃菜籽油为底物,利用C.necator H16生产聚羟基丁酸酯(Polyhydroxybutyrate,PHB),通过连续培养,72 h 之后PHB产量可达105 g/L;Verlinden等[13]利用 C. necator以煎炸废油为底物生产PHA,72 h产量为1.2 g/L。种宇轩等[14]以煎炸废油作为发酵过程中的碳源,对C. necator合成PHA过程的进行了条件优化,结果在最佳条件下PHA的产量可达到6.63 g/L,占到细胞干重的约83%。以上利用油脂生物合成PHAs的研究多集中在单一组分油脂的利用上,主要是因为混合废油作为合成底物因其成份复杂而受到限制,混合餐厨废油中含有许多杂质,会影响微生物的生长,可能导致PHA产率低。因此,利用混合餐厨废油为原料制备PHAs的研究报道目前较少。
本研究以餐厨垃圾混合废油为底物,利用C.necator为发酵菌株制备PHB,通过制备条件优化,扩大实验规模,在混合餐厨废油作为单一碳源的条件下,实现C. necator对此废油的高效利用,以期为餐厨垃圾混合废油提供新的利用途径,同时为未来的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和餐厨废油来源 可合成聚羟基丁酸酯(PHB)的菌株C. necator(CGMCC 1.7092)购于中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)。餐厨废油取自厦门市东部固废中心,为餐厨垃圾处理过程中分离得到的粗油脂。餐厨废油的脂肪酸含量,如表1所示。

表1 餐厨废油的脂肪酸含量Table 1 Fatty acid content of the waste cooking oil
1.1.2 药品与培养基 PHB合成所用培养基主要 成 分 为 :(NH4)2SO4:1 g/L,KH2PO4:1 g/L,Na2HPO4·12H2O :11.1 g/L,MgSO4:0.2 g/L,1 mL微 量 元 素 液(FeCl3:9.7 g/L,CaCl2:7.8 g/L,CuSO4·5H2O:0.156 g/L,CoCl2:0.119 g/L,NiCl2:0.118 g/L,CrCl2:0.062 g/L 溶解于 0.1 mol/L HCl 中);LB培养基(胰蛋白胨:10 g/L;NaCl:5 g/L;酵母提取物:5 g/L)用于细菌培养。
1.2 方法
1.2.1 菌株C. necator合成 PHAs的种类分析 称取0.3 g冻干菌体于消解管中,加入2 mL氯仿和2 mL苯甲酸-甲醇溶液(含10% 浓硫酸),置于 100℃烘箱反应 4 h,苯甲酸作为内标。反应结束冷却后,加入1 mL 去离子水,振荡均匀,静置一夜离心分层。取下层氯仿相进行气质联机分析[14]。羟基脂肪酸与甲醇在浓硫酸的催化下生成羟基脂肪酸甲酯,因此通过气相色谱串联质谱仪检测出的为羟基脂肪酸甲酯,以此来得出PHAs的种类。
1.2.2 PHB合成条件优化 培养温度:50 mL的无机盐培养基(pH7.5)中含油量4%,并接种4%的菌悬液,置于转速为200 r/min的摇床培养,摇床温度分别设定为20、25、30和35℃,72 h后取样测定菌体干重和PHB含量。
培养基初始pH值:50 mL的无机盐培养基中含油量4%,并用酸碱调节培养基初始的pH值分别为6.0、6.5、7.0、7.5和8.0,并接种4%的菌悬液,置于转速为200 r/min的摇床培养,摇床温度设定为之前测定的最适温度,72 h后取样测定菌体干重和PHB含量。
摇床转速:50 mL的无机盐培养基中含油量4%,培养基初始pH值调节至上一步测定的最适pH值,摇床温度设定为最适温度。分别设置摇床转速为100、150、200和250 r/min。培养基中接种4%的菌悬液,72 h后取样测定菌体干重和PHB含量。
餐厨废油添加量:50 mL的无机盐培养基,培养基初始pH值、摇床温度和转速都设定为之前测定的最佳值。分别在培养基中添加不同比例的餐厨废油,包括1%、2%、3%、4%和5%。培养基中接种4%的菌悬液,72 h后取样测定菌体干重和PHB含量。
菌株接种量:50 mL的无机盐培养基,培养基初始pH值、摇床温度、转速以及餐厨废油添加量都设定为之前测定的最佳值。在培养基中接种不同量的菌株(OD600=2.0),包括1%、2%、3%、4%、5%和6%。72 h后取样测定菌体干重和PHB含量。
培养时间:50 mL的无机盐培养基,培养基初始pH值、摇床温度、转速、餐厨废油添加量和接种量都设定为之前测定的最佳值。共设置6组实验,每一组分别在不同时间点(12、24、48、72、96和120 h)取出摇床。测定菌体干重和PHB含量。
1.2.3 菌株C. necator 发酵培养 微生物发酵是利用微生物的特殊代谢途径,把原料转化为目标产物的生物学过程。不同的发酵方法会导致发酵产量的不同,甚至是产物种类的变化。以下通过3种不同的发酵模式,探究提高PHB产量的方法。
模式一(分批发酵):利用5 L的发酵装置,培养基装液量为3.5 L。自动控制发酵温度在25℃,搅拌速率为150 r/min,自动调节酸碱值在pH 7.0。接种量和餐厨废油添加量为3%。发酵期间利用空气压缩机向发酵罐中通入无菌空气,气体通入量为2 L/min。96 h后取样测定菌体干重和PHB含量。
模式二:基本方法同模式一,但在发酵2 d后加入无菌餐厨废油(22.3 g/L)。96 h后取样测定菌体干重和PHB含量。此模式的主要目的是补充前期已转化的餐厨废油,探明中途添加废油是否能够提高PHB产量。
模式三(补料分批发酵):初始无机盐培养基1.5 L,接种量和餐厨废油量为3%,运行24 h后,向发酵罐中补充1 L新鲜培养基(培养基中的(NH4)2SO4和Na2HPO4·2H2O的浓度减半,以达到氮磷限制的目的),继续运行24 h,再次补料。96 h后取样测定菌体干重和PHB含量。此模式的主要目的是通过新鲜营养液的加入,补充前期发酵造成的营养流失,并通过氮磷限制的方法探究其对PHB合成效率的影响。
1.2.4 分析方法
1.2.4.1 菌体干重分析 5 mL培养液与等体积的正己烷混合,离心15 min(8 000 r/min),收集菌体,并用正己烷和去离子水各洗涤一次后,冷冻干燥后称重,计算得出菌体干重[15]。
1.2.4.2 PHB的提取 取一定量的干菌体于100 mL三角瓶中,加入次氯酸钠溶液和氯仿(1∶3),置于30℃,200 r/min摇床。90 min后离心20 min(9 000 r/min),取下层氯仿相,加入2 mL去离子水震荡,再次离心20 min(9 000 r/min)后,取下层氯仿相,倒于已知重量的9 cm的培养皿中,培养皿置于通风橱,待氯仿蒸干后称重获得PHB[16]。
1.2.4.3 PHB分子量分布和热力学性质分析 热重分析:称取10 mg PHB放置在热重天平小坩埚中。热重实验使用氮气作为吹扫气,流速设定为 60 mL/min;氮气作为反应气,流速设定为20 mL/min。升温程序为:以 20℃/min的升温速率从40℃升至600℃,结束。
差示扫描量热分析(Differential scanning calorimetry,DSC)利用差热扫描量热仪(TA,美国)在-90℃-200℃的温度范围内进行测量,加热和冷却速率为10℃/min。高纯氮以50 mL /min的速度通入,基线以空铝锅为基准进行校准[17]。
分子量分布:采用凝胶渗透色谱(Waters,美国)测试。将聚合物样品溶解于氯仿样品中,然后使用孔径为0.2 μm的聚四氟乙烯过滤器对溶液进行过滤,上机检测。洗脱条件为30℃,流速为1mL/min,以氯仿为流动相[18]。
1.2.5 数据分析 采用IBM SPSS统计软件(20.0)对数据进行单因素方差分析(LSD多重比较检验),P< 0.05时视为差异显著。利用Origin 8.5软件绘图。
2 结果
2.1 菌株C. necator合成 PHAs的种类分析
菌株C. necator 利用混合餐厨废油合成PHA后的菌体,在酸性、高温条件下进行甲酯化,以获得羟基脂肪酸甲酯。通过气相色谱-质谱检测,并与物质库中的标准物质比对,可以发现其检测到的物质主要为3-羟基丁酸甲酯(图1),说明菌株C.necator合成的产物主要是短链脂肪酸酯—聚羟基丁酸酯(PHB)。将该物质与PHB标准品消解后样品利用气相色谱-质谱检测后得到了相同的图谱,进一步证实了菌株C. necator 利用混合餐厨废油合成的PHA的主要主要组成是PHB。

图1 PHA甲酯化产物气相色谱质谱鉴定图Fig. 1 Identification of methylated products of PHA by gas chromatography-mass spectrometry
2.2 菌株C. necator合成PHB的最适条件
2.2.1 温度对菌株生长和PHB合成的影响 培养温度对菌株C. necator的生长及PHB合成的影响如图2所示。在20和25℃时,菌体的生长量随着温度变化有略微的增加,但是无明显差异(P > 0.05)。随着温度升高,所得到的菌体细胞干重急剧减少(P <0.05),35℃时得到的细胞干重仅不到2 g/L,PHB的占比逐渐下降到20%左右(P < 0.05)。PHB在细菌细胞内的占比表现出与菌体生长量相似的趋势,在25℃时达到最大值,为78%。因此,结合菌体的生长量和PHB在菌体内所占比重,最终确定25℃作为菌株C. necator合成 PHB的最适温度。

图2 温度对菌株C. necator细胞干重和PHB合成的影响Fig. 2 Effect of temperature on the cell dry weight of strain C. necator and PHB synthesis
2.2.2 培养基初始pH值对菌株生长和PHB合成的影响 在最适的培养温度(35℃)基础上,本研究继续探索pH值对C. necator合成PHB的影响。如图3所示,不同的初始pH值对菌体的生长和PHB的合成有一定的影响。过高或过低的pH值对菌株生长和PHB在细胞内的占比表现出明显的抑制作用。培养基初始pH值为7.0时,菌株C. necator的生长最佳,可达8.0 g/L。另外,PHB在菌株细胞内的占比与生长的趋势一致,随着pH值的升高,先增加后降低,同样在pH值为7.0时,达到最大值79%。综上所述,得到优化的pH值为7.0。

图3 pH对菌株C. necator细胞干重和PHB合成的影响Fig.3 Effect of pH on the cell dry weight of strain C.necator and PHB synthesis
2.2.3 摇床转速对菌株生长和PHB合成的影响 基于优化的温度(35℃)和pH值(7.0),进一步研究摇床转速(100 r/min-250 r/min)对菌株生长和PHB合成的影响。如图4所示,摇床转速为100 r/min时得到的菌体细胞干重最低,转速从100升高至150 r/min时,菌体产量和PHB占比均显著升高(P <0.05)。转速在150 r/min-250 r/min的范围内菌体细胞干重无显著差异(P >0.05)。在PHB合成方面,摇床转速为150和200 r/min时,PHB的合成量无显著差异(P >0.05),并且随着转速的增加,无明显变化。因此,选择转速150 r/min为最佳培养转速,可在一定程度上减少能耗,节约生产成本。
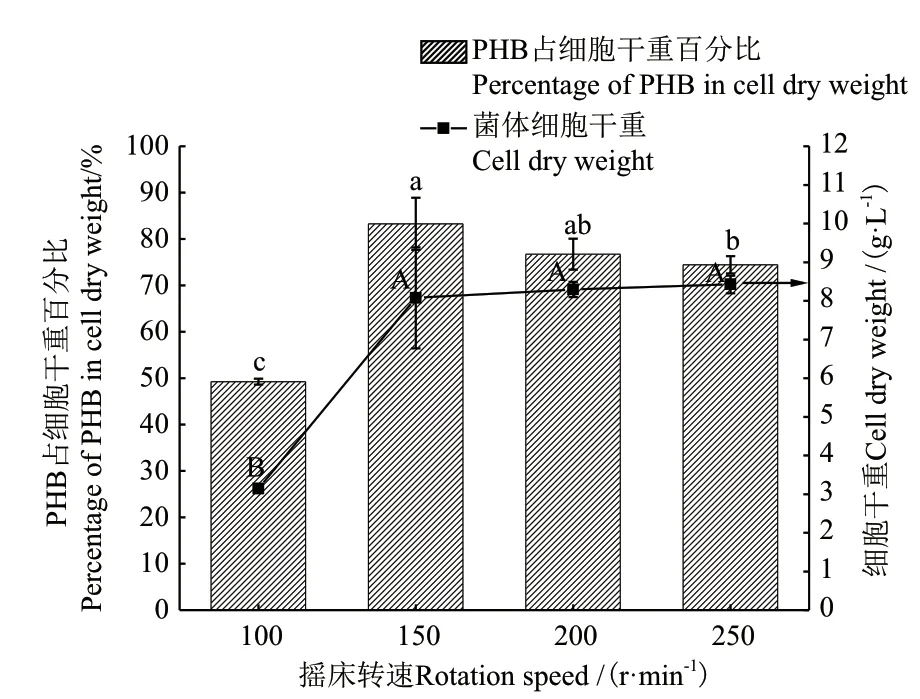
图4 摇床转速对菌株C. necator 细胞干重和PHB合成的影响Fig.4 Effect of rotation speed on the cell dry weight of strain C. necator and PHB synthesis
2.2.4 餐厨废油添加量对菌株生长和PHB合成的影响 本研究中,培养基初始pH值调节至中性,温度和摇床转速分别控制在30℃和150 r/min,继续探究了餐厨废油添加量分别为1%、2%、3%、4%和5%时菌株的生长和PHB合成情况。结果如图5所示,不同餐厨废油添加量对菌体合成PHB的影响不大,胞内PHB含量均在细胞干重的75%左右。但对菌体细胞干重有一定的影响,当废油添加量在3%时,菌体细胞干重达到最大值(8.7 g/L),随着废油添加量的增加,菌体细胞干重与废油添加量在3%时无显著差异(P>0.05)。因此,从节约底物和利用效率方面考虑,培养时选取废油添加量3%为佳。

图5 餐厨废油添加量对菌株C. necator 细胞干重和PHB合成的影响Fig.5 Effect of waste cooking oil amount on the cell dry weight of strain C. necator and PHB synthesis
2.2.5 接种量对菌株生长和PHB合成的影响 在之前所获得的最佳条件下(30℃,150 r/min,pH 7.0,3%餐厨废油添加量),继续探究了接种量分别为1%、2%、3%、4%、5%和6%对菌株生长和PHB合成的影响。结果显示(图6),不同的接种量对菌株生长与PHB的合成的影响不显著(P>0.05)。接种量为6%时,虽然PHB的合成量占细胞干重的比例最大,但菌株的生长相对较低,最后将导致总PHB的合成量相对略有减少。因此,从合成PHB的总量的角度分析,接种量为3%时,获得的PHB总量最大。

图6 接种量对菌株C. necator细胞干重和PHB合成的影响Fig.6 Effect of inoculum amount on the cell dry weight of strain C. necator and PHB synthesis
2.2.6 菌株C. necator生长和PHB合成随时间的变化 在上述所有优化条件的基础上,研究了菌株C.necator以餐厨废油为单一碳源时,随着培养时间(0-120 h)的变化,菌体生长和PHB合成情况。从图7可以看出,菌株在前48 h 迅速生长(P<0.05),之后逐渐呈现缓慢生长的趋势。菌体干重在96 h达到比较高的数值(9.5 g/L),与120 h的菌体干重无显著差异(P>0.05)。PHB在菌体细胞内的占比也是随时间逐渐增加,12 h时PHB占菌体细胞干重的百分比仅为40%,48 h后增加至75%以上,随后增幅减弱并在96 h之后保持稳定,菌体占比维持在80%左右。

图7 培养时间对菌株C. necator细胞干重和PHB合成的影响Fig.7 Effect of culture time on the cell dry weight of strain C. necator and PHB synthesis
2.3 菌株C. necator发酵合成PHB
为了进一步放大实验规模,为今后的产业化打下基础,本研究继续开展了发酵罐容量为5 L的发酵实验,以提高PHB的总体产量。发酵培养的条件基本按照摇瓶培养所优化的条件进行。温度为25℃,搅拌速率为150 r/min,利用硫酸和氢氧化钠溶液作为酸碱调节剂自动调节酸碱值在pH 7.0。接种量和餐厨废油添加量为3%。各培养模式的实验结果如表2所示。模式一进行96 h后菌体干重达到10.75 g/L左右,所获的PHB占菌体干重的比例为76.75%左右,PHB产量为8.25 g/L。模式二在48 h时加入了一定量的餐厨废油,最终导致餐厨废油残留量较大,菌体干重相比于模式一有所降低(7.62 g/L),PHB占菌体干重的比例较高,到达86.88%,但总的PHB产量低于模式一。模式三初始的发酵体积为1 L,通过两次的补料最终体积为3 L。两次补料都限制了氮磷的添加,96 h后PHB占菌体干重的比例达到82.06 %,但菌体干重较前两种模式低,仅有6.79 g/L。另外,对于产量较高的模式一进行了连续4次的出料补料实验,结果如表3所示。实验中菌体干重在10 g/L-12 g/L左右,所获的PHB占菌体干重的比例均在76%左右,实验过程产出稳定,实验连续性较好。
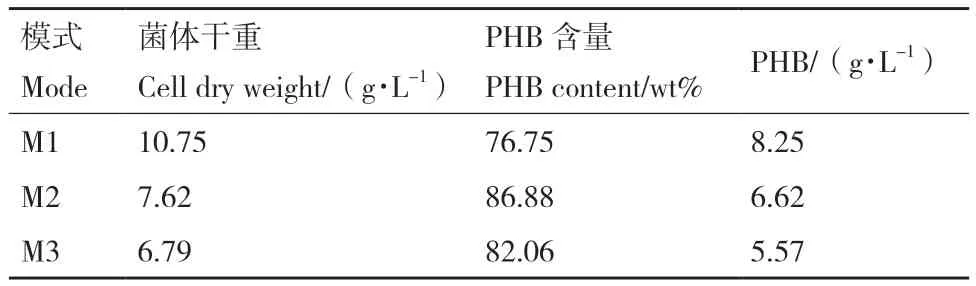
表2 不同发酵模式下菌体和PHB产量Table 2 Bacterial cell and PHB production under different fermentation modes
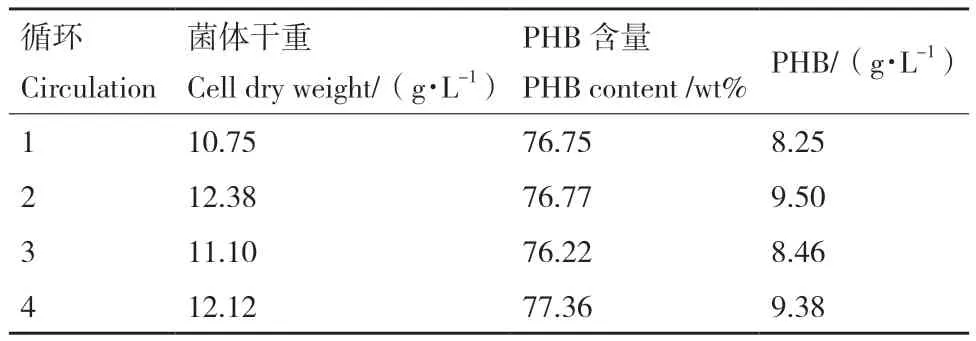
表3 模式一发酵培养实验结果Table 3 Experiment results of fermentation model 1
2.4 PHB性质分析
2.4.1 PHB分子量分布 菌株C. necator利用餐厨废油合成的聚合物是3-羟基丁酸酯均聚物,该聚合物的分子量分布采用凝胶渗透色谱检测,结果如表4所示。菌株C. necator利用餐厨废油合成的PHB的数均分子量(Mn)、重均分子量(Mw)分别为20和30 kD,分散性指数(PDI)为1.44。说明该聚合物分子量不大,但是均一性较好。
2.4.2 PHB热性能分析 PHB的DSC测量的温度范围为-90℃-200℃,检测结果见表4和图8-A。样品熔化的峰值在175.7℃。DSC图谱中,在0-10℃有出现极弱的小峰,猜测是该过程的玻璃转化点,但由于现象不明显,故不可完全判断出该聚合物的玻璃转化温度。其融化温度为175.7℃,结晶温度为71.9℃。PHB的热重分析(TG)是将样品以20℃/min的升温速率从40℃升至600℃,观察其质量随温度的变化情况。如图8-B所示,该聚合物热分解发生在285.5℃,310℃左右被完全分解。

表4 细菌合成PHB的分子量分布和热力学性质Table 4 Molecular weight distribution and thermodynamic properties of PHB synthesized by bacteria

图8 差示扫描量热分析(A)和热重分析(B)结果图Fig.8 Differential scanning calorimetry analysis (A) and thermogravimetric analysis (B)
3 讨论
由上述结果分析的得出,温度和培养基pH值是影响微生物生长繁殖的重要环境因素。温度和pH值的变化不仅改变微生物细胞膜的通透性,还对胞内酶的活性产生影响,从而影响微生物细胞内一系列的生化反应[21]。在适宜的环境条件下培养,才能实现微生物的生长和功能的最大化。目前,除了嗜热菌种的PHAs合成实验以外,菌株发酵合成PHAs的实验普遍将温度控制在30℃左右。任连海等[22]选用 C. necator(DSM428)作为实验菌株,利用地沟油作为细菌生长的碳源,发现其在30℃下细菌生长和PHAs含量都达到最大值。种宇轩等[14]研究了C. necator利用煎炸废油合成PHAs的最佳条件,其在28℃时PHAs产量达到最大。由此可以分析,贪铜菌C. necator合成PHAs的最佳温度范围在25-30℃,与本研究的实验结果基本一致。另外,大多数细菌的最适pH值在6.5-7.5之间,在利用油脂合成PHA的实验中,多将pH值控制在中性条件下[23]。然而,种宇轩等[14]研究的C. necator利用煎炸废油合成PHB的最适pH值是7.5;任连海等[22]发现C.necator(DSM428)利用地沟油合成PHA的最佳pH条件为8.0。以上两研究与本研究的差别可能是因为不同的废油脂本身的性质以及废油添加量导致的菌株在细胞生理活性上有略微的差异。
除了温度和pH值两个极其重要的因素以外,摇床转数、废油添加量、发酵时间对菌体的生长和PHB的合成也有一定的影响。摇床转速的变化主要是改变培养基的溶氧量。一般来说,溶氧量和摇床的转速成正比[21]。转速较慢,溶氧较低,菌体与营养物接触不充分,会出现生长滞后,使得菌体的生长和PHB的合成受到限制;摇床转速过高,溶氧过剩,对菌株生长影响不大,但对其发酵代谢过程可能有一定的抑制作用。废油添加量和接种量的变化可能对发酵的过程影响不大。废油添加量过低,会使营养物质不足,导致菌株生长较弱;过多的油脂会促使菌体产生大量的酸性中间产物,从而改变过程中的pH值,抑制菌株的进一步生长[14]。但是,发酵培养过程中是实时调节发酵液酸碱性,废油添加量增加会导致发酵液的碳氮比(C/N)增加,可能有利于PHB的积累。在培养初期,菌株先利用底物进行繁殖生长,后期在合适的条件下累积PHB。因此,实验初期,菌体增长快,PHB含量少。随着时间增加,细菌生长减缓,PHB 逐渐合成,并积累在菌体细胞内。到后期菌株衰退,培养液中有害物质增加,PHB有可能被消耗而导致略微有所减少。
发酵是借助微生物在有氧或无氧条件下的生命活动来制备微生物菌体本身、直接代谢产物或次级代谢产物的过程。模式一为分批发酵实验,在发酵的96 h内仅控制发酵罐的温度和pH值,并未进行其它物质的添加,菌株在发酵罐内有较好的生长环境和状态。但由于搅拌速率仅为150 r/min,后期发酵液变浓稠后氧气难以进入可能导致后期溶解氧不足,在一定程度上抑制了菌体的生长,且不利于PHB的合成。模式二改变了分批发酵的固有模式,中途添加了一定量的餐厨废油,由于发酵液碳氮比的极速增大,促进了PHB的合成[1],因此在模式二中PHB的含量最高。但过多的混合餐厨废油向培养基中引入更多的有毒物质,在一定程度上会限制菌体的生长,导致PHB的整体产量较低。模式三为补料分批发酵,在发酵过程中间歇补加了新鲜的培养液。由于氮磷限制,PHB的合成效率相对于模式一有一定的提升,但营养不足导致菌体的生长量较低,同样导致最终PHB的产量较低。综上分析,利用C.necator发酵培养可通过改进的分批培养法,一次性加入过多的废油不利于发酵的进行。因此,中途可间歇性添加废油,提高培养液碳氮比,促进PHB积累的同时可减少对菌体生长的抑制。Ng等[24]利用C.necator H16以麻疯果油为碳源合成PHB。普通摇瓶培养下,48 h菌体的细胞干为3.3 g/L-8.2 g/L,PHB在细胞内的含量为74%-87%。当进行补料流加培养时,48 h菌体的细胞干重可达65.2 g/L,PHB在细胞内的含量仍然较高,为76%。Cruz等[25]通过溶氧反馈补料发酵法,利用C. necator DSM 428以食堂烹饪废油为碳源合成PHB,96 h菌体干重可达27.2 g/L,PHB产量为19.8 g/L。这些高产的补料策略将来也可用于C. necator以餐厨废油为碳源合成PHB实验。另外,适当提高搅拌速率,有利于溶解氧的增加,促进PHB合成,但同时需要注意气泡的产生和逃液的现象。
菌株C. necator利用餐厨废油合成的聚合物为PHB,该结果与文献报道的使用同种菌株的利用葵花籽油[2]、咖啡渣废油[26]、菜籽油[7]和煎炸废油[27]等含油底物的合成的均聚物类型一致。PHAs的分子量具有多样性,可从几万到上千万道尔顿不等[28-29]。不同的PHAs分子量是由微生物类型、生长条件和提取方法等多个因素造成的[18]。本研究中合成的PHB分子量较低,一方面可能与所用的餐厨废油有关;另一方面主要是由于提取方法中所用的次氯酸钠对该聚合物具有降解作用所导致[30]。另外,PHAs的PDI在1.2-3.0的范围[17],PDI越大,分子量分布越宽,PDI越小,分子量分布越均匀,既体现了聚合物的均匀性。利用餐厨废油合成的PHB的PDI为1.44,较低于已有报道的结果,说明该聚合物具有较好的均一性。关于PHB的热分解性能,根据DSC和TG分析,该PHB熔融温度为175.7℃,与文献报道一致[20]。其热分解发生在285.5℃,310℃左右被完全分解。据报道,PHAs在200℃以上开始不稳定,并断链分解[21]。然而本研究制备的PHB的分解温度相对较高的,体现出更好的抗热特性。较高的分解温度是有利的特征,为之后塑料制品的成型、加工提供了一个更广泛的温度范围,并且能够在热塑的过程中减少分解,保持较好的机械性能[31]。
4 结论
通过单因素实验获得菌株利用混合餐厨废油合成PHB的最佳条件为30℃,150 r/min,pH 7.0,3%餐厨废油添加量和接种量。在该条件下,C. necator的生长量与 PHB 合成量均达到最大值,分别为9.5 g/L和7.6 g/L。考虑到发酵效率和能耗问题,最佳培养时间为96 h。
在最适条件下进行的发酵合成PHB的放大实验,以模式一的培养方式生产的PHB最多,96 h产量可达8.25 g/L。
菌株C. necator利用餐厨废油合成的聚合物是3-羟基丁酸酯均聚物,平均分子量为30 kD,分散性指数(PDI)为1.44。PHB的熔融温度为175.7℃,分解温度为285.5℃,与文献中报道的PHB热力学性质相似,基本可以满足热塑性材料的需求。