乌拉尔甘草CBL基因家族的鉴定与表达分析
高玲 王斐 谢双全 陈喜凤 沈海涛 李鸿彬
(石河子大学生命科学学院,石河子 832003)
乌拉尔甘草(Glycyrrhiza uralensis)是一种重要的药用植物,对干旱、盐碱等逆境胁迫具有较强的耐受性[1]。
次生代谢物质是甘草的主要药用成分,其含量与甘草的生长环境紧密相关。研究表明,适度的干旱胁迫能够促进甘草中甘草苷、甘草酸等有效成分的积累[2];盐胁迫能够通过抑制初生代谢和促进次生代谢,使得甘草酸和甘草苷相对含量增加[3];甘草根中甘草苷、甘草酸铵和甘草次酸的含量在增强UV-B辐射下有显著升高的趋势[4];适当浓度的赤霉素GA3和茉莉酸甲酯MeJA处理能够显著促进甘草有效成分的积累及其生物合成途径相关基因的表达[5-6]。
植物钙调磷酸酶B类蛋白CBL是一类重要的Ca2+传递类传感蛋白。CBL蛋白具有保守的4个EF结构域,与钙离子结合后,通过与下游蛋白CIPK(CBL-interaction protein kinase)相互作用介导钙信号向下游传递,参与植物生长发育调控及应对外界各种逆境信号的转导[7-8]。目前已从拟南芥、水稻和杨树基因组中分别鉴定得到10个CBL基因[9],此外,在高粱(6个)、葡萄(8个)、苔藓(4个)及蕨类(4个)等不同植物中均有关于CBL成员的报道[10]。植物CBL基因在调节植物生长发育中发挥重要功能。拟南芥AtCBL1在高盐、干旱、低温和伤害等非生物胁迫下被诱导表达[11-13]。AtCBL2和AtCBL3不同程度的受光诱导表达[14]。低钾胁迫下,拟南芥CBL1/CBL9通过与CIPK23作用调控质膜上钾离子通道蛋白AKT1的活性[15];玉米ZmCBL4显著提高转基因拟南芥的耐盐性[16];陆地棉GhCBL2和GhCBL3在调节棉纤维的伸长方面发挥重要作用[17]。乌拉尔甘草非生物胁迫细胞生理学研究表明适度逆境胁迫一定程度上促进了甘草药用有效成分的累积[18-24]。
目前,关于乌拉尔甘草CBL基因家族的研究未见报道。本研究利用生物信息学方法从乌拉尔甘草全基因组中鉴定得到10个GuCBL基因,并对这些基因的染色体分布、基因结构和基序、进化关系和顺式作用元件进行了系统分析,研究GuCBL的组织特异性和响应非生物胁迫的表达特征,为深入研究GuCBL在生长发育和逆境应答中的功能和调控机制奠定基础。
1 材料与方法
1.1 材料
甘草品种为野生药用乌拉尔甘草,由石河子大学甘草研究所保存。甘草种子用98% H2SO4浸泡处理25 min,无菌水冲洗3次,0.1% HgCl2消毒7 min后播种至基质盆钵内,温度为28℃白天/25℃黑夜,光照周期为16 h光照/8h/黑暗进行蛭石培养45 d。收集同一时期乌拉尔甘草根、茎和叶片组织,置于-80℃备用。选择长势一致的约45 d的乌拉尔甘草幼苗移至300 mL的水培瓶中,用1×Hoagland(去除Na+)营养液水培3 d后进行非生物胁迫处理。分别 用 300 mmol/L NaCl、10%(W/V)PEG6000、2%H2O2、4℃和42℃处理模拟盐、旱、氧化、低温和高温胁迫,收集处理后0、6、12和24 h上述处理的根部材料,-80℃保存备用。
1.2 方法
1.2.1 乌拉尔甘草CBL基因家族成员鉴定及生物信息学分析 利用拟南芥10个CBL蛋白序列及大豆12个CBL蛋白序列在乌拉尔甘草基因组中进行比对,去除重复后筛选获得乌拉尔甘草GuCBL候选基因。利用在线网站http://www.expasy.org/分析蛋白质序列的长度、分子质量和等电点等信息。利用Softberry网 站http://linux1.softberry.com/berry.phtml预测亚细胞定位。使用MEGA软件邻接法Neighbor-Joining,将乌拉尔甘草、拟南芥、大豆3个物种的CBL基因构建进化树。使用GSDS工具分析基因结构特征,使用MEME软件分析蛋白质的保守基序。使用TBtool https://github.com/CJ-Chen/TBtools软件绘制GuCBL家族成员在不同Scaffold中的位置及基因间的复制关系。使用ClustalW 2.0对复制的GuCBL的CDS序列进行比对,DnaSP 5.0软件计算非同义替换Ka、同义替换Ks以及它们之间的比值(Ka/Ks)以评估进化中的选择压力;使用Graphics工具分析并绘制乌拉尔甘草与拟南芥、大豆之间CBL基因家族成员的亲缘关系及其同源性。利用UGENE软件从基因组序列中获取GuCBL上游1 500 bp的启动子序列,使用PlantCARE软件http://bioinformatics.psb.ugent.be/webtools/plancare/html/分析存在的顺式作用元件。
1.2.2 基因表达分析 使用TIANGEN公司的RNAPREP PURE PLANT KIT试剂盒提取不同材料总RNA,使用Takara公司高容量ScriptTM RT试剂盒合成cDNA。使用Premier 5.0软件设计特异性引物(表1)。选择甘草肌动蛋白基因(GuActin,Genbank:GQ404511)作为内参基因进行归一化数据[25]。使用实时定量PCR检测GuCBL的表达情况,引物由生工生物工程上海股份有限公司合成,每个测试样品进行3次重复试验。相对表达值使用2-△△Ct法计算获得,热图使用MeV软件进行聚类分析作图。
2 结果
2.1 乌拉尔甘草CBL家族基因的鉴定
在乌拉尔甘草基因组数据库中共初步鉴定获得10个CBL成员GuCBL1-GuCBL10(表2)。在这10个GuCBL成员中,GuCBL4、GuCBL7和GuCBL10为拼接错误序列,对这些基因进行设计全长引物(表1),进行PCR扩增后获得了这3个基因的完整全长序列。最终获得了10个完整的GuCBL成员,分别定位在不同的染色体支架上(图1)。GuCBL开放阅读框的范围为642-1 008 bp,GuCBL蛋白的分子量为24.36-41.46 kD,包含氨基酸数目为213-364aa,具有的等电点范围为4.57-5.38,亚细胞定位预测显示GuCBL蛋白均定位在质膜上,GuCBL蛋白N-末端均含有棕榈酰化位点,其中,GuCBL5、GuCBL8和GuCBL9还含有豆蔻酰化位点(表2)。

图1 乌拉尔甘草GuCBL在染色体支架上的分布Fig. 1 Chromosomal scaffold distribution of GuCBL genes in G. uralensis
2.2 乌拉尔甘草GuCBL系统发育分析
为了解乌拉尔甘草CBL系统进化关系,选择与拟南芥和大豆的CBL共同构建了系统进化树。结果显示,乌拉尔甘草GuCBL可分为A、B、C、D 4个组,分别包括3个(GuCBL2、GuCBL3、GuCBL6)、1个(GuCBL5)、2个(GuCBL1和GuCBL7)和4个(Gu-CBL4、GuCBL8、GuCBL9、GuCBL10)成员(图 2)。

表2 乌拉尔甘草CBL基因家族特征分析Table 2 Characteristic analysis of G. uralensis CBL family genes
2.3 乌拉尔甘草GuCBL结构及保守基序分析
通过对内含子/外显子结构和保守基序的分析,进一步研究乌拉尔甘草CBL的结构特征。结果显示,不同组GuCBL成员显示出不同的基因结构,总体上分为与系统进化分析一致的4个组A-D(图3-a)。GuCBL包含12个保守基序(图3-b)。所有的乌拉尔甘草GuCBL都含有motif 1-motif 5,分别是4个EF-hand结构域和PFPF结构域。
为了更直观地体现GuCBL结构域的位置,对其进行了氨基酸序列比对,发现它们除了在N端变化较大外,其他区域都相对比较保守。乌拉尔甘草GuCBL的氨基酸序列都含有4个EF手型结构(图4);此外,GuCBL5、GuCBL8和GuCBL9的N端都含有一个非常保守的豆蔻酞化位点。在EF4手型域后相差8个氨基酸左右的位置还存在PFPF结构域,该结构域中的丝氨酸残基可能在提高CBL与CIPK之间互作的稳定性中发挥重要作用。
2.4 乌拉尔甘草CBL基因在染色体上的定位及基因进化关系分析
染色体分布及基因复制结果显示,GuCBL存在2个片段重复基因对GuCBL1/GuCBL7和GuCBL2/GuCBL3(图1)。对乌拉尔甘草、拟南芥和大豆的CBL进行共线性分析,探究CBL基因家族的扩张情况,发现26对CBL基因间存在共线性关系(图5)。为更深入地理解CBL基因在进化过程中的复制和功能分化,计算了GuCBL家族2个片段重复基因对的Ka/Ks值,GuCBL1/GuCBL7、GuCBL2/GuCBL3两 组重复基因对的Ka/Ks>1,说明它们进行了正向选择(表3)。通过计算田岛相对进化速率来评估这些重复对的进化速率,其P值小于0.05,表明GuCBL正在经历加速进化(表4)。

图2 CBL家族的系统发育关系分析Fig. 2 Phylogenetic relationship analysis of the CBL family
2.5 乌拉尔甘草CBL基因顺式作用元件分析
预测分析发现GuCBL上游1 500 bp启动子序列中存多个逆境和激素应答元件(图6),多个GuCBL成员启动子具有TC-rich元件,说明这些成员可能与逆境应答相关。GuCBL3、GuCBL6和GuCBL10启动子区域中有与生长素相关的响应元件TGA-元件、AuxRE ;GuCBL2、GuCBL3、GuCBL5、GuCBL6、GuCBL8和GuCBL10的启动子含有GA响应的元件 TATC-box、P-box 和 GARE-motif;GuCBL1、GuCBL2、GuCBL4、GuCBL5、GuCBL6、GuCBL7 和GuCBL10的启动子区域中检测到ABA元件ABRE;除GuCBL3、GuCBL5、GuCBL7和GuCBL8外,其他GuCBL启动子区域中均检测到乙烯响应元件ERE;GuCBL1、GuCBL2、GuCBL4、GuCBL9和 GuCBL10 5个基因的启动子顺式作用元件中存在MeJA响应元件;4个 GuCBL的启动子(GuCBL3、GuCBL5、GuCBL6和GuCBL7)还含有SA响应元件;表明GuCBL可能受到各种不同激素的调控。多个GuCBL启动子中存在一个或两个元件涉及类黄酮生物合成调控的MBSI元件,暗示这些GuCBL可能参与类黄酮的生物合成。以上结果表明,GuCBL可能与逆境应答、激素信号转导和生长发育过程密切相关。
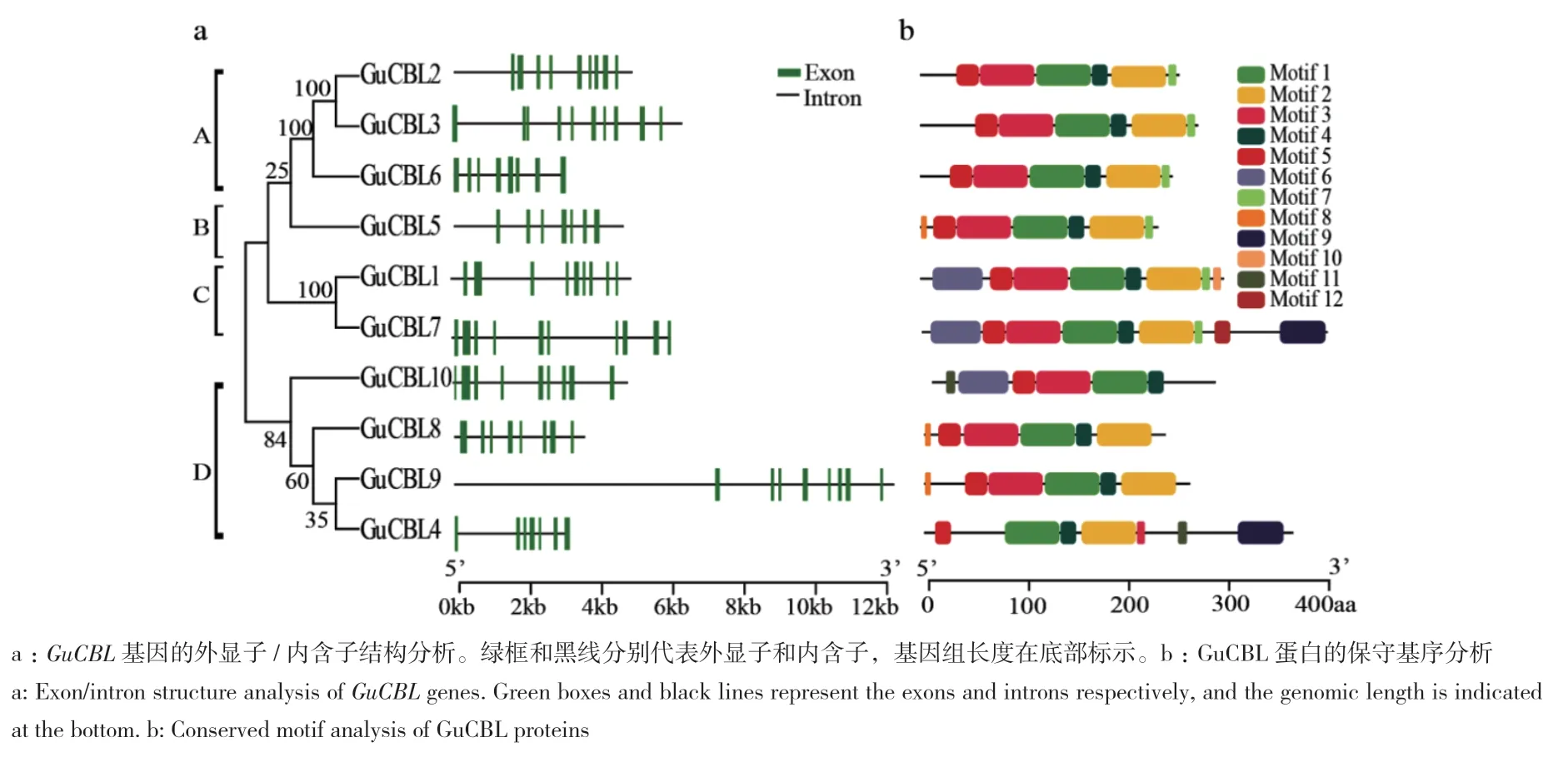
图3 乌拉尔甘草CBL家族基因基因结构和保守基序分析Fig. 3 Conserved motif and gene structure analyses of CBL family genes in G. uralensis
2.6 乌拉尔甘草CBL基因的组织特异性表达分析
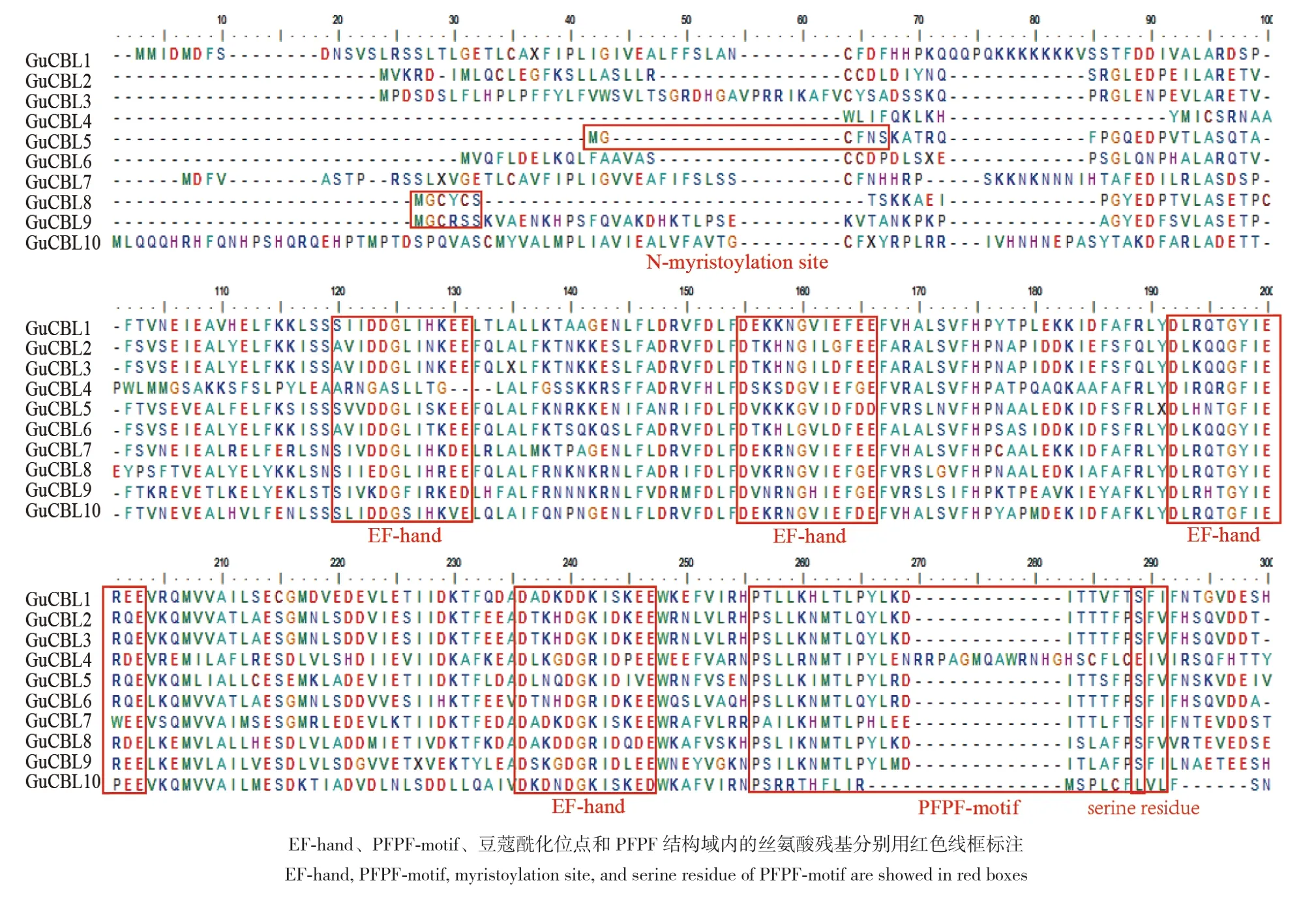
图4 乌拉尔甘草 CBL的多序列比对和保守结构域分析Fig. 4 Multiple alignment and conserved motif analysis of CBL in G. uralensis

图5 乌拉尔甘草、大豆和拟南芥CBL基因的共线性分析Fig. 5 Syntenic analysis of CBL genes in G. uralensis, G. max, and A. thaliana
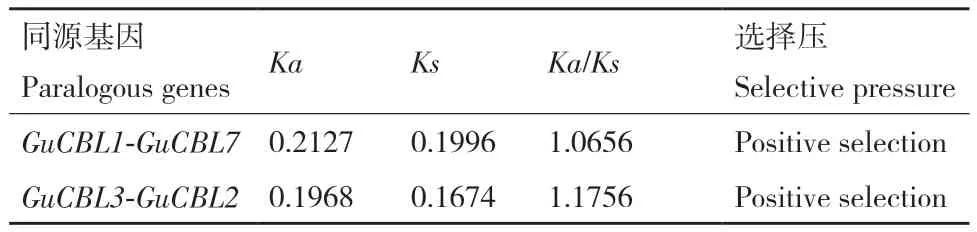
表3 乌拉尔甘草同源CBL基因的Ka/Ks比值Table 3 Ka/Ks ratios for homologous CBL genes in G.uralensis

表4 乌拉尔甘草中同源CBL基因对的田岛相对进化速率分析aTable 4 Tajima relative rate tests of homologous CBL gene pairs in G. uralensisa
提取乌拉尔甘草根、茎、叶的RNA并进行qRT-PCR,分析GuCBL的组织特异性表达特征。根据其表达情况经MeV聚类分析后可分为4组(图7),Ⅰ组和Ⅱ组的GuCBL成员在根组织中优势表达,同时在茎中有一定的表达,表明它们在根发育及相关生理代谢过程中可能发挥潜在的重要功能;Ⅲ组仅包含GuCBL6一个成员并在所有组织中表达均较低;Ⅳ组的2个成员GuCBL7和GuCBL10在茎中具有一定的表达,在根和叶中表达量都较低。以上结果表明,I组和II组的GuCBL可能在乌拉尔甘草根组织的发育及生理代谢过程中发挥着重要作用。
2.7 GuCBL响应非生物胁迫处理的表达特征分析
收集非生物胁迫处理的乌拉尔甘草根组织的材料并提取RNA进行qRT-PCR分析(图8),GuCBL家族成员在不同的胁迫处理下的转录水平呈现不同的表达特征,通过MeV聚类后,GuCBL的表达分为不同的4个亚组。在NaCl刺激下,GuCBL的表达总体呈现下调表达,但N4组的3个成员GuCBL2、GuCBL9、GuCBL10在处理后6和12 h受到诱导表达。H2O2氧化胁迫处理后,O1组的基因家族成员呈上调表达,并在处理24 h后达到最大值;O2和O3组的成员GuCBL1和GuCBL7均呈现下调表达;H4组的3个成员GuCBL3、GuCBL4和GuCBL10在处理6 h后显著上调随后下降。PEG模拟干旱胁迫时,P1和P2组的GuCBL成员在处理6-24 h均表现出显著的诱导表达。GuCBL基因家族在响应低温、高温刺激时,在一段时间内胁迫处理促进了基因的表达,4℃处理诱导了L2组的GuCBL1和GuCBL2、L3组的GuCBL9和GuCBL6的增加表达;42℃处理促进了H1组中4个成员和H3组中3个成员的显著增加表达。结果表明,GuCBL可能通过增加表达在乌拉尔甘草响应逆境胁迫中发挥重要作用。
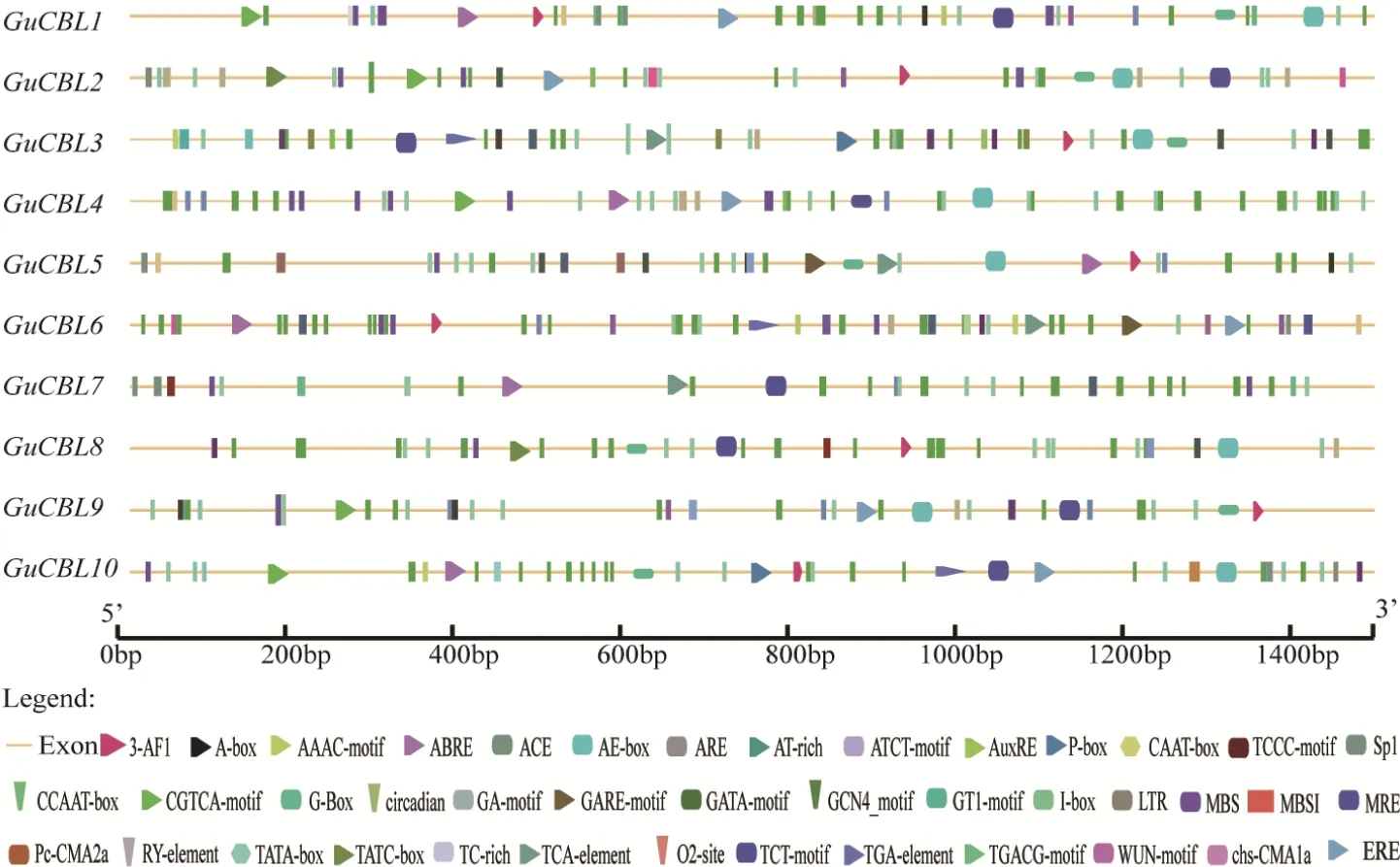
图6 GuCBL启动子中的顺式作用元件分布Fig. 6 Distribution of cis-elements in GuCBL promoter regions

图7 乌拉尔甘草GuCBL的组织特异性表达分析Fig. 7 Tissue-specific expression analysis of G. uralensis GuCBL genes
3 讨论
细胞内Ca2+是调控多种细胞功能的第二信使[26],植物受到非生物逆境与其他细胞外界刺激时会进行胞内外信号的转化,钙信使通过与钙结合蛋白相互作用,将外界信息传递给不同的信号通路,进而调节细胞代谢活动,响应外界环境变化[27]。CBL作为一类重要的钙离子结合蛋白,家族内不同的CBL成员的功能存在特异性,已从大豆、苜蓿、拟南芥等作物中均已克隆到多个CBL家族基因,为研究乌拉尔甘草CBL家族基因提供了一定基础。
本研究从乌拉尔甘草基因组中鉴定获得10个GuCBL基因。成员均含有能与钙结合的EF-hand结构和与CIPK互作的PFPF结构域。乌拉尔甘草GuCBL可分为4个组,且存在多对垂直同源基因对。重复基因对的Ka / Ks比及田岛相对进化速率,显示GuCBL家族基因正处于加速进化过程中,其可能在基因家族的扩大过程中发挥着一定作用。启动子顺式作用元件分析显示GuCBL成员不仅含有多个非生物胁迫响应元件,还存在许多激素响应、生长发育调控等元件,表明GuCBL潜在的重要功能。同一组内的GuCBL 基因含有胁迫及激素应答元件的类型和数量也各不相同,说明不同GuCBL的表达调控方式具有特异性和复杂性,其具体功能还需进一步研究。
CBL不仅参与种子萌发和幼苗生长过程,还参与植物自身的防御[28-29]。大多数乌拉尔甘草GuCBL基因在根组织中优势表达,暗示这些基因在植物根发育过程中可能发挥重要功能。CBL在植物逆境应答信号中发挥极其重要的作用,该蛋白与其下游CIPK靶蛋白组成的CBL-CIPK信号系统参与了植物多种逆境应答信号途径[30]。拟南芥AtCBL10主要受盐诱导[31];PbCBL9在盐胁迫下、PbCBL2在低温胁迫下持续高水平表达[32];胡杨PeCBL6在干旱胁迫条件下呈震荡变化的情况[33]。本研究对乌拉尔甘草进行了不同的胁迫处理,GuCBL在不同处理下呈现不同的诱导表达特征,暗示它们与逆境胁迫应答之间的密切关系。鉴于非生物胁迫能够促进次生代谢产物的累积[34],表明了GuCBL的表达与逆境胁迫下次生代谢产物合成之间的直接或间接联系,具体的功能还需进一步的遗传实验验证。

图8 乌拉尔甘 GuCBL响应非生物胁迫的表达分析Fig. 8 Expression analysis of G. uralensis GuCBL genes in response to abiotic stress
4 结论
从乌拉尔甘草基因组中成功鉴定出10个GuCBL家族基因,GuCBL在根组织中较高表达,能够被盐、氧化、干旱、低温和高温诱导表达。

