新型冠状病毒及其临床检测方法研究进展
李家俊 郑潇 盛杰 徐瑶
(武汉科技大学生命科学与健康学院 生物医学研究院,武汉 430081)
2019年12月,一种新型冠状病毒引起的肺炎在武汉爆发、流行,研究显示新冠病毒具有人传人的能力[1],且传播能力强,R0约为 2.2[2]。2020 年1月12日,世界卫生组织将2019新型冠状病毒命名为2019-nCoV(后更名为COVID-19),2月11日,国际病毒分类委员会将新冠病毒命名为SARS-CoV-2(severe acute respiratory syndrome coronavirus2)。该病作为急性呼吸道传染病已纳入《中华人民共和国传染病防治法》规定的乙类传染病,并采取甲类传染病的预防、控制措施。据新华网报道,截至7月24日,中国本土累计确诊病例86 500例,治愈80 738例,死亡4 656例,世界范围更是确诊超过1 500万例,新冠病毒对全球公共卫生安全构成了巨大威胁。准确快速确诊新冠肺炎对于防控疫情,病患的及时合理治疗非常关键。本文综述了新型冠状病毒的病原学特点与检测方法的研究进展,简要介绍了检测技术的原理和应用现状,旨在为新冠肺炎的临床准确诊断及疫情防控提供一些帮助。
1 病原学特点
SARS-CoV-2是发现的第7种β属冠状病毒[3],有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60-140 nm(图1)。SARS-CoV-2遗传物质为单股正链RNA,基因组大小约为30 kb,为已知基因组最大的RNA病毒,具有5′帽结构和3′PolyA尾巴结构,转录模式同2012年的SARS-CoV相似。SARS-CoV-2含有14个ORF共编码27种蛋白质,5′端为一个约占基因组2/3的开放阅读框架ORF1ab,编码一个多肽蛋白,在一些病毒自身编码的蛋白酶作用下加工裂解成15种非结构蛋白,如RdRP和解旋酶。靠近3′端约占基因组1/3的ORF编码至少4种结构蛋白,特异性结合宿主细胞受体的棘突蛋白(S),包膜形成相关的膜蛋白(M)、包膜蛋白(E),病毒组装相关的核衣壳蛋白(N),辅助类蛋白基因分布在结构蛋白基因之间[3-5]。
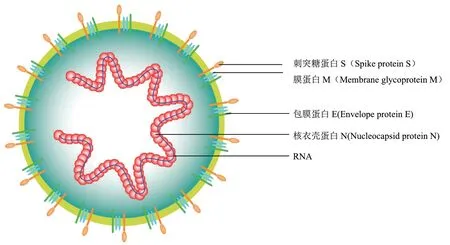
图1 新冠病毒结构示意图Fig.1 Schematic diagram of the novel coronavirus structure
目前研究显示与蝙蝠SARS样冠状病毒(bat-SLCoVZC45)同源性达85%以上。体外分离培养时,2019-nCoV 96 h左右即可在人呼吸道上皮细胞内发现,而在Vero E6和Huh 7细胞系中分离培养需约6 d。新型冠状病毒对紫外线和热敏感,56℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒,氯己定不能有效灭活病毒[6]。
Hoffman和Zhou等[7-8]分别通过病侵染细胞试验,证实了SARS-CoV-2使用血管紧张素转换酶ACE2作为S蛋白受体进入细胞,Xu[9]利用模型模拟结合计算发现S蛋白与ACE2有很强的结合能-50.6 kcal/mol。ACE2蛋白在多种组织都存在低表达[10],但主要分布在肺泡上皮细胞和小肠上皮细胞等上皮细胞腔面。ACE2作为受体蛋白与病毒一起被内吞进入细胞,导致细胞表面ACE2蛋白酶的减少,破坏了患者肾素-血管紧张素系统失衡,使得本身有基础疾病如糖尿病、高血压和心血管等患者感染后病情较重[11-13]。下呼吸道的病毒含量高于上呼吸道,呼吸道检出率又高于血液。临床上取样优先度,首先是下呼吸道样本肺泡灌洗液、支气管灌洗液,其次是深咳痰,接着是鼻咽部,最后是口咽部[14]。依据临床取样难度和患者接受程度,目前临床最常用的标本是口咽拭子,其次是鼻咽拭子。重症病例优先采集下呼吸道标本(如支气管或肺泡灌洗液、肺组织活检标本等)。部分患者的检测结果显示粪便样本与常用的咽拭子样本具有同样甚至更高的准确性[15],同时检测两份以上不同部位的样本可以增加核酸检出率。
2 检测方法
病毒感染的实验室检查包括病毒分离与鉴定、病毒核酸检测以及特异性抗体的检测。
2.1 病毒实验室分离与鉴定
病毒培养、分离与鉴定是实验室鉴定病原体的金标准。Zhu等[16]将从3例患者的支气管肺泡灌洗液分离到的病毒接种至人上皮细胞、Vero E6和Huh-7细胞株,96 h后在人气道上皮细胞表层观察到细胞病变,6 d后可以在Vero E6和Huh-7细胞株中观察到病变。分离的病毒颗粒在透射电镜下可以观察到冠状病毒日冕等独特结构。分离纯化病毒为今后病毒生物学特征、致病机理研究、疫苗研发、抗病毒特效药的研究奠定了基础。但由于病毒的培养时间较长,技术要求较高,且必须在三级安全的生物实验室内进行,所以在疫情期间并不适合用于SARS-CoV-2的快速诊断。
2.2 核酸检测
2.2.1 高通量测序 《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》中确诊依据之一就是“病毒基因测序,与已知的新型冠状病毒高度同源”。面对新型冠状病毒引起的疫情,对病毒全基因组测序可以帮助人们了解病毒的遗传信息,研究病毒进化与变异[17],解释病毒毒力来源,病毒追踪和溯源分析,为特异性的检测试剂盒、疫苗研发提供支持。疫情爆发后,多个研究团队[18-20]利用宏转录组测序技术确定了病毒的基因组,比较了不同冠状病毒的异同,并对病毒基因组做了详细系统发育树分析,及时与多数据信息平台分享,为各国疫情防控提供了数据支持。Wang等[21]建立了第三代测序纳米孔靶向测序技术,可在6-10 h内同时检测SARS-CoV-2和其他呼吸道病毒。高通量测序技术优势在于高准确性,高通量、高灵敏,检验RT-PCR灰度可疑区的结果,避免RT-PCR由于样本病毒低载量问题、引物或探针结合区存在突变位点导致的假阴性结果[22],同时还可以鉴定出其他的致病病原体,但由于检测成本较高,检测时间较长,且需要专业生物信息人员对测序结果进行解读,所以不适合用于疫情高发期间临床快速大规模检测。
2.2.2 实时荧光定量PCR 实时荧光定量PCR(RT-qPCR)按原理主要分为两类(图2),一类是通过嵌入式染料(如SYBR Green)在PCR扩增反应过程中与扩增产生的双链DNA结合,发射荧光信号,实现对PCR产物的实时定量检测。另一种则通过荧光基团标记探针进行实时检测,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5′-3′外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统接收到荧光信号,实现了荧光信号的累积与PCR产物的形成完全同步。荧光探针法特异性较高,探针可根据不同需求灵活设计,区分常见的冠状病毒,对多个靶标同时进行检测提高准确性同时防止漏检,所以目前多数使用的都是荧光探针法。进一步说RTPCR分为一步法和两步法,一步法相较两步法而言,操作简易快速,反转录与PCR扩增检测过程不相互独立,提高样本反应浓度,减少开盖次数有助于降低样本与环境污染,因而多采用一步法。Corman等[23]使用荧光探针RT-qPCR法检测新冠病毒ORF1ab、E、N三个靶标,再另外设计1条探针,用于区分2019-nCoV、SARS-CoV及bat-SAR的RdRP靶标。RT-PCR因其快速简便、成本低、特异性高等特点是疫情期间使用最多最广泛的核酸检测方法,但检测结果容易受到诸多因素影响而变成假阴性,应多次检测,确保结果的准确性。
目前国家药监局批准了16种基于荧光PCR方法的新型冠状病毒检测试剂盒(表1),检测靶标涉及ORF1ab、N、E三个基因,检测靶标至少应包括最为保守特异的ORF1ab区域。
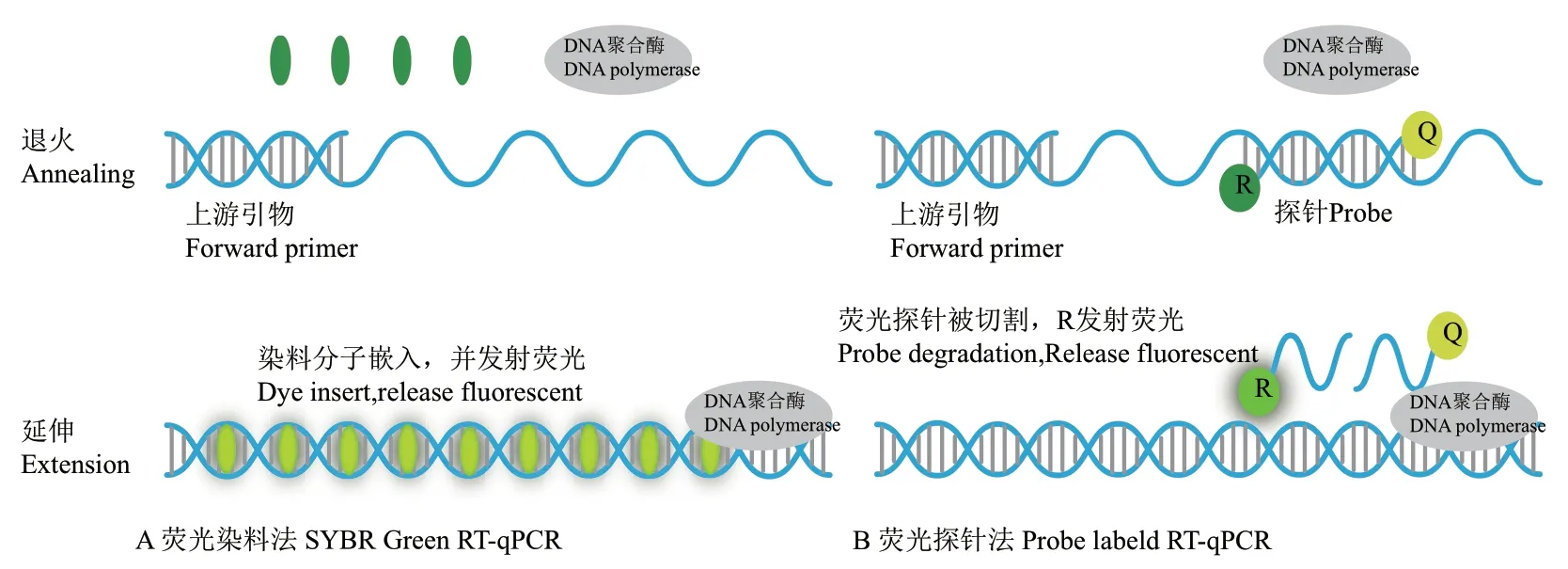
图2 两种荧光PCR示意图Fig.2 Schematic diagram of two quantitative real-time PCR
新冠病毒核酸检测的阳性样本检出率仅有30%-50%[24],导致检出率低的原因大致可分为以下几类,可参考相应的对策解决。(1)用于检测的样本不合格,样本收集的过早或过晚,样本采集保存运输灭活方式不合适,样本采集部位不同等原因导致的样本病毒载量不高,达不到检出限。在采集样本时应尽量多收集各个部位的样本混样或者同时检测,严格按照标准进行样本采集、处理和转运。Yang等[25]对6例新冠肺炎患者的鼻拭子、咽拭子、痰液和支气管肺泡灌洗液进行检测率比较发现,除支气管肺泡灌洗液(BALF)外,痰标本阳性率最高(74.4%-88.9%);其次为鼻拭子(53.6%-73.3%)。也有报道[26]患者粪便标本病原核酸检测转为阴性时间远晚于呼吸道病原核酸检测,提示可以参考粪便样本检测结果。(2)检测试剂盒本身没有经过大量临床样本优化,选用经测试过包含多靶标的的试剂盒。郭元元等[27]对6种国产新型冠状病毒核酸检测试剂检测性能比较发现,不同试剂阳性检出率不一致,重复率也不一致。靶标不一样,检出率也不一样,N亚基因拷贝数多于ORF1a/b基因,但保守程度不及ORF1a/b,导致N基因扩增阳性而ORF1a/b基因阴性[28]。(3)技术本身存在局限性使得灵敏度不高,更换更灵敏的方法检测。(4)检测结果判读困难,背景信号很强导致扩增曲线基线不准,一些灰度区的判读。重新实验,增加阴性、阳性和内标质控对照,以监测各个环节有无异常,增加可信度。(5)病毒已经发生了变异,引物结合区存在突变位点,更换试剂盒或检测方法。
2.2.3 实时荧光定量数字PCR(real time digital PCR,RT-dPCR) 样本病毒载量过低是导致RT-qPCR检出率低的一大方面原因,RT-PCR检测原理决定了大多试剂盒的检测灵敏度介于100-500拷贝。数字PCR是一种核酸分子绝对定量技术,采用微滴化方法,将大量稀释后的核酸溶液分散数万个微滴或芯片中,每个微滴反应中的核酸模板数少于等于1个。扩增完成后,只有含有核酸分子模板的微滴反应才会发出荧光信号,荧光收集后,分析软件根据泊松分布原理及阳性反应比例计算给出待检靶分子的浓度或拷贝数。新冠肺炎病患出院的标准之一,两次以上核酸检测为阴性,但常有患者连续检测结果呈阴性,却在后来被证实为阳性的报道,建议RT-dPCR作为现行标准的补充[29],对即将出院的患者进行结果确认,有利于降低SARS-CoV-2疫情和社会恐慌的风险。RT-dPCR具有高灵敏度,高特异性和低检测线等优点[30],能简化判读,分析成分复杂样本,但由于配套试剂及设备昂贵、成本较高操作复杂、通量小易受污染等缺点,使得应用受限。
2.2.4 等温扩增技术 传统的体外核酸扩增技术需要精准控制温度升降,且耗时较长(1-2 h),对样本及实验设备环境要求高,难以实现现场快速检测。20世纪90年代以来,相继诞生了十几种等温扩增技术,特点是能够在固定反应温度下实现核酸的快速扩增和检测。这里主要介绍RT-LAMP、RTRPA、恒温扩增芯片3种等温扩增技术在新冠肺炎检测中的应用,其他常见的等温扩增技术如依赖核酸序列扩增(nucleic acid sequence-based amplification,NASBA)、依赖解旋酶扩增(Helicase-dependent amplification,HDA)还未见有相关报道。
2.2.4.1 环介导等温扩增 环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是在2000年由Notomi[31]首次提出,它在等温条件下扩增DNA,具有高特异性、高效率、快速和低成本特点,1 h内可扩增109倍。LAMP体系不同于一般的扩增反应体系,它利用具有链置换活性的DNA聚合酶,以及一对特殊设计的外部引物和一对内部引物,使得能够扩增形成具有特殊环状结构的DNA链,环状结构存在内部引物的结合区,每经过一个扩增循环,环状结构就多了一倍,从而实现DNA的快速扩
增。随后在2002年,Nagamine等[32]改进了此种方法,增加一对环状引物,将扩增时间缩短了一倍。LAMP最大的优点是检测可视化。伴随着DNA迅速扩增,大量焦磷酸从底物dNTP中释放出来,焦磷酸与溶液中的镁离子反应,产生大量白色的焦磷酸镁沉淀,溶液发生pH、镁离子浓度、核酸含量和浑浊度4种变化。浑浊度可肉眼判断[33],pH变化可用pH敏感的染料通过颜色的改变读出扩增反应结果[34],由于可能存在非特异性扩增序列,因此通过浑浊度及颜色检测结果并不十分准确,可结合荧光探针提高检测特异性的方法解决这一问题[35]。核酸含量变化可使用安全灵敏的核酸染料GeneFinder,在蓝光照射下,100 copies/μL的阳性反应即可肉眼观察到清晰的绿色荧光,而阴性对照则保持粉红色[36]。镁离子浓度变化可通过添加钙黄绿素实时监测离子浓度变化[37],可以肉眼观察到从橙色到绿色的颜色变化的阳性反应。LAMP反应灵敏度高,扩增迅速,可用于即时检测,但易受到污染影响,引物设计复杂,需要有一定经验技术人员操作。

表1 国家药监局新型冠状病毒检测试剂注册信息Table 1 Registration information of novel coronavirus detection reagent in the National Medical Prodical Products Administration
2.2.4.2 重组酶聚合酶扩增 重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA) 是一种核酸恒温扩增技术,具有灵敏度高、特异性强、无需对样品进行复杂处理等特点。RPA技术利用3种在常温下仍具有活性的蛋白:结合单链核酸的重组酶,单链DNA结合蛋白SSB和链置换DNA聚合酶。重组酶与引物结合形成的蛋白-DNA复合物,能够帮助引物定位在双链DNA中同源序列,形成一个D环结构,然后链置换酶替换下DNA链,被替换的DNA链与SSB结合,防止进一步替换,聚合酶启动DNA链延伸的同时继续打开模板DNA双螺旋,整个过程十分迅速,一般可在十分钟之内获得检出水平的扩增产物,支持对样品进行多重化定量分析。在RPA体系中加入反转录重组聚合酶,即能实现RNA的扩增。产物的检测有多种方式,包括凝胶电泳、实时荧光定量、测流层析试纸等。RT-RPA能够在检测新冠病毒的同时快速区分多种常见的呼吸道病毒核酸[38],在食品卫生方面也同样能发挥作用[39],且特异性良好,与一般病毒无交叉反应。RPA能在常温条件下灵敏扩增,无需任何仪器,试剂冻干形式保存期长,检测极限低,但由于引物长度需要30-35 bp,所以并不适合较短的靶序列扩增。
2.2.4.3 恒温扩增芯片 恒温扩增芯片法的特点是针对靶基因的6个区域设计4对特异性物,利用链置换DNA聚合酶在恒温条件下经过非循环起始阶段、环扩增阶段、循环延伸阶段,最终形成一系列有多个靶 DNA反向重复序列串联的不同大小的产物,不需要模板的热变性、温度循环、电泳及紫外观察等步骤,整过程15-60 min即可完成[40]。恒温芯片扩增法检测也存在一些局限,它只是针对某一些病原体的检测,往往会遗漏一些少见致病性病原体的检出。3月26日,“6项呼吸道病毒核酸检测芯片试剂盒”获得国家药监局批准上市,该试剂盒能在1.5 h内检测包括新型冠状病毒(2019-nCoV)在内的6项呼吸道病毒。
2.2.4.4 基于Cas酶的检测技术 CRISPR/Cas系统作为一种强大的基因编辑工具,同样可以应用在核酸检测上。SHERLOCK(specific high sensity enzymatic reporter unlock)技术是 2017年张锋[41]教授团队开发的一种基于CRISPR靶向RNA的核酸检测方法。方法原理,Cas13a在crRNA引导下检测到目标RNA序列,则会激活一种非特异性的dsRNA酶切割活性,能够切割体系中的RNA报告分子,荧光基团与淬灭基团分离,检测到释放出的荧光信号,与RT-RPA扩增技术、T7转录技术结合灵敏度可达渺摩尔级别,特异性精确到单碱基。之后张峰对SHERLOCK进行改进,使之能够针对不同靶点进行多重检测,结合Cas13和一种辅助CRISPR相关酶Csm6,灵敏度提高3.5倍,达到2个渺摩尔[42]。同年,5月6日,美国食品药品监督管理局(FDA)批准了一款基于SHERLOCK技术的新冠病毒检测试剂盒,据研发公司称检测可以在大约1 h后返回结果。同样基于CRISPR的检测技术还有DETECTR,类似于SHERLOCK工作原理,不同的是DETECTR技术使用的非特异性核酸酶为Cas12a,Cas12a检测识别DNA而不是RNA,因此在检测新冠病毒时需增加反转录步骤。Broughton等[43]开发了一种基于DETECTR技术检测SARS-CoV-2的方法,45 min即可在测流条上肉眼查看结果,阳性率达95%。基于CRISPR的核酸检测技术目前还处于新兴阶段,该技术可无需特殊仪器辅助,反应体积小又有很高的灵敏度精确度,方法成熟后可扩大通量检测,因而显示出极大的应用发展前景。由于病毒的高变异性,如何提高crRNA靶向识别的特异性、反应的稳定性很是关键,相信经过不断优化改进后可以广泛运用在核酸检测领域。
2.2.5 抗体检测 由于核酸检测存在较高的假阴性,且耗时较长,对场地设备和技术人员要求较高,免疫学检测因其快速可满足现场检测、诊断较为准确可辅助临床确诊,高滴度抗体血浆对重症COVID-19患者的治疗有所帮助,因此得到了越来越多的人重视。《新型冠状病毒传染的肺炎诊疗方案(试行第七版)》首次将血清学检测作为确诊依据之一,新型冠状病毒特异性IgM抗体和IgG阳性或新型冠状病毒特异性IgG抗体由阴性转为阳性或恢复期较急性期4倍及以上升高也可确诊。目前免疫学的检测方法主要有胶体金免疫层析法、磁微粒化学发光法和酶联免疫吸附测定ELISA三种。
2.2.5.1 胶体金免疫层析法 胶体金免疫层析法(colloidal gold immunochromatography assay,GICA)以抗原抗体特异性免疫反应为基础,利用胶体金颗粒作为示踪物标记其中之一,标记物在溶剂层析作用带动下,于C/T线上发生免疫反应,根据T线颜色即可得到检测结果(图3)。GICA的样本可以是全血,血清或者血浆,研究表明胶体金检测试剂检测全血、血浆或血清具有高度一致性[44]。目前获得国家药监局批准的胶体金试剂盒有7种全为检测抗体,未有针对抗原的检测试剂盒。以RT-qPCR检测方法作为对照发现,IgM/IgG抗体对于检测的灵敏度和特异度不同,二者联合检测的检出率最高为66.1%(125/189)[45]。胶体金试纸条法可用于企业复工、学生返校、社区人群排查等场景,只需要一滴指尖血,一般15 min即可肉眼观察检测结果,具有快速简便无需特殊仪器等优点,但是检测存在窗口期、无法定量、有暴露风险、灵敏度低和易受环境因素干扰等缺点,需要核酸检测进行验证。
2.2.5.2 磁微粒化学发光法 磁微粒化学发光法利用表面固定重组抗原的磁微粒捕获样本中的特异性IgM/IgG抗体,外加磁场沉淀抗原抗体复合物,然后利用酶标二抗识别捕获的二元复合物,之后加入发光剂后通过化学发光仪测定发光强度,从而定量分析的一种新兴技术,具有快速(一般30-60 min)、灵敏度高、特异性强、检测范围宽等特点。目前获批的有7种磁微粒化学发光法检测试剂盒,最先获批的博奥赛斯生物科技有限公司研发的试剂盒,搭配化学发光自动分析仪,可做到检测速度240 T/H,首报告时间30 min。
2.2.5.3 ELISA 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA),将抗原或抗体结合到某种固相载体表面,保持其免疫活性,加入样本后形成抗原-抗体复合物,之后再加入酶标记的抗原或抗体,形成三元复合物,洗涤后加入酶催化底物显色,颜色深浅与待测样本含量成正比,可通过酶标仪测得的吸光度大小定量分析。ELISA方法特异性主要取决于所用抗原的抗原性强弱,Liu等[46]评估了两种基于不同抗原核蛋白、S蛋白的ELISA试剂盒COVID-19的检测效果,结果发现214例确诊新冠肺炎患者使用S蛋白抗原的试剂盒IgM/IgG阳性率均高于N蛋白,建议联合二者检测提高检出率。ELISA方法具有特异性强,灵敏度高的特点,但整体检测时间较长,通量较小,不利于基层大范围展开应用。
研究数据显示3种抗体检测方法敏感性特异性均很高,总抗体检测敏感性更高,建议免疫学检测总抗体[47]。对患者体内总抗体、IgM和IgG随病情进展的动态变化进行分析[48]发现,总抗体、IgM、IgG三者的阳转时间中位数分别为11/12/14 d,而SARS-CoV-2抗原在1-5 d内即可出现,提示抗体检测存在检测窗口期,在发病后的7 d内RNA阳性率为66.7%,抗体阳性率小于40%,而发病15 d后RNA阳性率下降到45.5%,总抗体阳性率则达到100%,说明随着病程不同,核酸抗体检测阳性率不同,在发病早期7 d之内同时检测核酸抗体可提高诊断敏感性。由于抗体的产生滞后时间较长,因此抗体检测灵敏性不如核酸检测,而且可能会与其他病毒产生抗体发生交叉反应,抗体水平易受到患者用药影响,血液样本中一些非特异性IgM、类风湿因子等物质容易产生干扰。IgM抗体一般在一周内产生,提示近期感染,IgG抗体产生晚于IgM抗体出现,但因为在体内能存在较长时间,所以检测可鉴别急性感染和既往感染,有利于病情的分型。基于上述原因,免疫学检测不能替代核酸检测,必须结合核酸检测结果进行确诊,可用来辅助核酸检测,排查检测阴性结果人群,发现无症状感染者,控制病毒的传播。
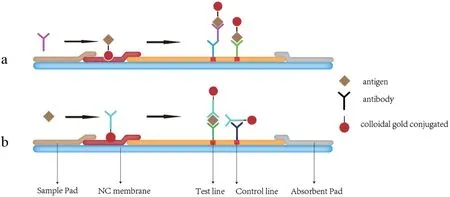
图3 免疫胶体金原理示意图Fig.3 Schematic diagram of Immune colloidal gold technique
3 结语
目前新冠病毒的检测方法主要以核酸、抗体检测为主,又以核酸检测结果阴性作为治疗康复标准,因此样本及选择检测方法至关重要,而造成检测结果假阴性的大部分原因是采集的样本病毒载量不合格或者处理保存不当。不同病程的病人宜采用不同的采样部位,同一患者不同部位采集样本检出率也不一样,具体可参照国家发布的新冠诊疗方案和实验室检测技术指南进行操作。采集过程中应尽量避免样本RNA酶污染,使用带螺旋盖内有垫圈、耐冷冻的样本采集管,样本保存在如Hank’s病毒保存液中,必要时可以在保存液中添加RNA酶抑制剂。采集好的样本应尽快检测,冷链运输,2-8℃条件下转运时间不应超过72 h,24 h内检测的标本可置于4℃保存,24 h 内无法检测的标本则应置于-70℃或以下保存,避免反复冻融。为保证实验室生物安全,在抽提病毒RNA基因组之前需要进行病毒灭活,不同的病毒灭活方式对检出率有影响,普遍采用的灭活方式为75%乙醇、56℃ 30 min处理。
伴随新冠患者不断康复出院,治愈后“复阳”的病例也屡见不鲜,目前无确凿证据表明新冠患者长期携毒、存在二次感染,究其复阳原因可分为以下几类:病毒潜伏较深,通过常规检测方法无法发现它的存在,或者因为病毒含量较低达不到检测线;糖皮质激素等免疫抑制治疗延长了带毒期;复阳检测出的核酸实际上是死病毒的核酸片段。最后一类假阳性问题可通过更换检测目标为病毒亚基因组或者活病毒颗粒解决,其余都可归结为假阴性问题。病毒样本采集、保存运输、预处理、核酸提取、扩增检测任何一个环节都有可能导致假阴性结果,临床上可通过综合评定不同部位多次采样多种检测方法连续检测结果、多种生化及影像学指标、分层管理个性化制定患者出院标准、出院隔离并定期复查等方式避免假阴性或“复阳”结果。
新冠病毒的检测方法有很多,各有优劣,除上述笔者所述外,还有很多方法,如基因芯片,核酸适配体等。现场快速即时检测产品POCT、方法的精确性、全自动流水线检测、方法学上的优化(如武汉全民体检采用了混样检测策略)是以后检测SARS-CoV-2的发展方向。随着对新冠病毒的了解逐步加深,科学技术的发展,相信会有更多更准确高效的检测方法产品被研发出来,我们期待今后出现集核酸提取、快速扩增、检测一体化的便携式仪器和类似禽流感检测商品化的抗体检测试纸条,能够方便普通民众在社区卫生服务中心或者居家等场景自我筛查,以防疫情再次来临时医院等稀缺公共资源紧张的情况。

