青钱柳中5种三萜酸成分对肝细胞糖异生的影响
曹静静,郑显,,刘瑶,殷志琦,蒋翠花,张健*
(1.南京中医药大学附属中西医结合医院,江苏 南京 210028;2.江苏省中医药研究院转化医学实验室,江苏 南京 210028;3.中国药科大学天然药物化学教研室&天然药物活性组分与药效国家重点实验室,江苏 南京 210009)
根据世界糖尿病大会(IDF)报道[1],2019年全球约有4.63亿成人患有糖尿病,预计到2045年全球糖尿病患者人数将上升至7亿,其中中国糖尿病患者人数和发病率位居世界第一。糖尿病患者中超过90%为2型糖尿病(T2DM)。研究表明,胰高血糖素主要通过刺激肝脏糖异生以在空腹或饥饿时维持血糖水平[2-3],在糖尿病的发生发展中发挥重要作用。临床研究发现T2DM患者肝糖异生功能异常增强,致使空腹血糖升高[4]。因此,挖掘特异性靶向肝糖异生的先导化合物,可为T2DM治疗药物的开发提供有益的参考。
青钱柳(Cyclocaryapaliurus),又名摇钱树、麻柳等,为胡桃科青钱柳属植物,具有降血糖、降血脂和抗氧化等功效[5-6]。本课题组前期研究发现青钱柳三萜酸部位可以有效降低糖尿病小鼠的高血糖[7-8],但其对肝脏葡萄糖代谢和糖异生的影响尚不明确。因此,本文评价青钱柳中5种主要三萜酸成分对小鼠原代肝细胞糖异生及磷酸烯醇式丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸脱氢酶(G6Pase)的影响,以期发现抑制肝糖异生的先导化合物,为青钱柳降糖提供更充分的科学依据。
1 材料
1.1 试剂与药物
D-Hanks缓冲液、DMEM高糖、噻唑兰(MTT)、PBS溶液(江苏凯基生物技术股份有限公司);氯化钙、ITS(Insulin、Transferrin、Selenium)细胞培养添加物、丙酮酸钠、乳酸钠、Ⅳ型胶原酶、地塞米松(美国Sigma公司);无糖DMEM培养基、Williams′Medium E培养基、L-glutamin、HEPES、Ⅰ型胶原(美国Gibco公司);EGTA、Percoll、0.4%台盼蓝染液、Triton X-100(索莱宝公司);RIPA裂解液、PMSF蛋白酶抑制剂、双抗(青霉素-链霉素溶液)、二甲基亚砜(DMSO)、PBS(10×)、DEPC水、山羊抗兔IgG、SDS-PAGE蛋白上样缓冲液(碧云天生物技术有限公司);胎牛血清(Hyclone公司);glucagon(Med Chem Express公司);二甲双胍(爱必信生物科技有限公司);Trizol Reagent(Ambion公司);葡萄糖含量测试盒、BCA测试盒(南京建成生物工程研究所);SYBR Green Realtime PCR Master Mix、ReverTra Ace qPCR RT Master Mix with gDNA Remover(东洋纺公司);引物设计合成(上海捷瑞生物工程有限公司);PEPCK、G6Pase、CK-18抗体(Abclonal公司);内参抗体β-tublin(沈阳万类生物有限公司)。
arjunolic acid(1)、hederagenin(2)、3β,23-dihydroxy-12-ene-28-ursolic acid(3)、cyclocaric acid B(4)、2α,3α,23-trihydroxyurs-12-en-28-oic(5)由中国药科大学中药制药系殷志琦教授课题组提供,纯度>98%(HPLC面积归一化法测定)。
1.2 仪器
MS205DU精密天平(美国Mettler Tolerdo);Vert.A1倒置荧光显微镜(德国CARL ZEISS公司);Synergy H1多功能微孔板检测仪(美国BioTek公司);Quantsdutio DX荧光定量PCR仪(美国ABI公司);S1000PCR热循环仪、164-5051电泳仪、电泳槽及转膜仪(美国Bio-Rad公司);TUS-200P振荡型恒温金属浴(上海一恒科技有限公司);Sapphire RGBNIR双模式多光谱激光成像系统(美国Azure Biosystems公司)。
1.3 实验动物
SPF级C57BL/6J小鼠,雄性,体质量18~22 g,购于上海斯莱克实验动物有限责任公司,合格证号SCXK(沪)2017-0005,饲养于江苏省中医药研究院实验动物中心,12 h光照循环,温度为(24±2)℃,相对湿度(60±10)%,自由进食和饮水条件进行饲养。
2 方法
2.1 小鼠原代肝细胞分离
参照Salem等[9]建立的实验方法,采用两步灌注法分离小鼠原代肝细胞。小鼠采用戊巴比妥钠45 mg/kg麻醉后,消毒,留置针插入下腔静脉,在体灌注37 ℃预热的Buffer 1灌注液(50 mL Hanks+10 mg EGTA,pH 值7.4),戳破门静脉,让血水流出。Buffer 1冲完前,换Buffer 2灌注液(50 mL Hanks+11 mg CaCl2+15 mg Ⅳ型胶原酶),灌注完成,分离肝脏置DMEM高糖中,70 μm筛网过滤,4 ℃、50×g离心2 min,弃上清,梯度离心液(5 mL 10×PBS+45 mL percoll+50 mL DMEM高糖)重悬,1 500 rpm离心8 min,弃上清,DMEM高糖重悬后,再次50×g离心2 min,弃上清,加入肝细胞培养液,台盼蓝计数,以1.5×105个/mL接种于24孔板,4 h细胞贴壁,观察生长状态。
2.2 小鼠原代肝细胞鉴定
2.2.1 CK-18蛋白水平检测
分离获得原代肝细胞以1.5×105个/mL接种于预先包被Ⅰ型鼠尾胶原的60 mm培养皿中培养24 h后,弃上清,PBS清洗细胞2次,每皿加入150 μL RIPA裂解液(含1% PMSF),冰上裂解5 min,刮下细胞,转移到1.5 mL EP管,13 000 rpm 4 ℃离心20 min,收集上清液,用BCA试剂盒测定蛋白浓度。配制10%分离胶及5%浓缩胶,进行SDS-PAGE电泳,经半干转到PVDF膜上,然后用含5%脱脂奶粉的TBST溶液室温封闭2 h,加入CK-18抗体孵育,4 ℃过夜。TBST洗涤3次,加入二抗37 ℃孵育1 h,TBST洗涤3次,电化学发光检测法显色。
2.2.2 免疫荧光染色
原代肝细胞按方法“2.1”项下铺于24孔板培养24 h后,吸去培养基,预热PBS清洗2次,每次5 min,清洗完成后,吸去PBS,每孔加入500 μL 4%多聚甲醛固定15 min。弃去多聚甲醛,PBS清洗3次,每次5 min,每孔加入500 μL 0.5%的Triton X-100通透液,室温静置通透5 min。弃去通透液,PBS清洗3次,每次5 min,每孔加入500 μL 5%的BSA封闭液,室温静置封闭1 h。吸去封闭液,PBS清洗3次,每次5 min,吸去PBS,每孔加入300 μL稀释后的CK-18抗体(稀释比例为1∶200),室温静置封闭2 h或4 ℃封闭过夜。吸去一抗,PBS清洗3次,每次5 min,吸去PBS,避光加入300 μL稀释后的Alexa Fluor 488荧光二抗,室温避光孵育1 h。吸去二抗,PBS清洗3次,每次5 min,弃去PBS,避光加入200 μL DAPI,室温避光孵育10 min。弃去DAPI染色液,PBS清洗4次,每次5 min,弃去PBS,倒置荧光显微镜下拍照。
2.3 药物配制及原代肝细胞糖异生实验
2.3.1 药物配制
取一定量的青钱柳三萜酸化合物1~5,用DMSO溶解(DMSO浓度不超过最终使用浓度的千分之一),然后用无糖DMEM稀释至需要浓度。
2.3.2 glucagon对原代肝细胞细胞毒性的影响
原代肝细胞按“2.1”项下铺于96孔板中,贴壁24 h后,将培养基换为含有50、100、200、400、600、800、1 000 nmol/L glucagon的DMEM培养基,培养12 h后,每孔加入5 mg/mL MTT 20 μL,孵育4 h,弃去上清,每孔加入150 μL DMSO溶液,振荡10 min,于490 nm处测定吸光度(A)。
2.3.3 glucagon对原代肝细胞糖异生的影响
原代肝细胞按“2.1”项下铺于24孔板中,贴壁4 h后更换为无血清培养基培养,继续培养18 h,用无糖DMEM润洗后,将培养基换为含2 mmol/L pyruvate、20 mmol/L乳酸的无糖DMEM,并分别添加50、100、200、400 nmol/L glucagon培养3、6、12 h后,取上清,4 ℃、10 000 rpm离心3 min,葡萄糖测试盒测定上清中葡萄糖含量,同时用BCA试剂盒检测各孔中蛋白浓度以校正葡萄糖含量。
2.4 5种三萜酸成分对原代肝细胞细胞毒性的影响
原代肝细胞按“2.1”项下方法铺于96孔板中,贴壁24 h后,给药组加入不同浓度的化合物(1、5、10、20、40、80、100 μmol/L)培养12 h后,方法同“2.3.2”,检测490 nm处吸光度,计算细胞活力。
2.5 5种三萜酸成分对原代肝细胞糖异生的影响
原代肝细胞按 “2.1”项下方法铺于24孔板中,贴壁4 h后更换为无血清培养基培养,继续培养18 h,用无糖DMEM润洗后,分为正常对照组(NC组,2 mmol/L pyruvate+20 mmol/L乳酸)、模型组(M组,2 mmol/L pyruvate+20 mmol/L乳酸+100 nmol/L glucagon)、给药组(分别为10 μmol/L化合物1~5)和二甲双胍组(Met组,150 μmol/L Metformin),共孵育6 h后,方法同“2.3.3”,测定上清中葡萄糖含量。
2.6 G6Pase、PEPCK mRNA表达水平检测
原代肝细胞按“2.1”项下方法铺于6孔板中,贴壁4 h后更换为无血清培养基培养18 h,无糖DMEM润洗后,分为NC组、M组、给药组(10 μmol/L化合物1、3、5)和Met组,孵育6 h后,弃去上清,PBS清洗细胞2次,用Trizol试剂抽提细胞总RNA,酶标仪测定A260/280及其浓度,A260/280在1.8~2.0视为提取纯度合适,按照逆转录试剂盒将RNA逆转录为cDNA。按照PCR试剂盒进行后续PCR反应。各引物序列如表1所示。

表1 实时PCR检测的引物序列
2.7 Western Blot分析
原代肝细胞按“2.1”项下方法接种于60 mm培养皿中,按“2.6”项下条件诱导糖异生和分组处理,孵育6 h后,弃去上清,PBS清洗细胞2次,每皿加入150 μL RIPA裂解液(含1% PMSF),在冰上裂解5 min,刮下细胞,转移到1.5 mL EP管,4 ℃ 13 000 rpm 离心20 min,收集上清液,用BCA试剂盒测定蛋白浓度。将蛋白质样品稀释至相同浓度,配制10%分离胶及5%浓缩胶,进行SDS-PAGE电泳,经半干转到PVDF膜上,用含5%脱脂奶粉的TBST溶液室温封闭2 h,加入一抗孵育,4 ℃过夜。TBST洗涤3次,然后加入二抗37 ℃孵育1 h,TBST洗涤3次,电化学发光检测法显色,Image pro plus 6.0软件扫描蛋白条带灰度值并进行分析。
2.8 统计学分析
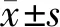
3 结果
3.1 小鼠原代肝细胞培养
采用两步灌注法及多次离心分离小鼠原代肝细胞,台盼蓝染色计数肝细胞存活率>90%。倒置显微镜下观察细胞形态变化(见图1A),结果发现接种4 h后,细胞基本贴壁,形状近似圆形,细胞核可见单核或双核;接种20 h后,细胞变大且不规则,相邻细胞互相连接。
3.2 小鼠原代肝细胞鉴定
3.2.1 CK-18蛋白水平检测
CK-18是肝细胞常用的标记蛋白。分离获得细胞培养24 h后,Western Blot显示分离所得的细胞CK-18表达阳性,表明分离获得细胞为肝脏细胞(见图1B)。

注:A:肝细胞培养0~20 h(×200);B:CK-18(1:HUVEC,2:AML12,3:自行分离细胞);C:CK-18免疫荧光(×200)。图1 小鼠原代肝细胞培养及鉴定
3.2.2 免疫荧光染色鉴定
肝细胞培养24 h后,进行抗CK-18免疫荧光染色后,结果发现细胞轮廓清晰,绿色荧光在胞质中均匀分布(见图1C),进一步证实分离所得细胞为肝脏细胞。
3.3 肝细胞糖异生模型的建立
3.3.1 glucagon对原代肝细胞细胞活力的影响
如图2A所示,MTT法检测50、100、200、400、600、800、1 000 nmol/L glucagon对原代肝细胞细胞活力的影响。结果显示,与NC组相比,1 000 nmol/L以内的glucagon对原代肝细胞无毒性影响,因此选择50、100、200、400 nmol/L浓度进行相关实验。
3.3.2 glucagon对原代肝细胞糖异生的影响
glucagon浓度为100 nmol/L,培养6 h时,糖异生最为显著(P<0.01)(见图2B)。故选用100 nmol/L glucagon浓度的无糖培养基培养6 h建立糖异生模型。
3.4 5种三萜酸成分对原代肝细胞细胞活力的影响
如图3A所示,MTT法检测结果显示,与NC组相比,化合物1、3、5在40 μmol/L及以上浓度对原代肝细胞有显著毒性(P<0.01),化合物2、4在20 μmol/L及以上浓度对原代肝细胞有显著毒性(P<0.01);此外,加入100 nmol/L glucagon刺激,以上结果无明显变化(见图3B),故选取10 μmol/L的化合物1~5作为安全浓度开展后续实验。

注:A:glucagon对原代肝细胞细胞活力的影响(12 h);B:不同浓度glucagon对原代肝细胞糖异生的影响;与对照组比较,*P<0.05,**P<0.01。图2 Glucagon诱导条件下对小鼠原代肝细胞糖异生的影响

注:A:5种成分对原代肝细胞细胞活力的影响(12 h);B:100 nmol/L glucagon +5种成分对原代肝细胞细胞活力的影响(12 h);与对照组比较,*P<0.05,**P<0.01,***P<0.001。图3 青钱柳中5种三萜酸成分对原代肝细胞细胞活力的影响
3.5 5种三萜酸成分对原代肝细胞糖异生的影响
如图4所示,与NC组相比较,glucagon可诱导糖异生显著升高54.9%(P<0.01)。而此条件下,10 μmol/L的化合物1、3、5的抑制率分别为16.2%、19.1%、14.9%(P<0.05)。该结果表明化合物1、3、5可以显著抑制小鼠原代肝细胞糖异生。

注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。图4 青钱柳中3种三萜酸成分对原代肝细胞异生的影响
3.6 青钱柳中3种三萜酸成分对原代肝细胞中G6Pase、PEPCK mRNA及蛋白表达的影响
3.6.1 药物对G6Pase、PEPCK mRNA表达的影响
如图5A所示,glucagon刺激可显著增加G6Pase和PEPCK的mRNA(P<0.01),在此条件下,10 μmol/L的化合物1、3、5可显著降低G6Pase和PEPCK的 mRNA水平(P<0.05),说明化合物1、3、5可显著降低glucagon刺激条件下原代肝细胞中G6Pase和PEPCK mRNA表达。
3.6.2 化合物1、3、5对G6Pase、PEPCK蛋白水平的影响
如图5B所示,与NC组相比,glucagon刺激条件下,G6Pase和PEPCK的蛋白水平显著增加38.7%、55.9%(P<0.05),化合物1、3、5干预后可显著降低G6Pase和PEPCK的蛋白水平(P<0.05)。提示化合物1、3、5可显著降低glucagon刺激条件下原代肝细胞中G6Pase和PEPCK蛋白的表达。

注:A:G6Pase、PEPCK mRNA表达水平;B:G6Pase、PEPCK蛋白水平;与对照组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01。图5 青钱柳中3种三萜酸成分对原代肝细胞中G6Pase、PEPCK蛋白水平及mRNA表达的影响
4 讨论
肝内胰高血糖素反应失调,肝糖异生功能明显增强,是产生高血糖的主要原因之一,有效抑制肝糖异生是控制血糖的重要方式[3,10-11]。本实验建立了糖异生细胞水平筛选模型,利用小鼠原代肝细胞评价化合物对糖异生的影响,发现来自青钱柳三萜酸的天然产物arjunolic acid、3β,23-dihydroxy-12-ene-28-ursolic acid、2α,3α,23-trihydroxyurs-12-en-28-oic通过调控G6Pase、PEPCK的表达水平,有效抑制肝糖异生。
中医学认为,糖尿病的发生多因脏腑虚损、阴虚燥热,并主张以“清热泻火、养阴生津”来治疗糖尿病。中药黄连、秋葵、石斛、青钱柳等均可降低血糖。现代药理学研究表明,黄连能抑制炎症,降低大鼠血糖[12];秋葵可改善肥胖,降低血糖[13];石斛能改善胰岛β细胞功能[14];青钱柳可以提高糖耐量[15]。其中,青钱柳作为药食两用植物[16],食用方便、味道甘甜且降糖效果显著,越来越受到关注。已有研究证实,青钱柳降糖主要活性成分为三萜和黄酮类化合物[17]。研究表明青钱柳三萜中青钱柳酸B和青钱柳苷H可改善糖代谢紊乱,其机制包括改善胰岛素抵抗、促进葡萄糖摄取等[18]。而本实验研究表明青钱柳三萜酸中主要成分arjunolic acid、3β,23-dihydroxy-12-ene-28-ursolic acid和2α,3α,23-trihydroxyurs-12-en-28-oi可以通过抑制糖异生降低血糖。
本研究发现青钱柳三萜中主要成分arjunolic acid、3β,23-dihydroxy-12-ene-28-ursolic acid、2α,3α,23-trihydroxyurs-12-en-28-oi可以抑制胰高血糖素诱导条件下的糖异生,提示上述单体可能是通过调控胰高血糖素信号通路发挥作用的。作为调控能量稳态的重要激酶,AMPK可通过影响胰高血糖素信号通路调控肝脏糖异生[19]。研究发现,青钱柳三萜类化合物可通过调控AMPK促进葡萄糖摄取,进而达到降糖效果[8,18]。可见,上述3种单体抑制糖异生的机制可能与AMPK有关。
综上所述,本研究在前期青钱柳降糖作用研究的基础上发现青钱柳中部分三萜酸类成分可显著抑制糖异生,进一步完善了青钱柳三萜部位降糖的药效物质基础,也为从调控糖异生的角度出发来治疗糖尿病提供更可靠的科学依据。但这些成分是通过何种机制调控肝脏糖异生关键酶G6Pase、PEPCK的表达发挥作用,以及其体内药效和安全性均需进一步研究。

