二甲基亚砜捕获-高效液相色谱法测定羟基自由基
韩 瑶,李佳隆,杨亚磊,节梦蕾,景伟文
(新疆农业大学化学工程学院,新疆乌鲁木齐 830052)
羟基自由基(·OH)具有非常高的氧化活性,可以与大多数有机物发生反应,反应速率达107~1010mol/(L·s)[1],其来源主要是光反应过程。但 ·OH的寿命非常短,在水相中只有约10-9s,且自然水体表层所含 ·OH的稳态浓度为1.0×10-17~1.0×10-15mol/L[2]。由于寿命极短加上其稳态浓度通常较低,因此给定量测定水体中 ·OH的生成带来了相当大的困难。
近年来,对有机探针DMSO测定 ·OH的有效性进行了充分的研究[14 - 16],但是目前没有报道将 DMSO 应用于Fe(Ⅲ)-羧酸体系中 ·OH的测定。本文尝试通过DMSO捕获 ·OH,并与其反应生成甲醛,产生的甲醛与衍生试剂2,4-二硝基苯肼(DNPH)反应得到衍生产物甲醛-2,4-二硝基苯腙(HCHO -DNPH),利用高效液相色谱-紫外检测器对衍生产物进行分离分析,并对具体的衍生化条件进行了优化,旨在建立一种简便快捷、灵敏度高、衍生产物具有单一性,适用于光反应体系中 ·OH测定的分析方法。最后以该方法对UV-Fe(Ⅲ)-羧酸体系中经光化学反应形成的 ·OH进行了定量,为今后环境中持久性有机污染物(POPs)光降解和转化反应的研究奠定基础。
1 实验部分
1.1 仪器与试剂
LC-20AB型高效液相色谱仪(日本,岛津公司),附SPD-M20A检测器;OCRS-1型光化学反应仪(开封市宏兴科教仪器),配300 W汞灯;FE20型pH计(上海梅特勒-托利多仪器有限公司);AL204型电子天平(上海梅特勒-托利多仪器有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);SHB-Ⅲ型循环水式多用真空泵。
甲醛标准品(100 mg/L,纯度>97%)购自北京北方伟业计量技术研究院;甲醇(>99.9%,色谱纯)购自Sigma-Aldrich公司;Fe(ClO4)3·xH2O、草酸、酒石酸、DMSO、DNPH购自天津光复科技发展有限公司,均为分析纯(>99.5%);HClO4(70%)、NaOH购自天津政成化学制品有限公司。实验用水为艾柯纯水仪制备的超纯水。
1.2 实验方法
1.2.1 溶液配制甲醛标准溶液:准确移取1.00 mL甲醛标准品于10 mL容量瓶中,用超纯水定容至刻度,配制成10.00 mg/L标准储备液,于冰箱4 ℃储存,临用时用超纯水稀释成不同浓度的标准工作液。
1.2.2 UV-Fe(Ⅲ)-羧酸体系中 ·OH的生成、捕获及测定准确称取0.0354 g(1.0×10-4mol/L)的Fe(ClO4)3·xH2O,加约900 mL超纯水,搅拌至充分溶解后,按照Fe∶羧酸物质的量比为1∶10的比例分别加入草酸或酒石酸,定量加入DMSO,调节pH=3后(NaOH或HClO4)移入容量瓶中定容摇匀,将反应液倒入反应容器中,置于汞灯光化学反应仪中进行光照,定时取样。样品1 mL移入容量瓶中,加5 mL H3PO4-NaH2PO4缓冲溶液,2.7 mL DNPH溶液(1 mmol/L),定容,于50 ℃下水浴30 min,冷却至室温后过滤,HPLC-PDA分离检测。生成的甲醛按照上述衍生条件进行测定,根据DMSO和 ·OH的捕获反应,如式1~3所示,2 mol的 ·OH得到 1 mol甲醛,从而计算 ·OH的生成量。

(1)

(2)

(3)
2 结果与讨论
2.1 色谱条件
选定的色谱条件为:采用ODS-SP-C18色谱柱;流动相为甲醇∶水(70∶30,V/V);等度洗脱方式;流速为0.7 mL/min;柱温30 ℃;进样量为20 μL,检测波长352 nm。图1为测定体系典型色谱图,其中图1a为对照(没有进行紫外光照射的溶液,取样后按照“1.2.2”方法进行衍生化反应),图1b为甲醛标准色谱图,图1c和图1d分别为Fe(Ⅲ)-草酸和Fe(Ⅲ)-酒石酸体系的测定结果。从图1a可以看到,HPLC法没有检测到HCHO -DNPH的色谱峰,只有DNPH存在,说明对照溶液不产生本底干扰。从图1b中可以看出,体系中DNPH及其衍生物HCHO -DNPH在12 min内完全分离,且分离度高,峰形对称,达到测定要求。其中甲醛衍生物HCHO -DNPH的保留时间约为10.8 min。另外图1c和图1d的结果说明反应液中其他成分不会对测定产生干扰。

图1 DNPH及甲醛衍生物HCHO -DNPH的色谱图Fig.1 Chromatograms of DNPH and formaldehyde derivative HCHO -DNPHa:blank;b:formaldehyde standard solution;c:Fe(Ⅲ)-oxalic acid system;d:Fe(Ⅲ)-tartaric acid system.
2.2 衍生化反应条件
2.2.1 DPNH浓度的影响本文所用方法是通过DMSO探针捕获 ·OH以产生特定的产物,然后利用衍生试剂对产物进行衍生,使生成稳定且适合用HPLC法进行测定的衍生产物,所以该方法的灵敏度有一部分是由衍生反应所决定的。目前较常使用的衍生试剂为DNPH[17]、乙醇[18]、五氟苄基羟胺盐酸盐[19]等。使用乙醇进行衍生时需要使用酸催化剂,操作与本文相比较为繁琐;使用五氟苄基羟胺盐酸盐衍生时时间较长,不适用于快速测定。因此本实验选择DNPH作为衍生试剂。
对衍生化试剂的浓度进行了优化,实验结果见图2。图2的结果显示,当DPNH浓度在0~90 μmol/L范围内变化时,衍生产物HCHO -DNPH的峰面积随DPNH浓度增加而快速增加,当DNPH浓度大于180 μmol/L,衍生物的峰面积基本保持平稳。增加衍生试剂的浓度有利于衍生反应进行彻底,所以后续实验衍生化试剂浓度控制在270 μmol/L左右。同时需要注意的是由于甲醛是一种易于氧化的挥发性化合物,因此在实际样品测定中,取样后应快速加入衍生试剂进行衍生化,以减小实验误差。
2.2.2 pH的影响使用DNPH进行甲醛的衍生化反应,应充分考虑酸度的影响,因为甲醛和DNPH只有在酸性条件下才能发生亲核加成反应。在其它实验条件相同条件下,pH的影响见图3。由图3可以看出,溶液pH值在2~3时,衍生物HCHO -DNPH的峰面积急剧下降,这是因为酸催化作用影响了DNPH和甲醛发生亲核加成反应,在强酸条件下对酸度变化更加敏感,所以HCHO -DNPH峰面积变化较快[20]。溶液pH在3~6范围内,酸度变化对于衍生物峰面积影响较小,且pH为4时峰面积达到最大,随着酸度的减弱,该衍生反应对于酸度变化的敏感程度也有所减弱,因此在此段pH区间内峰面积有一个较为平稳的变化。当pH值在6~8之间时,尽管在较高的pH值下,可用的游离亲核试剂较多,然而羰基反应性较差,所以峰面积迅速减小[21]。综上所述,本实验选择pH为4的H3PO4-NaH2PO4缓冲溶液。
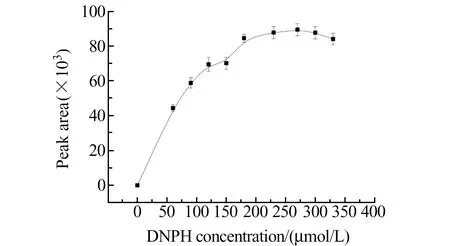
图2 DNPH浓度对甲醛衍生化的影响Fig.2 Effect of DPNH concentration on derivatization of formaldehydeHCHO:5 μmol/L;pH=4.0;derivatization temperature:50 ℃;derivatization time:30 min.
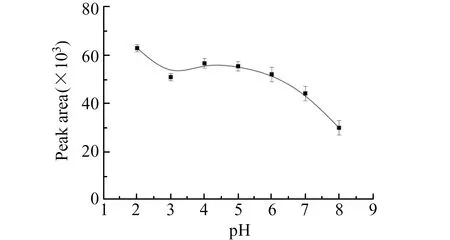
图3 pH对甲醛衍生化的影响Fig.3 Effect of pH on derivatization of formaldehydeHCHO:5 μmol/L;DNPH:270 μmol/L;derivatization temperature:50 ℃;derivatization time:30 min.
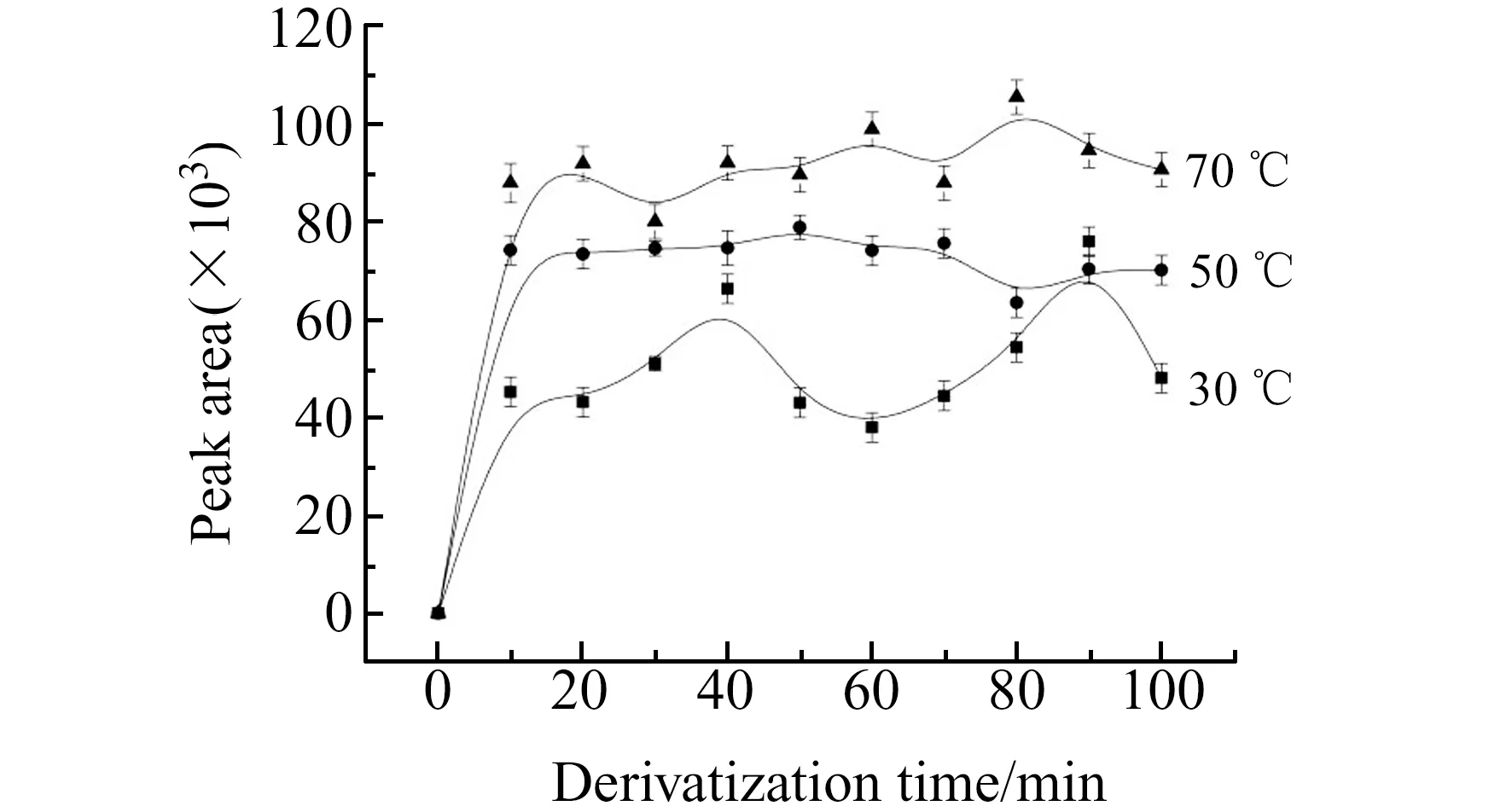
图4 衍生温度和时间对HCHO -DNPH峰面积的影响Fig.4 Effect of derivatization temperature and time on the peak area of HCHO -DNPHHCHO:5 μmol/L;DNPH:270 μmol/L;pH=4.0.
2.2.3 衍生化温度和时间的影响对衍生化反应的温度和时间影响的考察结果如图4所示。由图4可以看出,衍生温度为70 ℃时,衍生产物HCHO -DNPH的峰面积变化波动明显,且在反应时间段内没有稳定的趋势,而且在高温下甲醛容易挥发。衍生温度降为30 ℃和50 ℃时,HCHO -DNPH的峰面积变化比较平稳。适当提高反应温度可加快反应速度,提高反应产率,因此选择衍生温度为50 ℃,反应30 min。
2.3 方法学验证
2.3.1 线性范围、定量限和检出限在优化的实验条件下,甲醛浓度(X)在0.1~5 mg/L范围内与衍生物(HCHO -DNPH)峰面积(Y)线性关系良好,拟合后的线性方程为:Y=3.05×105X-2.67×104,相关系数为0.9962。
以光照30 min后的反应液作为空白进行加标试验(加标量0.1 mg/L,取6个独立样品进行测试)在仪器上的响应值为基础,以3倍信噪比(S/N)所对应的摩尔浓度为方法的检出限,得出甲醛的检出限(LOD=3S/b,其中S峰面积的标准偏差,b为标准曲线的斜率)为0.0013 mmol/L,以10倍S/N所对应的摩尔浓度为方法的定量限(LOQ=10S/b),得出甲醛的定量限为0.0045 mmol/L,则该方法对 ·OH的检出限和定量限分别为0.0027 mmol/L和0.0090 mmol/L。
2.3.2 方法的加标回收率和精密度在高纯水中加入Fe(ClO4)3·xH2O∶草酸(10∶1),捕获剂DMSO,并分别加入4个不同浓度水平的甲醛标准溶液,置于光反应仪中光照30 min进行加标回收率实验。每个添加水平分别取3个独立样品进行衍生化,考察该方法的相关回收率和精密度,结果如表1。由表1中的结果可知,本方法具有良好的准确度和精密度。

表1 回收率及精密度实验结果
2.4 实际样品的测定
2.4.1 捕获剂DMSO用量为了能完全捕获水体在光照条件下产生的 ·OH,以及在一定程度上抑制体系中可能存在的副反应,对捕获剂DMSO的用量进行了考察,结果如图5所示。图5中的结果表明,不加入捕获剂DMSO时,检测不到衍生产物HCHO -DNPH的存在。当DMSO浓度在0~14 mmol/L范围内变化时,HCHO -DNPH峰面积随DMSO浓度增加而急剧增加,当DMSO浓度大于14 mmol/L时,HCHO -DNPH峰面积几乎没有变化。在使用COU作为捕获剂的高级氧化工艺中也报道了类似的结果[22]。当捕获剂DMSO浓度超过14 mmol/L后,就足以捕获UV-Fe(Ⅲ)-草酸体系在汞灯光照30 min下产生的 ·OH。但是由于考虑到更长的光照时间和不同反应体系的活性,故本实验选择捕获剂DMSO的浓度为84 mmol/L,在此浓度捕获剂条件下,反应体系产生的 ·OH都能够被DMSO所捕获,另一方面有研究表明在浓度足够高的二甲基亚砜条件下,反应产生的另一种产物甲醇不能被氧化成甲醛[15]。所以本文采用较高浓度的DMSO。
2.4.2 UV-Fe(Ⅲ)-羧酸体系中 ·OH的光化学生成将本文建立的测定方法应用于Fe(Ⅲ)、Fe(Ⅲ)-草酸盐配合物和Fe(Ⅲ)-酒石酸盐配合物光解产生 ·OH的测定。在汞灯光源连续照射过程中产生 ·OH的累积浓度随光照时间增加的变化如图6所示。在足够高的捕获剂浓度下,累积的 ·OH浓度呈现出增长趋势。
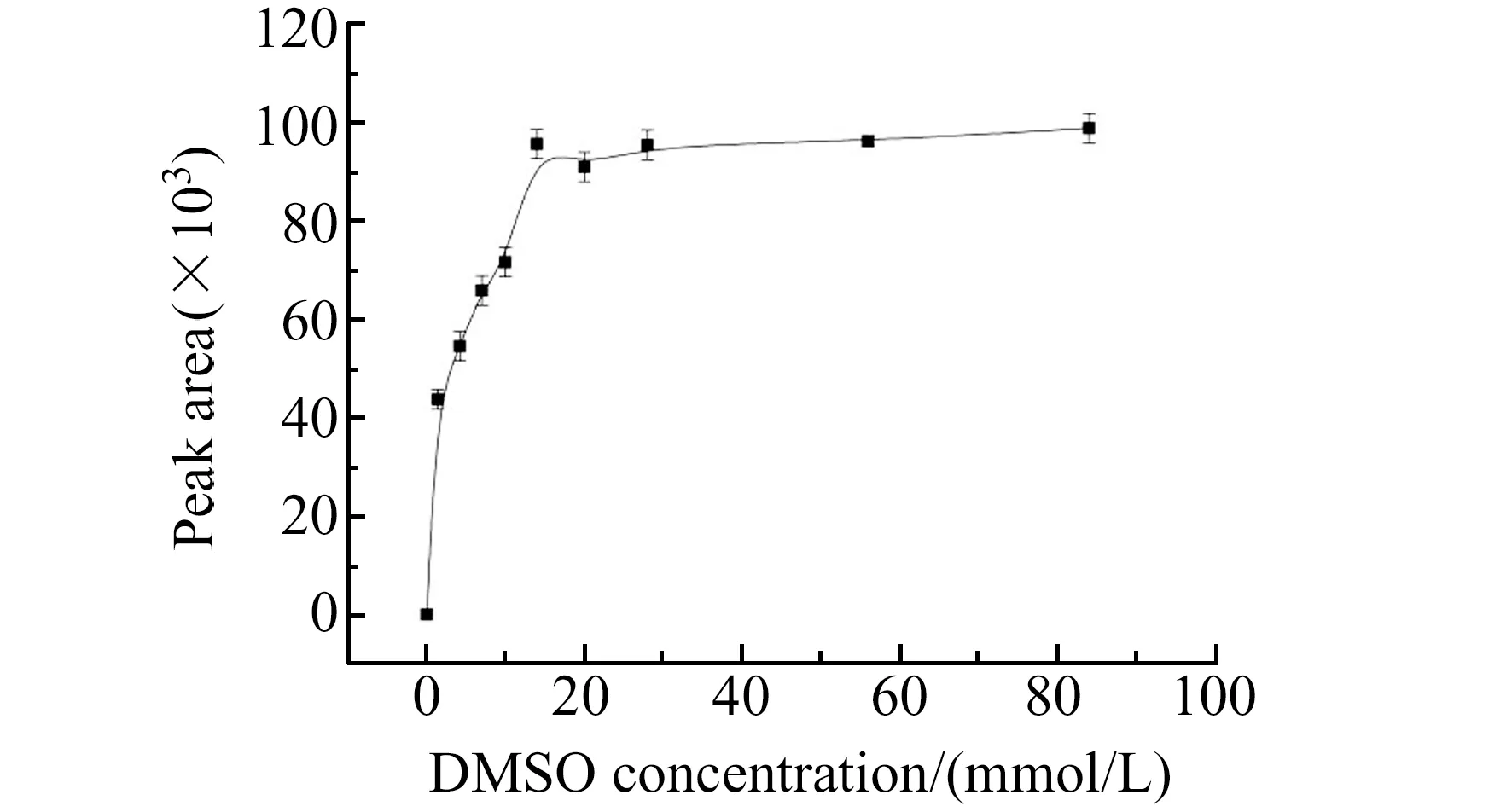
图5 DMSO浓度对羟基自由基捕获的影响Fig.5 Effect of DMSO concentration on the trapping of hydroxyl radicalsDNPH:270 μmol/L;derivatization temperature:50 ℃;derivatization time:30 min;pH=4.0.
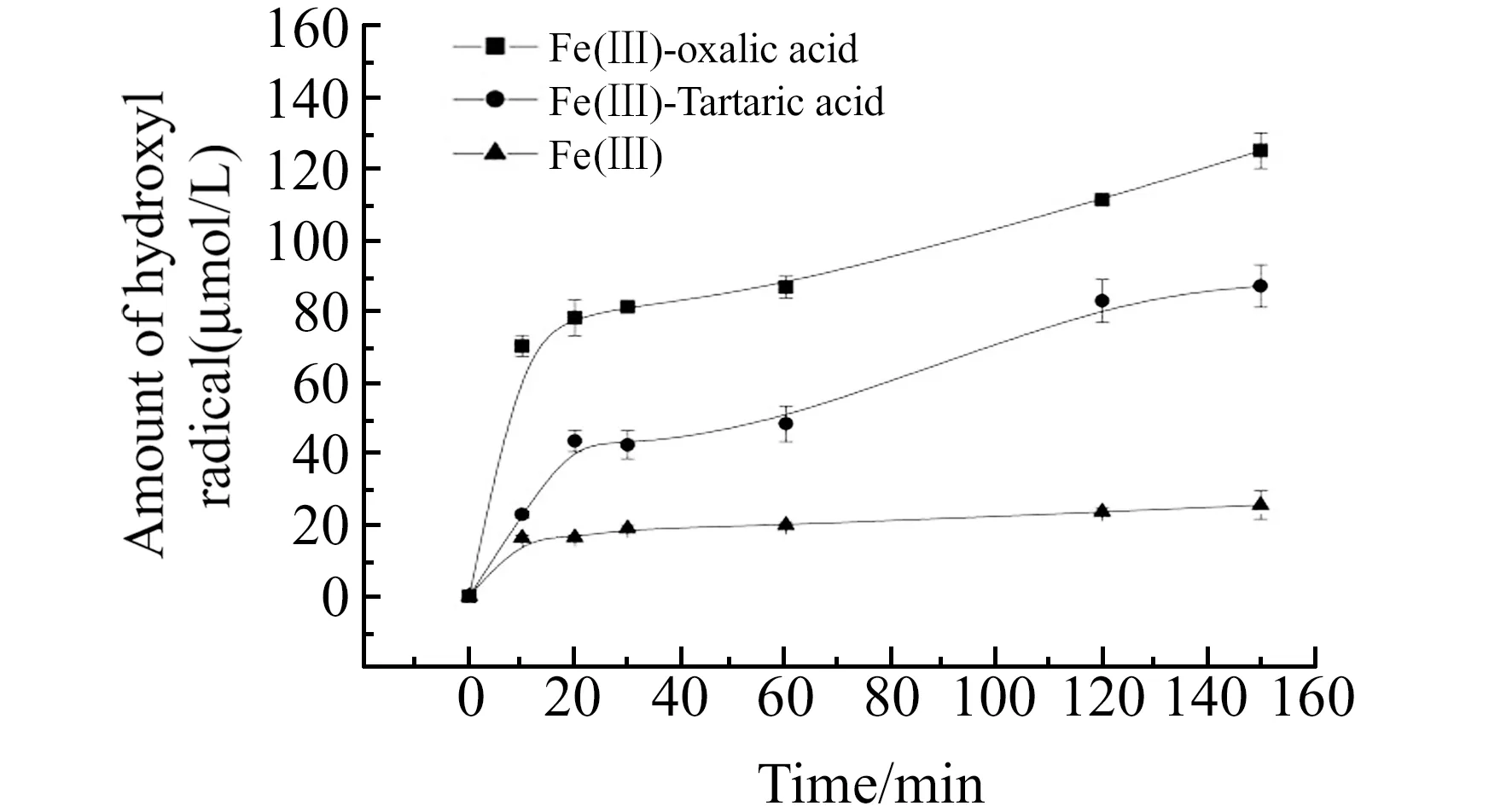
图6 不同羧酸铁体系在汞灯模拟光源下 ·OH的生成Fig.6 The generation of hydroxyl radicals of different Fe(Ⅲ)-carboxylic acid systems under mercury lamp
0~10 min时间范围内 ·OH的生成量迅速增加,随后增加速度减慢。对于三种体系中测定的 ·OH浓度变化进行动力学分析,结果符合表观零级反应动力学模型。由表2可知,在只有Fe(Ⅲ)存在的体系中 ·OH 的生成速率为 0.11 μmol/(L·min),而在Fe(Ⅲ)-草酸和Fe(Ⅲ)-酒石酸体系中分别为0.56 μmol/(L·min)、0.50 μmol/(L·min)。该实验结果表明,向UV-Fe(Ⅲ)体系中添加草酸或者酒石酸均显著增强 ·OH的光化学生成,提高了反应活性,有利于提高降解有机污染物的氧化性能,这一研究结果与文献报道[23]相一致。该结果意味着广泛存在于自然水体中的Fe(Ⅲ)和小分子羧酸的协同作用对于有机物的降解作用是不容忽视的,其相互作用的机理有待于更深一步的研究。

表2 UV-Fe(Ⅲ)-羧酸体系 ·OH生成反应的反应动力学分析(pH=3±0.05)
3 结论
本文利用DMSO作为反应的捕获剂,与 ·OH定量生成甲醛,甲醛和DNPH衍生成HCHO -DNPH,该衍生产物单一且稳定。在此基础上,以高效液相色谱进行分离后定量检测Fe(Ⅲ)催化的光反应体系中的 ·OH,并进行了方法学验证。将该方法应用于Fe(Ⅲ)-羧酸体系中 ·OH的测定,实验结果令人满意。值得注意的是,当反应体系中有较多的其他有机物时,甲氧自由基可能会与其他有机物发生甲基化反应,给 ·OH 的测定带来困难,因此本文所建立的方法不适用于有机底物较多的复杂体系中 ·OH的定量检测。

