微小隐孢子虫E2F样结构域包含转录因子CpELD基因的原核和真核表达
陈 宇,米荣升,龚海燕,程 龙,王 旭,韩先干,黄 燕,陈兆国
(中国农业科学院上海兽医研究所,农业农村部动物产品质量安全生物性危害因子风险评估实验室,农业农村部动物寄生虫学重点实验室,上海 200241)
通过控制DNA合成以及细胞分裂所需基因的表达,E2F转录因子可以调控动物和植物的细胞周期[1]。E2F蛋白包含一个DNA结合(DNA-binding,DB)结构域和一个二聚伙伴(dimerization partner,DP)结构域,以及反式激活结构域和口袋蛋白(pocket proteins)结合的残基[2]。E2F的活性由视网膜母细胞瘤(retinoblastoma protein,Rb)及其他“口袋”蛋白(pocket proteins)家族成员p107和p130调节,它们结合并抑制E2F活性,调控细胞增殖。除了细胞周期调节外,这些口袋蛋白-E2F复合物还是信号通路的关键节点,这些信号通路可触发多种细胞过程,包括增殖、分化、凋亡和应激反应。口袋蛋白的不当失活是癌细胞保持异常增殖的常见机制。口袋蛋白-E2F的解离及随后E2F的活化是由细胞周期蛋白依赖性激酶磷酸化(cyclin-dependent kinase phosphorylation)或病毒癌蛋白(viral oncoproteins,如SV40 T抗原)结合诱导的[1]。
E2F家族包含8个成员,其中5个(E2F1~E2F5)与口袋蛋白形成复合物。E2F1~E2F3与Rb特异结合,在细胞周期的G1期至S期作为转录的有效激活因子。这些“激活”的E2Fs也会特异性地诱导细胞凋亡。E2F4与所有3种口袋蛋白均可形成复合物,与E2F5一起被认为是一种抑制因子,常位于被抑制基因的启动子,抑制细胞分裂和促进细胞分化,从而在G0/G1期阻滞细胞周期,并在口袋蛋白释放时从细胞核中释放[1-2]。
顶复门原虫DNA结合蛋白的作用也已有所研究。Naor A等[3]发现,采用MYR依赖的弓形虫(Toxoplasmagondii)致密颗粒蛋白易位(MYR-dependent translocation of dense granule proteins)来诱发一系列重要宿主反应,与细胞周期尤其是包括细胞周期素E(cyclin E)在内的E2F转录因子的靶点有关。随后,该研究组发现了一种新的效应蛋白——HCE1,弓形虫将其输送到人类细胞的细胞核中,在那里调节多种基因的表达,包括编码细胞周期蛋白E基因。而细胞周期蛋白E是控制人类细胞何时分裂、是否分裂的最关键蛋白之一。作者发现,HCE1通过与特定的转录因子,即E2F3、E2F4和DP1结合而发挥作用,而这些转录因子通常精细地调控很多重要的通路,表明这些感染因子可利用人类细胞高效生长[4]。而顶复门原虫AP2 DNA结合蛋白(Apicomplexan AP2 DNA binding proteins,ApiAP2s)是一类经过验证的转录因子,作为分化的潜在调控因子已被广泛研究。以往的研究显示,单独的ApiAP2s敲除能够调节缓殖子的分化,但不能完全消除分化。与ApiAP2相对应的Myb样转录因子(Myb-like transcription factor1)缓殖子形成缺陷1(bradyzoite-formation deficient 1,BFD1)近期亦被鉴定为是细胞培养和小鼠感染时弓形虫分化的必需和充分的调控因子[5]。
与其他顶复门原虫相比,隐孢子虫(Cryptosporidiumspp.)调节因子的特性和功能研究还非常匮乏。Oberstaller J等[6]通过对3 281个基因在感染后7个时间点的基因表达谱进行了聚类分析,识别在体外上皮细胞培养的前72 h内表现出类似表达模式的基因。结果在基因簇的上游序列中发现了几个可能作为顺式调控元件的DNA基序,与蛋白质DNA结合位点数据相一致,排在超表达最前列的分别是E2F(5′-TGGCGCCA-3′)、G-box(5′-G.GGGG-3′)、ApiAP2结合基序(5′-TGCAT-3′),以及一个未知基序(5′-[A/C]AACTA-3′)。根据假定的ApiAP2转录因子cgd8-810序列,表达获得了一个重组微小隐孢子虫(Cryptosporidiumparvum)DNA结合蛋白结构域,采用蛋白结合微阵列确定了其结合特异性。研究结果表明,cgd8-810很可能与超表达的G-box基序结合,该ApiAP2转录因子参与了许多基因簇的调控。进一步研究发现,C.parvum对ApiAP2调节因子的依赖程度较低,部分原因是它利用了E2F/DP1转录因子[7]。
目前,隐孢子虫可用的分子遗传学研究工具非常少,也缺乏持续的体外培养和转染体系,需要通过动物宿主繁殖虫体,纯化足够数量的细胞内发育阶段虫体用于后续分子研究十分困难和昂贵,导致目前对C.parvum的基因调控知之甚少。本实验室在研究微小隐孢子虫类钙调蛋白(C.parvumcalmodulin-like protein,CpCML)互作蛋白时,通过酵母双杂交筛选到一个候选互作蛋白cgd8-1850,经BLASTA和生物信息学发现其可能是包含E2F样结构域的转录因子(C.parvumE2F like domain containing transcription factor,CpELD)。本研究拟对CpELD编码基因进行原核和真核表达,对其免疫反应性进行研究,为进一步验证其性质与功能,以及与CpCML的互作关系奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体、细胞、DNA 质粒pMD18T购自宝生物工程(大连)有限公司;原核表达载体pET32a、真核表达载体p3xFLAG CMV14和pCMV-HA(N)、293T细胞、微小隐孢子虫cDNA由本实验室保存提供。
1.1.2 主要试剂 KOD FX DNA聚合酶、DNA Marker DL 2000、DNA Marker DL5000、6×Loading Buffer、限制性内切酶(EcoRⅠ和KpnⅠ)购自宝生物工程(大连)有限公司;无缝克隆连接酶购自Invitrogen公司;蛋白质分子质量标准购自Thermo Fisher Scientific公司;AxyPrep DNA胶回收试剂盒购于Axygen公司;DH5α、BL21(DE3)感受态细胞购于北京全式金生物技术有限公司;Dulbecco's Modified Eagle's medium(DMEM)、胎牛血清、2.5 g/L Trypsin-0.53 mmoL/L EDTA、青霉素和链霉素(10 000 U/mL)均购自Gibco公司;Lipofectamine 2000购自Invitrogen公司;胰蛋白胨、酵母提取物均购自英国OXOID公司;脱脂奶粉购自BD公司;Ni-NTA-His结合树脂亲和层析购于Novagen;琼脂糖购自BLOWEST公司;辣根过氧化物 酶(HRP)、鼠抗Flag标签单抗、兔抗HA标签单抗、羊抗小鼠IgG-HRP、羊抗兔IgG-HRP购自Cell美国Signaling公司;胎牛血清购自GIBCO公司;PBS购自Solarbio公司;牛血清白蛋白(BSA)购自VWR公司;质粒小提试剂盒、无内毒素质粒大提试剂盒(内含核酸洗脱液 TB)、Enhanced HRP-DAB Charomogenic Substrate Kit均购自天根生化科技(北京)有限公司;预混合浓缩胶和预混合分离胶均购自新赛美生物科技有限公司;硝酸纤维素膜购自Whatman公司。其他试剂均为国产分析纯。
1.1.3 主要仪器 PCR仪(S1000TM Thermal Cycle)、垂直电泳仪(PwerPacTM HC High-Current)、Bio-RAD电泳槽(MINI 4)、ChemiDocTMTouchImaging System(ChemiDocTMTouch),美国Bio-RAD公司产品;分光光度计(NanoDrop 2000c),ThermoFisher公司产品;紫外分析仪(KH-UVⅢ),上海康禾光电仪器有限公司产品;微量恒温器(HW-8C型),绍兴市卫星医疗设备制造有限公司产品;微波炉(G80F20CN2L-B8),广东格兰仕电器公司产品;可调节恒温水槽(DK-8D),上海跃进医疗器械厂产品;精密电子天平(AL104),梅特勒-托利多仪器(上海)有限公司产品;Mini离心机(X1),韩国Gene公司产品;恒温生化培养箱(SPX-250B-Z),上海博讯实业有限公司医疗设备厂产品;-80℃冰箱(Heto Ultra Freeze UF5410),捷克Thermo Electron公司产品;-20℃冰箱(BC/BD-379H),青岛海尔股份有限公司产品;超净工作台(JJ-CJ-1FD),吴江市净化设备总厂产品;高速低温台式离心机(5810-R),德国Eppendorf公司产品;CO2培养箱(3110),Thermo Fisher Scientific公司产品;超声破碎仪(VCx750),美国Sonics公司产品。
1.2 方法
1.2.1 CpELD蛋白特性的初步生物信息学分析 从GenBank下载CpELD(登陆号:EAK89387)的氨基酸序列信息及其编码基因cpeld核苷酸序列,利用生物信息学分析网站cryptoDB在线分析蛋白的分子质量、等电点和氨基酸长度,并进行蛋白的功能预测。
1.2.2 引物的设计与合成 根据GenBank上cpeld基因序列(登陆号:EAK89387),应用Primer Primer5.0软件设计了原核和真核表达引物,分别在原核表达引物中插入限制性内切酶BamHⅠ和Hind Ⅲ(见表1);在真核表达引物中插入EcoRⅠ和KpnⅠ酶切位点以及保护性碱基,同时,在上游引物中加入了一段Kozak翻译起始序列(GCCACC)。根据GenBank中微小隐孢子虫CML基因序列(登录号:EAK87541),设计1对真核表达扩增引物(表1)。
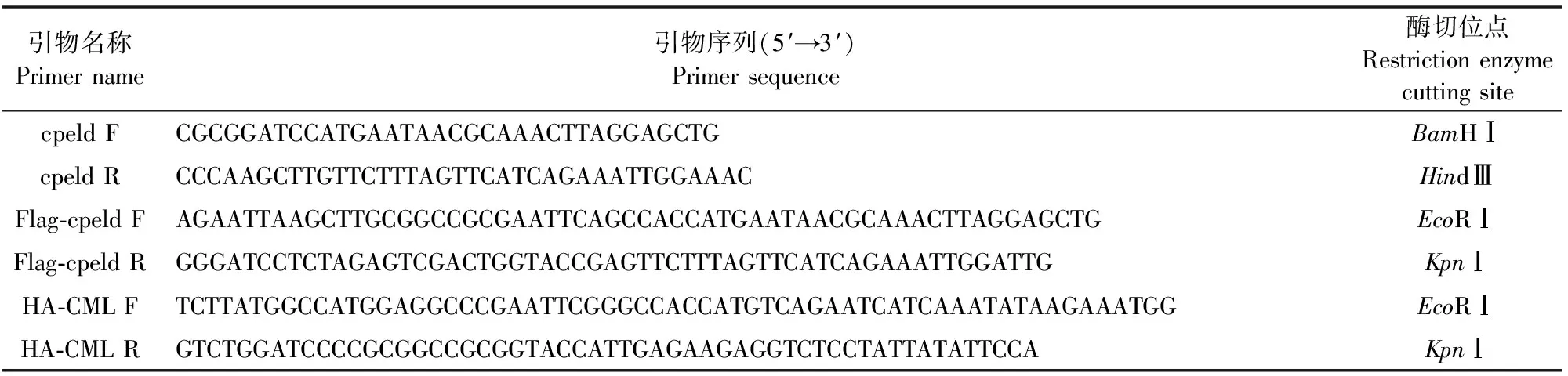
表1 PCR扩增所需的特异性引物
1.2.3cpeld基因的PCR扩增 以微小隐孢子虫cDNA为模版,分别以cpeld F、cpeld R为引物,扩增cpeld。以Flag-cpeld F、Flag-cpeld R和HA-CML F、HA-CML R扩增cpeld(e)和CML。在50 μL PCR反应体系中,包括ddH2O 13 μL,2×PCR缓冲液(Mg2+)25 μL,dNTP混合物(2.5 mmol/L)8 μL,上、下游引物(10 μmol/L)各0.5 μL,1 μL KOD FX(5 U/μL),cDNA模板2 μL。cpeldPCR反应条件:94℃ 3 min;94℃ 40 s,55℃ 40 s,72℃ 1 min,30个循环;72℃ 10 min。cpeld(e)反应条件:94℃ 3 min;94℃ 40 s,55℃ 40 s,72℃ 1 min,30个循环;72℃ 10 min。CML反应条件:94℃ 3 min;94℃ 40 s,55℃ 40 s,72℃ 1 min,30个循环;72℃ 10 min。扩增产物在12 g/L的琼脂糖凝胶上进行电泳,用胶回收试剂盒回收纯化扩增产物。
1.2.4 PCR扩增产物的克隆鉴定 将胶回收的cpeld基因片段用分光光度计测量核酸浓度后,连接到pMD18-T载体上,转化DH5α感受态细胞,在含有氨苄青霉素的平板上涂板培养后,挑取单菌落于LB培养基中培养,经PCR鉴定为阳性的转化菌送至上海擎科生物技术有限公司测序,并与NCBI上公布的基因序列比对。
1.2.5 原核和真核表达质粒构建 将鉴定正确的菌液用质粒小提试剂盒提取质粒,经BamHⅠ、Hind Ⅲ双酶切鉴定后通过T4连接酶连接到表达载体pET32a载体上,并转化到BL21(DE3)感受态细胞中,经PCR鉴定为阳性的转化菌送至上海擎科生物技术有限公司测序。将cpeld(e)和CML基因片段用无缝克隆连接酶分别连接到p3XFLAG-CMV14载体和pcmv-HA(N)载体上,转化DH5α感受态细胞中,经PCR、序列测定正确的转化菌用质粒小体试剂盒提取质粒DNA,用EcoRⅠ和KpnⅠ限制性内切酶进行双酶切,酶切产物在10 g/L琼脂糖凝胶上电泳鉴定。用无内毒素大提质粒试剂盒提取鉴定正确的重组质粒转化菌,用分光光度计测量浓度,命名p3XFLAG-CMV14-cpeld和pcmv-HA-CML。
1.2.6 原核表达 将鉴定正确的pET32a-cpeld重组质粒BL21(DE3)转化菌按1∶100的比例分别接种到含有50 μg/mL氨苄抗性的1L液体LB培养基中,于37℃中以200 r/min速度摇菌培养。当菌液OD值达到0.6时,取1 mL菌液作为阴性对照,剩余样品加入IPTG使终浓度为0.8 mmol/L,于37℃继续培养6 h。以8 000 r/min离心15 min收集菌体沉淀,用约35 mL的结合缓冲液重悬沉淀。在冰浴中超声破碎(400 W,超声5 s,停5 s)30 min。将超声产物在4℃下以14 000 r/min离心20 min,分别收集上清和沉淀,取30 μL制样并加入6×蛋白上样缓冲液,煮沸10 min,进行SDS-PAGE分析。
1.2.7 重组蛋白的纯化 在纯化柱里加入2 mL Ni-NTA-his结合树脂,用15 mL结合缓冲液洗涤树脂。将超声后的诱导产物上清加入纯化柱,重复3次以上,冰浴30 min后,加入10 mL洗涤缓冲液洗去除杂质。分别用5 mL的20、40、60、80、100、120、200、250 mmol/L浓度梯度的咪唑洗脱。分别收集流出样品,取30 μL制样并加入6×蛋白上样缓冲液,煮沸10 min后进行SDS-PAGE分析。
1.2.8 真核表达 将储存于液氮中的293T细胞复苏后,于37℃、50 mL/L CO2细胞培养箱中培养。将处于对数生长期的293T贴壁细胞用胰酶消化,按每孔0.3×106个细胞,以2 mL细胞完全培养液悬浮,置于6孔板中进行传代培养。约80%细胞融合时,以LipofectamineTM2000为转染试剂,参照说明书方法,分别共转染p3XFLAG-CMV14-cpeld和pcmv-HA-CML,以及p3XFLAG-CMV14和pcmv-HA(N)质粒。将转染细胞于37℃、5% CO2培养箱中培养细胞6 h后,把培养液更换为含20 mL/L胎牛血清的完全培养基,于37℃、5% CO2培养箱中培养24 h~36 h。
1.2.9 Western blot分析 收集纯化后原核表达产物超滤柱浓缩液30 μL,以pET32a空质粒转化大肠埃希氏菌超声裂解上清为对照,加入6×蛋白上样缓冲液,煮沸10 min后,取10 μL进行电泳分析。在转染了真核重组质粒的细胞中加入300 μL 细胞裂解液,收集细胞,离心后吸取上清50 μL,加入 10 μL的 6×蛋白上样缓冲液,煮沸离心后,取 15 μL用于电泳分析。将经SDS-PAGE电泳条带转印到硝酸纤维素膜上,4℃封闭过夜。原核表达产物一抗为鼠抗His单克隆抗体(1∶1 000 稀释),二抗为HRP标记的羊抗小鼠IgG(1∶5 000稀释);真核表达产物一抗为鼠抗Flag单抗和兔抗HA单抗(均为1∶1 000稀释),二抗为HRP标记的兔抗小鼠IgG(1∶5 000稀释)。用Enhanced HRP-DAB Charomogenic Substrate Kit反应5 min~10 min后拍照。
2 结果
2.1 CpELD理化特性的生物信息学初步分析
软件分析显示,CpELD有293个氨基酸残基,分子量为31.3 ku,等电点(pI)为7.2。染色体定位分析表明,cpeld分布在C.parvumIowa Ⅱ株的8号染色体上,无内含子,与Protein Data Bank(PDB)公布的1cf7的B链(1CF7-B)相似,一致性为37%。蛋白质特性分析发现,CpELD包含3个蛋白质资源信息系统(InterPro)公布的结构域PFAM(InterPro ID:IPR003316)、SMART(InterPro ID:IPR003316)和SUPERFAMILY(InterPro ID:IPR036390)。GO功能预测分析显示,该蛋白具有转录调节、DNA模板化功能;在细胞组成上,该蛋白可作为转录因子复合物;在分子功能上,该蛋白具有DNA结合转录因子活性。
2.2 cpeld及CML基因的PCR扩增
以微小隐孢子虫卵囊cDNA为模版,利用合成的特异性引物进行扩增,分别获得用于原核表达的cpeld、用于真核表达的cpeld(e)和CML基因,大小分别为882、940和720 bp(图1),与预期大小一致。序列测定结果显示,所获基因序列与NCBI上报道的cpeld(cgd8-1850)(登陆号:EAK89387)、CML基因序列(登录号:EAK87541)相同。

M.DNA标准DL 2 000;1~6.cpeld基因的PCR扩增产物;7~11.真核表达用cpeld(e)基因的PCR扩增产物;12~17.CML基因的PCR扩增产物;N.阴性对照
2.3 原核表达质粒的构建
重组质粒pMD18T-cpeld经BamHⅠ和Hind Ⅲ双酶切鉴定(图2),片段大小正确。将酶切产物胶回收后,与经BamHⅠ和Hind Ⅲ双酶切的pET32a载体连接,序列测定结果显示,重组质粒pET32a-cpeld插入片段位点正确,无碱基突变。

M.DNA标准DL 2 000;1~4.重组质粒pMD18T-cpeld的双酶切产物;5.未酶切的重组质粒pMD18T-cpeld DNA
2.4 原核表达纯化
用T4-DNA连接酶将cpeld连接到PET-32a载体上,将重组质粒pET32a-cpeld转化的到大肠埃希氏菌BL21(DE3)经中表达重组融合蛋白。蛋白经SDS-PAGE分析,在IPTG浓度为0.8 mmol/LIPTG,37℃诱导6 h后时,SDS-PAGE分析显示出现明显的表达条带,大小约为55 ku(图3)。经Ni-NTA-His结合树脂亲和纯化,考马斯蓝染色显示,诱导的pET32a-cpeld重组质粒转化菌上清经纯化后得到一条大小约55 ku的蛋白条带,与预期分子质量一致(图4)。

M.低蛋白分子质量标准;1~5.转入pET32a-cpeld的BL21(DE3)诱导1、3、5、6、8 h;6.诱导6 h的pET32a-cpeld转化BL21(DE3)裂解产物上清;7.诱导6 h的pET32a-cpeld转化BL21(DE3)裂解产物沉淀;N.转入pET32a质粒的BL21(DE3)诱导产物

M.低分子质量蛋白质标准;1~9.20、40、60、80、100、120、200、250 mmol/L咪唑洗脱产物
2.5 真核表达载体的构建
采用无缝克隆方法,将p3XFLAG-CMV14和pcmv-HA(N)载体EcoRⅠ和KpnⅠ双酶切产物,分别与cpeld及CMLPCR产物用无缝克隆连接酶连接,重组质粒p3XFLAG-CMV14-cpeld和B:pcmv-HA-CML经序列测定,发现无碱基突变。
2.6 Western blot 分析
用小鼠抗His单克隆抗体反应,结果显示,pET32a-cpeld转化菌上清纯化产物在大小约55 ku处出现明显的反应条带,而空质粒转化菌无反应条带;共转染p3XFLAG-CMV14-cpeld和pcmv-HA-CML质粒的293T细胞蛋白,用鼠抗Flag、兔抗HA标签抗体反应,结果分别在大小约为38 ku、27 ku处出现明显的反应条带,与预期大小相符;而共转染了p3XFLAG-CMV14、pcmv-HA(N)空载体的293T细胞组均未出现反应条带(图5)。

M.蛋白质分子质量标准;1.pET32a转化的大肠埃希氏菌裂解液上清与鼠抗His单克隆抗体反应;2.pET32a-cpeld转化菌上清纯化产物与鼠抗His单克隆抗体反应;3.p3XFLAG-CMV14空载体转染的293T细胞,一抗为鼠抗Flag标签抗体;4.共转染p3XFLAG-CMV14-cpeld和pcmv-HA-CML质粒的293T细胞蛋白,一抗为鼠抗Flag标签抗体;5.共转染p3XFLAG-CMV14-cpeld和pcmv-HA-CML质粒的293T细胞蛋白,一抗为兔抗HA标签抗体;6.pcmv-HA(N)空载体共转染的293T细胞蛋白,一抗为兔抗HA标签抗体
3 讨论
关于微小隐孢子虫CML的研究报道较少,其特性和功能并不十分清楚。通过查找与其互作的蛋白,有助于深入了解其功能和作用机制。实验室在前期工作中,利用酵母双杂交技术筛选与微小隐孢子虫CML互作的蛋白时,发现其中一个蛋白为CpELD。本研究利用在线生物信息学软件发现,CpELD包含3个蛋白质资源信息系统(InterPro)公布的结构域:PFAM(InterPro ID:IPR003316)、SMART(InterPro ID:IPR003316)和SUPERFAMILY(InterPro ID:IPR036390)。其中PFAM被描述为E2F/DP家族翼螺旋DNA结合域(E2F/DP family winged-helix DNA-binding domain);SUPERFAMILY被描述为翼螺旋DNA结合域(winged helix DNA-binding domain)。GO功能预测分析显示,在生化过程中,该蛋白具有转录调节、DNA模板化功能;在细胞组成上,该蛋白可作为转录因子复合物;在分子功能上,该蛋白具有DNA结合转录因子活性。蛋白结构分析显示,CpELD与PDB中公布的1cf7的B链(1CF7-B)相似,一致性为37%。1cf7是异二聚体细胞周期转录因子E2F-DP识别DNA的结构基础(structural basis of DNA recognition by the heterodimeric cell cycle transcription factor E2F-DP),在细胞分裂过程中,E2F/DP(E2 factor)转录因子能调控G期到M期调控基因的表达,故 E2F/DP 转录因子家族是调节动、植物体细胞周期的“开关分子”[8],对其功能和作用机制的研究,有助于深入了解隐孢子虫的发育调控机制,具有重要的理论和实用价值。
为获得表达水平高、易于溶解和纯化的蛋白产物,选择一个合适的表达系统十分重要的。现有的基因表达系统主要包括真核和原核两大系统,其中原核表达系统主要为大肠埃希氏菌表达系统。本研究通过构建原核和真核表达质粒来分别进行研究,原核表达采用了pET32a表达载体,该载体表达效率高,表达的重组蛋白含有His,为后期使用Ni-NTA-His结合树脂进行亲和层析纯化提供了方便,并且His标签小,故对蛋白质空间结构影响小。SDS-PAGE分析显示,诱导的重组质粒转化菌裂解上清和沉淀都出现了明显区别于诱导的空载体转化菌裂解物,在上清和沉淀中均有目的蛋白。由于上清中的目的蛋白是以可溶形式存在,利于纯化,具有活性的可能性较大,便于后续验证与CML相互作用研究,所以本试验选择了上清中的重组蛋白。经Ni-NTA-His结合树脂亲和层析法对可溶表达的目的蛋白进行纯化,Western blot分析显示,纯化的融合蛋白能被鼠抗His标签单抗识别,在分子质量约为55 ku处出现反应条带,与预期大小一致,而阴性对照没有相同的条带,表明重组表达的rCpELD具有良好的反应原性。
为便于后续利用免疫共沉淀等技术验证CpCML与CpELD互作,本研究成功地构建了微小隐孢子虫cpeld(cgd8-1850)、CpCML基因的重组真核表达质粒p3XFLAG-CMV14-cpeld和pcmv-HA-CML,转染293T细胞后,Western blot试验发现分别在约38 ku和27 ku处出现清晰的反应条带,与目的蛋白大小一致,表明构建的重组质粒p3XFLAG-CMV14-cpeld和pcmv-HA-CML在293T细胞中成功地进行了高效表达,且表达蛋白的反应原性良好。表达蛋白带有Flag和HA标签,利于后续的纯化。构建的真核重组质粒能够在宿主体内成功转录和表达,是验证蛋白互作的前提;同时,真核表达蛋白拥有多种翻译后修饰功能,通常拥有与体内相似的生物学活性,便于后续进行其在宿主细胞中的功能研究。例如,很多真核细胞表达蛋白为分泌性的糖基化蛋白,避免了原核表达系统蛋白的变性复性,蛋白带有糖基化修饰,更接近蛋白的天然结构[9],利于反映蛋白相互作用的真实情况。
本研究构建了微小隐孢子虫E2F样结构域的转录因子编码基因cpeld的原核和真核表达质粒pET32a-cpeld和p3XFLAG-CMV14-cpeld,同时构建了可能与其互作的微小隐孢子虫类钙调蛋白编码基因的真核表达质粒pcmv-HA-CML,实现了cpeld基因的原核和真核表达、CML基因的真核表达,Western blot试验证实表达的重组蛋白具有良好的反应原性,为后续开展CpELD、CpCML的互作关系验证,以及其特性和功能研究打下了基础。

