非洲猪瘟病毒PCR检测方法的建立
李云灿,胡剑武,赵俊龙,李家奎*
(1.西藏农牧学院动物科学学院,西藏林芝 860000; 2.西藏自治区兽医生物药品制造厂,西藏拉萨 850003; 3.华中农业大学动物医学院,湖北武汉 430070)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染家猪和野猪引起的一种出血性病毒病[1]。ASFV感染猪的临诊表现为呼吸障碍、皮肤以及脏器广泛出血等,对养猪业危害严重,被纳入世界动物卫生组织(OIE)通报性疾病名录中[2]。非洲猪瘟疫情最早可追溯到20世纪初期。在1921年,Montgomery进行了有关肯尼亚1909年至1915年家猪疫情的系统研究后,发现此病并首次报道[3]。随后,在中非和南非也发现了这种病毒。1957年在里斯本首次发现该病,并迅速传播到欧洲其他国家,美洲国家也受到了ASFV的影响[4]。非洲猪瘟的流行,给这些国家的养殖业造成了毁灭性的打击[5]。2018年8月,中国沈阳出现一例疑似疫情,该疫情随后被权威部门确诊为非洲猪瘟[6]。随后各省相继有疫情发生,疫情范围持续扩大。2019年4月,中国农业和农村部发布通知,中国西藏地域发现了该类疫情,危害的地区主要集中在林芝市及周边区域。林芝地区是我国藏猪的主要产区,藏猪是该地独有的高海拔地方性品种猪。由于藏猪传统的放牧饲养方法,导致疾病易于传播,非洲猪瘟的流行给当地藏猪养殖业造成重大损失[7]。聚合酶链反应(PCR)是现阶段检测方法中最成熟的分子生物学检测技术,被广泛应用于各个领域[8]。因此,建立一种针对非洲猪瘟病毒的快速PCR检测方法对于预防和诊断非洲猪瘟具有重要意义。
1 材料与方法
1.1 材料
1.1.1 毒株 VP72基因片段,武汉生工生物工程有限公司提供;用于特异性试验的病毒:经典猪瘟病毒(CSFV,疫苗C株),广东永顺生物技术有限公司提供;猪伪狂犬病病毒(PRV,HB-98株),武汉科前生物股份有限公司提供;猪圆环病毒2型(PCV2,LG疫苗株)、猪细小病毒(PPV,N疫苗株)、猪流行性腹泻病毒(PEDV,疫苗CV777株)、轮状病毒(RV,疫苗NX株),哈尔滨维科生物技术开发公司提供。
1.1.2 试剂 2×EasyTaqPCR Super Mix(dye)、DNA标准DL2000,北京全式金生物技术有限公司产品;dNTP、Taq®酶及反应缓冲液,宝生物工程(大连)有限公司产品;病毒基因组DNA/RNA提取试剂盒,天根生化科技北京有限公司产品;反转录试剂盒,美国Thermo Scientific公司产品;溴化乙锭(EB),美国Sigma公司产品;琼脂糖,英国Oxoid公司产品。
1.1.3 仪器设备 恒温双列四孔型恒温水浴锅(DK-98-ⅡA),天津泰斯特仪器有限公司产品;台式冷冻离心机(CT15RE),日立公司产品;生物安全柜(BSC-1100-LⅡB2),北京东联哈尔仪器制造有限公司产品;PCR仪(TC-XP),杭州博日科技有限公司产品;双稳定时电泳仪电源(DYY-6C),北京六一生物科技有限公司产品;全自动数码凝胶图像分析系统(1600/1600R),上海天能科技有限公司产品。
1.2 方法
1.2.1 引物设计 本试验参照GenBank上公布的非洲猪瘟病毒(ASFV)VP72基因序列,使用Primer Premier软件设计检测ASFV的PCR引物。ASFV-539F:ATGCCGATACCACAAGAT;ASFV-539R:TAACCACCACGATGAAAA,目的片段长度539 bp。OIE推荐的ASFV PCR引物序列为,OIE-F:ATGGATACCGAGGGAATAGC;OIE-R:CTTACCGATGAAAATGATAC,目的片段长度278 bp[9]。引物均由武汉生工生物工程有限公司合成。
1.2.2 方法的建立 以合成的VP72基因片段作为阳性对照,建立PCR方法,反应体系(25 μL)如下:2×EasyTaqPCR Super Mix(dye)13 μL,ddH2O 8 μL,模板DNA 2 μL,上、下游引物各1 μL。扩增条件为:94℃预变性5 min;94℃变性30 s,49℃退火30 s,72℃延伸30 s,共35个循环;最后72℃后延伸10 min。PCR扩增产物在10 g/L琼脂糖中进行凝胶电泳,根据凝胶图像分析系统显示的目的条带判断。
1.2.3 特异性试验 按照病毒基因组DNA/RNA提取试剂盒说明书分别提取经典猪瘟病毒、猪流行性腹泻病毒、猪伪狂犬病病毒等疫苗的核酸,并通过反转录的方法得到经典猪瘟病毒、猪流行性腹泻病毒、轮状病毒的cDNA。随后进行本试验引物和OIE引物的特异性反应。
1.2.4 敏感性试验 以合成的VP72基因片段作为模板进行10倍梯度稀释,共设15个梯度。使用本试验引物和OIE推荐引物分别进行PCR反应。
2 结果
2.1 特异性试验结果
按照方法1.2.3进行特异性试验,结果显示两种引物在特异性方面均表现良好,只有合成的VP72基因片段呈现目的条带,如图1(A、B)所示。
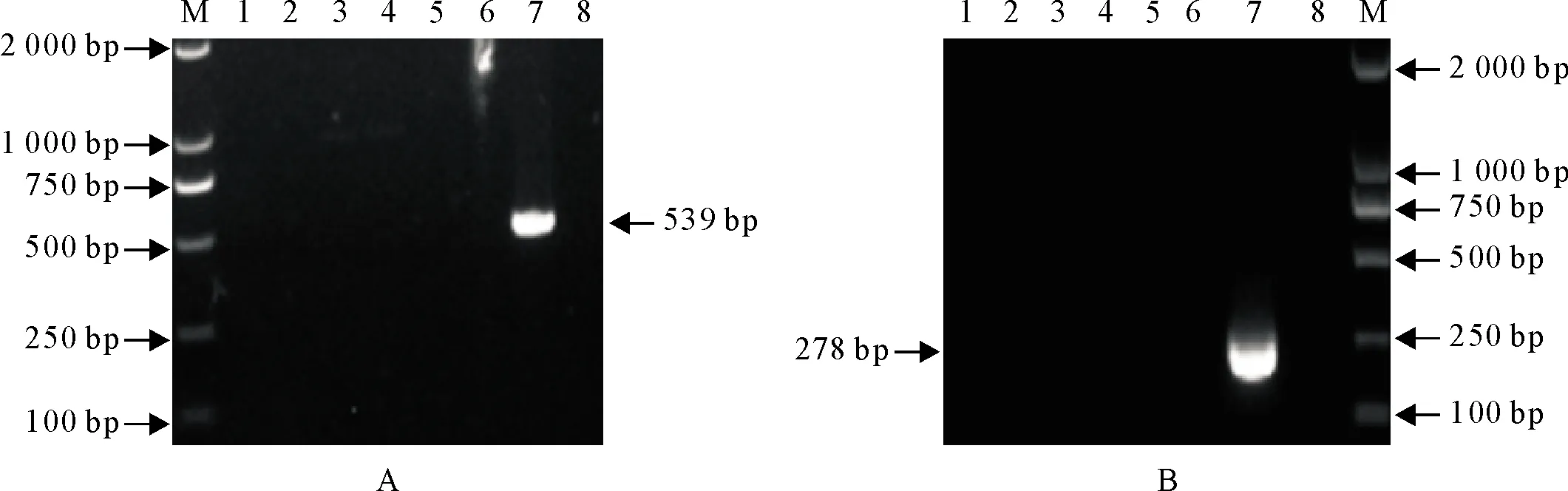
A.本试验设计引物; B.OIE推荐引物; M.DNA标准DL 2 000; 1.经典猪瘟病毒; 2.猪流行性腹泻病毒; 3.轮状病毒; 4.伪狂犬病病毒; 5.猪圆环Ⅱ型病毒; 6.猪细小病毒; 7.阳性; 8.阴性
2.2 敏感性试验结果
两对引物敏感性试验的凝胶电泳检测结果如图2(A、B)所示,本试验设计的特异性引物和OIE推荐引物PCR最低检测限分别达到10-8和10-7。两对引物的敏感性试验结果表明,本试验设计的引物比OIE推荐使用的引物敏感性高10倍。

A.本试验设计引物; B.OIE推荐引物; M.DNA标准DL 2 000; 1~15.以合成的VP72基因片段为模板10倍梯度稀释10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10、10-11、10-12、10-13、10-14、10-15; 16.阴性对照; 17.阳性对照
3 讨论
中国出现非洲猪瘟以来,该病对中国的猪养殖业造成了致命性打击。虽然疫情是突然发生的,但中国相关部门也迅速制定并实施了相应的应急措施。截止2019年初,非洲猪瘟疫情在中国共计发生98起,发病范围涵盖23个省(直辖市)区。2019年4月,西藏自治区首次发生。现阶段疫情发生规模和形势而言,疫情依然呈现零星、散发态势[10-11]。畜牧业是西藏重要的基础产业之一,但当前该产业受到了非洲猪瘟流行的严重威胁和挑战,如何对非洲猪瘟进行防控以及快速检测非洲猪瘟病毒,并采取合理的措施是非常重要的。
目前检测非洲猪瘟病毒的方法有细胞接种、酶联免疫吸附试验(ELISA)、环介导等温扩增(LAMP)、聚合酶链反应(PCR)、实时定量PCR(real-time PCR)等。由于ASFV不易在常规细胞上生长,同时还存在着散毒的隐患。ELISA用于检测其抗体水平的高低,不能用于ASF的确诊。LAMP操作简单且灵敏性高,但易形成气溶胶污染,其假阳性问题较为严重。而real-time PCR容易出现污染且成本较高。PCR方法普遍用于诊断多种动物疫病,特别对于诊断中、低毒力感染或慢性病例非常有用,是早期诊断的首选[12-13]。早在20世纪90年代初,Steiger等就选取非洲猪瘟病毒基因序列的保守区段设计引物,用于ASFV的特异性检测。尽管该方法在检测红细胞样品时容易出现非特异性DNA带,但PCR检测ASFV所表现出来的灵敏、快速和简便的特性,显著地好于一些常规的检测方法。
King D P等[9]和Aguero M等[14]建立了非洲猪瘟病毒的PCR检测方法,后来该方法被世界动物卫生组织(OIE)采用。此后,国内外的很多学者陆续发表关于非洲猪瘟病毒PCR方法建立的论文[15-16]。本试验以VP72基因序列为靶标,设计PCR引物用于特异性检测非洲猪瘟病毒,并进行特异性及敏感性试验。试验结果显示,本试验设计的PCR检测引物检测猪常见病毒均无交叉反应,特异性良好,同时引物敏感性可达到10-8。而OIE推荐使用引物PCR最低检测限为10-7,本试验设计的PCR引物敏感性比OIE推荐引物高出10倍。在非洲猪瘟盛行的情况下,要想在最短的时间内根除病原,就必须及早地通过诊断来发现疫情。ASF诊断是为了预防疾病的传播,增强PCR方法的敏感性对环境样品和潜伏期病毒的检测十分重要。本试验设计的PCR引物在非洲猪瘟病毒的临床检测和早期预警中具有更大的优势,为非洲猪瘟的预防和控制提供了一种更灵敏的诊断方法,值得在生猪生产中推广应用。

