一株鸡大肠埃希氏菌裂解性噬菌体的分离与生物学特性分析
吴圆圆,屈勇刚*,于会举,谷思颖,魏 其,梁 晏,吴 勤,张湘莉兰,童贻刚
(1.石河子大学动物科技学院,石河子 832003;2.石河子大学分析测试中心,石河子 832003;3.军事医学科学院微生物流行病研究所,北京 100071;4.北京化工大学生命科学与技术学院,北京 100029)
大肠埃希氏菌(Escherichiacoli)是肠杆菌科(Enterobacteriaceae)埃希氏菌属(Escherichia)成员之一[1],一般不致病,多为条件致病菌。1894年,首次有了关于鸡大肠埃希氏菌的报道,随后世界养禽业发达国家和地区逐渐有了关于大肠杆菌病不同病型的报道[2-5],由多种致病因子结合的禽致病性大肠埃希氏菌(Avian pathogenicE.coli,APEC),可导致禽类的多种症状,最常见的是死胚、败血症、心包炎、卵黄性腹膜炎、关节炎、气囊炎、肉芽肿等[6-7]。由于临床上抗菌药物的长期、不合理使用,导致耐药菌株不断增多[8]。因此,急切地需要新型药物的研发,以控制耐药性致病菌引起的感染。噬菌体是一种广泛存在于自然界中的病毒,对其宿主菌具有高效特异性的感染,并且不出现耐药性。近年来噬菌体已应用于临床疾病的治疗,并具有良好的效果[9-13]。在现今鸡大肠杆菌病治疗的基础上,笔者以本实验室前期分离得的鸡致病性大肠埃希氏菌为宿主菌分离噬菌体,经过筛选得到一株裂解性噬菌体,分析了其部分其生物学特征,并进行了全基因组测序及分析,为该噬菌体用于临床治疗提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株和水样 45株鸡大肠埃希氏菌均由石河子大学动物传染病实验室分离鉴定与保存,污水采于石河子市及周边养鸡场。
1.1.2 主要试剂 DNaseI、RNase A、Mung Bean Nuclease、病毒总基因提取试剂盒为TaKaRa公司产品;PEG4000为天津市科密欧化学试剂开发中心产品;SM缓冲液、PBS缓冲液、LB的液体/半固体/固体培养基均在石河子大学动科院传染病实验室进行常规配制所得。
1.1.3 主要仪器 高速冷冻离心机(Multifuge XLR),美国赛默飞世尔科技有限公司产品;透射电子显微镜(HT7700),日立(中国)有限公司产品;测序仪(Miseq),美国Illumina公司产品。
1.2 方法
1.2.1 宿主菌的准备 将本实验室保存于-80℃超低温冰箱中的45株鸡大肠埃希氏菌置于4℃环境下解冻。挑取在LB固体平板上划线生长出的单一菌落分别接种于5 mL液体LB培养基中,于37℃、160 r/min条件下过夜富集培养,后置4℃保存。
1.2.2 噬菌体的分离与纯化 参考文献[14-15]方法将污水水样依次经过无菌纱布和滤纸过滤,得到的滤液置于4℃过夜后,再用0.22 μm滤膜过滤除菌。取除菌的污水滤液与45株鸡大肠埃希氏菌各菌悬液依次加于液体LB培养基中,于锥形瓶中混匀,室温静止15 min,37℃、160 r/min培养7 h并于4℃过夜,10 000 r/min离心10 min,取上清液分别与45株鸡大肠埃希氏菌菌悬液混合吸附后,用双层琼脂平板法过夜培养进行噬菌体的分离。
用无菌牙签挑取生长良好的单个噬菌空斑至于100 μL相应宿主菌,吸附反应15 min,加入5 mL 液体LB培养基中,振荡培养5 h,将离心倍比稀释的培养液与宿主菌混合均匀后采用双层琼脂法培养,如此过程重复3次以上,直至在一个平板上形成形态单一的噬菌斑。即可得到纯的噬菌体原液,将其置于-80℃(与500 mL/L甘油等体积混匀)保存和4℃备用。
1.2.3 噬菌体的浓缩及电镜观察 参考文献[16],采用超速离心法,进行噬菌体浓缩,将裂解液上清在4℃下24 446×g,离心1.5 h,用 SM缓冲液轻轻洗脱重悬每个离心管中的沉淀,最后将得到的浓缩液收集在1.5 mL无菌离心管中保存于-80℃备用。取20 μL噬菌体浓缩液滴于载玻片上,用精细镊子轻轻夹取铜网(200目)放于噬菌体浓缩液液滴上,室温下吸附2 min后取出,放于吸水纸上,去除铜网上的液体,滴一滴20 g/L的磷钨酸染液在铜网上,静置染色3 min取出,放于吸水纸上,用红外灯照射30 min,以彻底除去水分与有害杂质后,用HT7700透射电子显微镜观察噬菌体的形态。
1.2.4 噬菌体核酸类型的鉴定 噬菌体基因组的提取严格按照病毒基因DNA/RNA提取试剂盒说明书中的操作步骤进行,将提取的核酸于37℃水浴条件下,用DNase Ⅰ、RNase A与Mung Bean Nuclease分别对噬菌体的基因组消化2 h后,采用琼脂凝胶电泳法对消化产物进行检测。
1.2.5 噬菌体全基因组的测序 将噬菌体基因组处理为约290 bp的测序文库,利用Miseq测序仪完成测序工作,使用软件Newbler 2.9与CLC 3.0对得到的基因组序列进行序列组装。测序工作由北京军事医学科学院微生物学流行病学研究所完成。利用MEGA7.0对所得序列进行亲缘关系的构建。
1.2.6 噬菌体裂解谱的测定 取100 μL噬菌体原液以1∶1分别与被调查的45株鸡大肠埃希氏菌菌悬液吸附反应15 min,双层琼脂法过夜培养,观察结果。
1.2.7 噬菌体最佳感染复数(multiplicity of infection,MOI)的测定 将宿主菌培养至OD600≈0.5(对数生长期),以固定的对数宿主菌液(100 μL),按照感染复数分别为0.000 000 1、0.000 001、0.000 01、0.000 1、0.001、0.01、0.1、1的比例加入相应体积的噬菌体液并混匀,静置吸附15 min,均补加LB液体培养基至2 mL,振荡培养4 h。10 000 r/min离心10 min,取上清,10倍倍比稀释后,与培养至对数期的菌液混合吸附,用双层琼脂法测定上述比例培养液的噬菌体滴度,滴度最高者即为最佳MOI。
1.2.8 噬菌体一步生长曲线的测定 将培养至对数期的菌液(100 ml)与噬菌体液按MOI=0.001混匀,并在静置吸附20 min后补加LB至200 mL,此为时间0,37℃、160 r/min,在0 min、5 min、10 min、15 min、20 min、25 min、30 min、40 min、50 min、60 min、70 min、80 min、90 min、110 min、130 min、150 min、170 min、190 min、210 min,19个时间点各取2 mL,离心、稀释、吸附,做3次重复试验,每次2个平行,采用双层琼脂法测定噬菌体滴度,并根据滴度绘制噬菌体感染宿主菌的一步生长曲线。
1.2.9 噬菌体pH敏感性的测定 取100 μL噬菌体液分别接种于900 μL不同pH(pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0)的LB液中,37℃水浴孵育2 h,稀释、吸附,用双层琼脂法测定噬菌体滴度。观察噬菌体的生长情况,绘制曲线。
1.2.10 噬菌体耐热稳定性的测定 分别取300 μL 效价为5.5×109PFU/mL的噬菌体原液于若干灭菌离心管中,将之分别置于40、50、60、70、80℃条件下处理,在0 min、20 min、40 min、60 min、80 min、100 min、120 min、140 min、160 min、180 min,10个时间点取样并迅速放置于4℃,稀释、吸附、倒板,测定其不同温度下、不同时间点噬菌体的滴度,绘制热稳定性曲线。
2 结果
2.1 噬菌体的分离与纯化
本试验以45株鸡大肠埃希氏菌与污水水样共培养,采用双层琼脂平板法经5次反复纯化,在平板上生长的噬菌斑形态、大小均单一,得到1株裂解性噬菌体,其噬菌斑形态和大小见图1,噬菌斑呈透亮的圆形,直径0.8 mm~1.1 mm,边缘整齐无晕环,将此噬菌体命名为vB-EcoM-IME540。
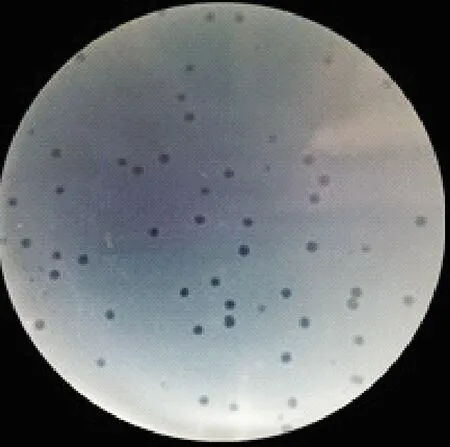
图1 噬菌体vB-EcoM-IME540的噬菌斑形态
2.2 噬菌体的电镜形态
透射电镜观察结果,如图2所示,噬菌体vB-EcoM-IME540的头部呈椭圆形且尾部具有收缩性,头尾被颈圈分开,头大小约106.7 nm×73.3 nm,尾长约140 nm×16.7 nm。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)在2011年发布的第9次报告中噬菌体的分类与命名标准,噬菌体vB-EcoM-IME540属有尾噬菌体目(Caudovirales),肌尾噬菌体科(Myoviridae)。

图2 噬菌体vB-EcoM-IME540的透射电镜照片
2.3 噬菌体的核酸类型鉴定
噬菌体核酸琼脂凝胶电泳结果,如图3所示,噬菌体vB-EcoM-IME540的核酸只能被DNase Ⅰ消化,却不能被RNase A与Mung Bean Nuclease消化,表明该噬菌体核酸为双链DNA(Double-stranded DNA,dsDNA)。
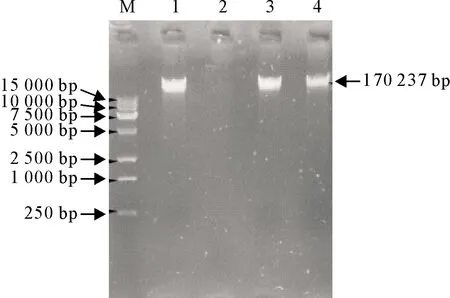
M.DNA标准DL 15 000;1.vB_EcoM-IME540核酸;2.DNase Ⅰ;3.RNase A;4.Mung Bean Nuclease
2.4 噬菌体的全基因组测序及亲缘性分析
由测序结果可知,噬菌体vB-EcoM-IME540的全基因组大小为170 237 bp,G+C含量为39.46 %,在DNAMan上序列组成分别为A:30.7%、C:19.1%、G:20.3%、T:29.8%,由此可知此噬菌体的核酸类型为dsDNA。利用MEGA7.0.26与NCBI上基因库中的亲缘噬菌体进行基因比对,制作其系统进化树如图4,通过Blastn发现vB-EcoM-IME540与NCBI上发布的大肠杆菌噬菌体Bp7的相似性为97.44%(Bp7的GenBank登录号为NC019500.1),并已知大肠杆菌噬菌体Bp7是肌尾科噬菌体,结合电镜形态观察可将噬菌体vB-EcoM-IME540归类为肌尾噬菌体家族。
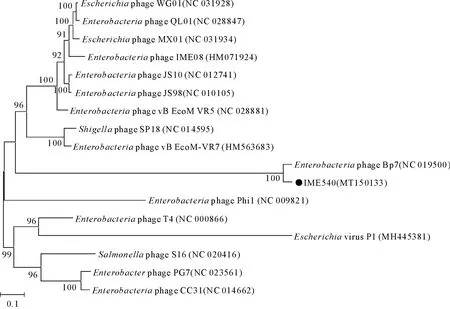
图4 噬菌体vB_EcoM_IME540的系统进化树
2.5 噬菌体的裂解谱
噬菌体vB-EcoM-IME540与45株鸡大肠埃希氏菌作用,测定其裂解谱,结果发现噬菌体vB-EcoM-IME540只对其中3株鸡大肠埃希氏菌有裂解作用,裂解率约为6.67%(3/45)。
2.6 噬菌体的最佳MOI
不同比例的噬菌体与宿主菌反应时,子代噬菌体的产生情况也大不相同,试验结果表明,当MOI=0.000 001时,产生的子代噬菌体滴度最高,见图5。因此,噬菌体vB-EcoM-IME540感染宿主菌的最佳MOI为0.000 001。
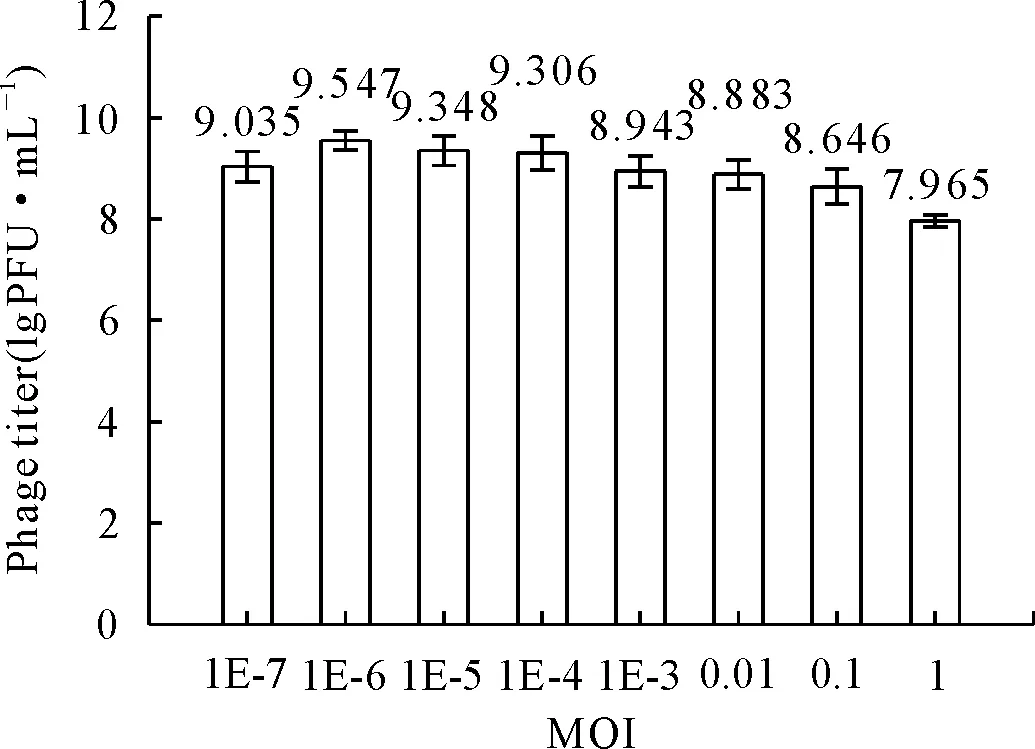
图5 噬菌体vB-EcoM-IME540的感染复数
2.7 噬菌体的一步生长曲线
裂解性噬菌体的感染过程经历吸附、穿入、合成与裂解释放4个阶段,可用一步生长曲线进行描述与展示。从图6可以清晰地看出,噬菌体vB-EcoM-IME540增殖的潜伏期、裂解期、平稳期以及裂解量;其中潜伏期大约为20 min,裂解爆发期约为130 min,裂解量约为23 PFU/cell;大约在噬菌体感染宿主菌的150 min进入平稳期,此时宿主菌全部裂解,噬菌体数量达到最高。
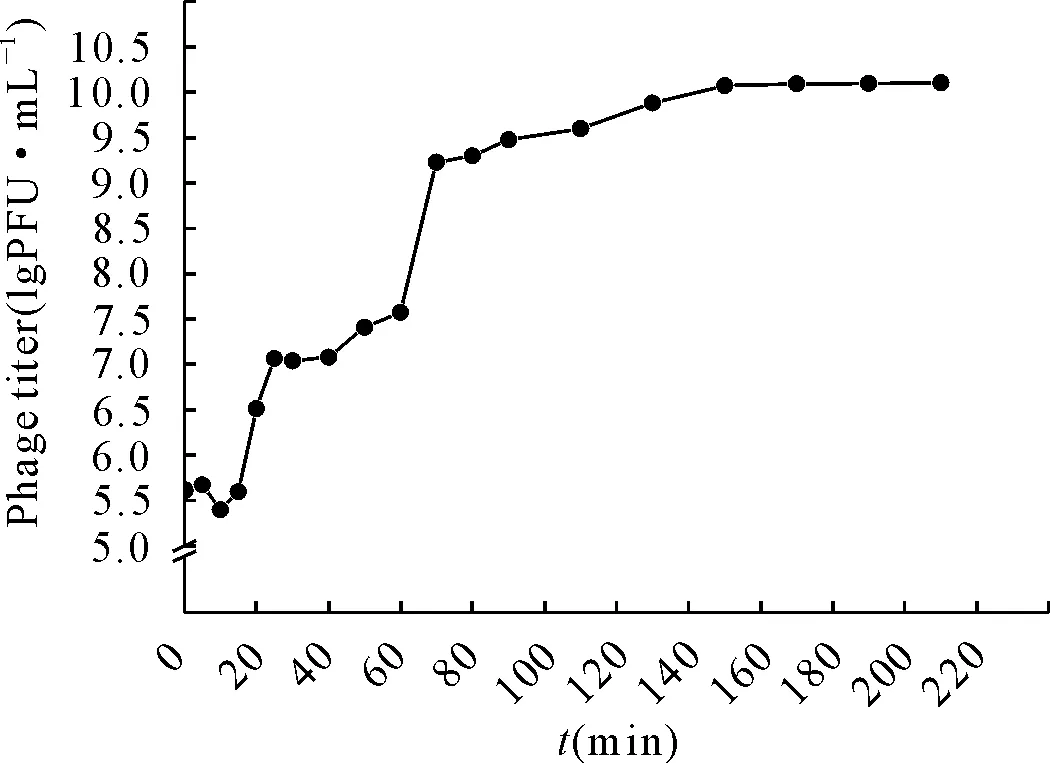
图6 噬菌体vB-EcoM-IME540的一步生长曲线
2.8 噬菌体的pH敏感性
由图7可知,噬菌体vB-EcoM-IME540在pH为4.0~13.0之间对噬菌体的影响不大,其效价无明显变化并保持在较高水平。在pH为3.0时其活性明显降低,在2.0时失去活性;在pH为13.0时,效价仍处于较高水平且明显高于3.0,说明噬菌体vB-EcoM-IME540具有强耐碱性。
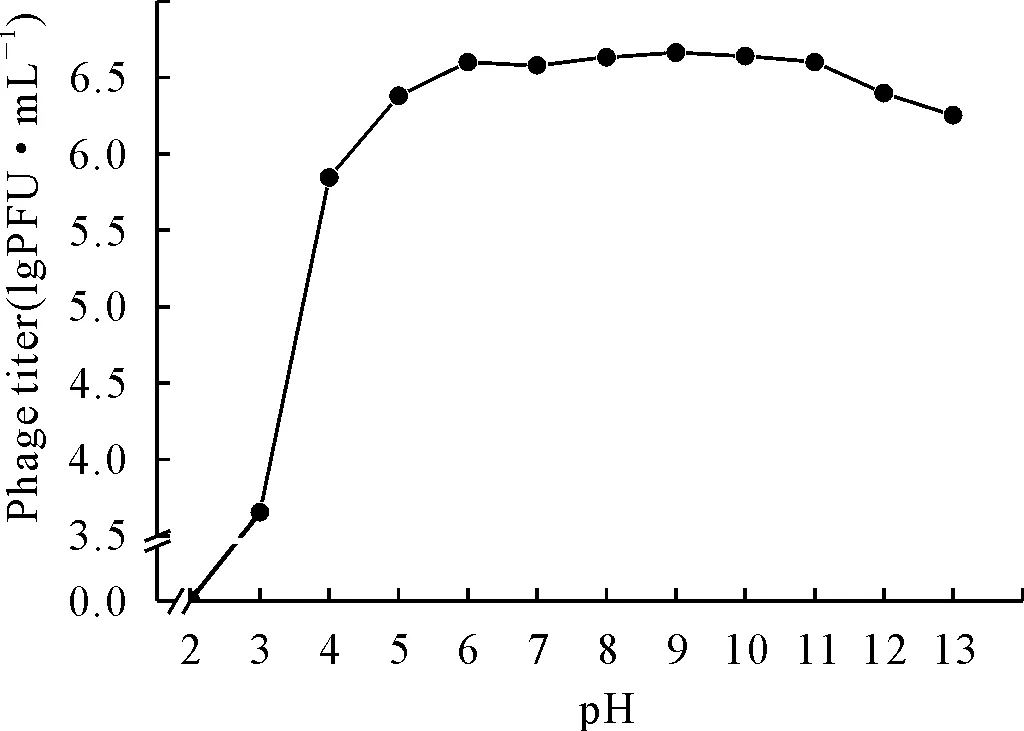
图7 噬菌体vB-EcoM-IME540的pH敏感性
2.9 噬菌体的耐热稳定性
由图8可知,噬菌体vB-EcoM-IME540在40℃、50℃条件下作用2 h时,噬菌体效价大约下降了13.0%;60℃作用2 h,大约下降了49.0%;70℃作用20 min,效价下降了60.0%;80℃作用20 min,噬菌体失活。
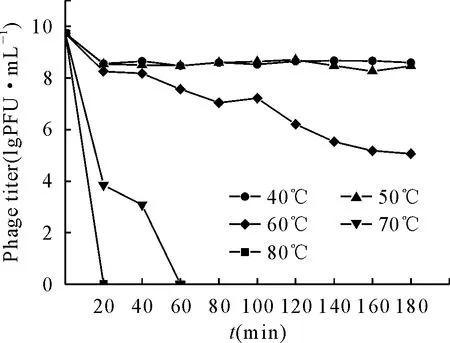
图8 噬菌体vB-EcoM-IME540的耐热稳定性
3 讨论
噬菌体与其细菌宿主的进化密切相关,并经常提供毒力因子,使得噬菌体的研究对于理解致病株的进化具有重要意义。本试验利用噬斑形成试验与双层琼脂平板培养法从污水中分离、纯化裂解性鸡大肠埃希氏菌噬菌体,并将其暂时命名为vB-EcoM-IME540,其代表意义可参考张倩等[17]对其的解释。
通过对噬菌体电镜观察、全基因组测序的比对和聚类分析知噬菌体vB-EcoM-IME540与噬菌体Enterobacteriaphage Bp7(有尾噬菌体目的肌尾噬菌体)亲缘性最好,其全基因组序列覆盖率高达 97%。在国际病毒分类委员会(ICTV)的最新报道中,又将此噬菌体划分为dsDNA病毒。噬菌体vB-EcoM-IME540在pH为5.0~13.0时均有很高的活性,与孙利广[18]等报道的V-EcoM-C1(pH5.0~10.0)相比,具有较强耐碱性;在50℃内具有稳定的活性,70℃下40 min仍具有活性,与本实验室分离的噬菌体EcP5[19]相比有一定耐高温性;裂解范围与王礼伟[20]分离的EcP10相比较窄,因仅对本实验室分离保存的鸡源大肠埃希氏菌进行了裂解谱测定试验,而对其他种源大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌等菌属是否具有裂解能力尚不清楚,需要进行后续的试验加以验证分析。感染宿主菌的潜伏期约为20 min,暴发期时间维持约130 min,裂解量23,具有较强的裂解活性;在较低的最佳感染复数0.000 001时,有较高的杀菌效率。综合以上信息,本次试验中分离的噬菌体vB-EcoM-IME540是一株能裂解鸡大肠埃希氏菌的有尾噬菌体目肌尾噬菌体科的dsDNA噬菌体,有一定的临床应用价值。

