环状RNA Circ0000316在大肠埃希氏菌和金黄色葡萄球菌诱导的奶牛乳腺上皮细胞炎症模型中的表达研究
谢晓刚,李 丹,罗 艳,贾燕青,薛增迪,张振仓,马乃祥,权富生*
(1.杨凌职业技术学院动物工程分院,陕西杨凌 712100;2.西北农林科技学院动物医学院,陕西杨凌 712100)
奶牛乳腺炎(Cow mastitis)是指奶牛乳腺组织代谢紊乱,或者受到物理或化学刺激后对病原微生物入侵易感而造成的炎症,是奶牛养殖场中的常见病和多发病,会影响奶牛产奶量和牛奶品质,严重时病牛会面临被淘汰的风险,给奶牛业造成了严重的经济损失[1]。在畜牧生产上,造成奶牛乳腺炎的病原微生物主要有大肠埃希氏菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus)。大肠埃希氏菌广泛存在于粪便、垫料以及饲料中,若工作人员在挤奶过程中操作不当,会造成大肠埃希氏菌入侵乳房引发急性乳腺炎;而金黄色葡萄球菌具有一定的黏附性,常通过皮肤传播,最后定植于乳腺上皮细胞,产生肠毒素等导致宿主细胞过度表达炎性介质造成持续的炎症反应,引起慢性乳腺炎[2-4]。因此,研究奶牛乳腺炎致病机理对临床生产上防控乳腺炎尤为重要。
circRNA是pre-mRNA的反向剪切或外显子跳跃产生的首尾相接的单链闭合环状分子[5],其具有多种生物学功能,如调节自身基因的表达[6];调节mRNA的可变剪切、转录以及蛋白质翻译过程[7];作为microRNA的“分子海绵”[8];作为蛋白海绵或蛋白支架[6];还可以翻译成蛋白或多肽[9]。此外,有一些假基因也来源于circRNA[10]。但circRNA在牛上的研究主要集中在作为“分子海绵”调节成肌细胞的增殖、分化与凋亡[11-13],参与牛睾丸发育和精子发生[14],也可能参与酪蛋白基因表达的调节[15]。之前也有相关circRNA在奶牛乳腺炎中作用的相关分析,证明circRNA参与了奶牛乳腺炎的发生发展过程。
本研究从前期高通量测序结果中筛选到一个名为circRNAcirc0000316的circRNA[16],并通过大肠埃希氏菌和金黄色葡萄球菌诱导建立奶牛乳腺上皮细胞炎症模型,采用RT-PCR方法检测circ0000316在该模型中的表达情况,为进一步研究环状RNA在奶牛乳腺炎进程中的作用提供理论支持。
1 材料与方法
1.1 材料
1.1.1 组织样品 由病理专业人员将现代牧业(宝鸡牧场)中明显患有乳腺炎病变和泌乳中后期因意外(如发生骨折等疾病)而淘汰的健康奶牛的乳腺组织取样送到实验室,经病理学鉴别诊断后确定患有乳腺炎,病料经40 mL/L福尔马林及9 g/L生理盐水处理后,一部分于-80℃保存,一部分用于后期试验。
1.1.2 细胞和菌种 奶牛乳腺上皮细胞系(MAC-T细胞)以及本研究中所用大肠埃希氏菌和金黄色葡萄球菌均由西北农林科技大学农业农村部动物生物技术重点实验室保存。
1.1.3 主要试剂 Trizol up试剂盒、TransScript®First-Strand cDNA Synthesis SuperMix试剂盒、TransStart®Top Green qPCR SuperMix试剂,均为北京全式金生物技术有限公司产品;牛肿瘤坏死因子(TNF-α)检测试剂盒,上海康朗实业有限公司产品;DMEM/DF12培养基,美国Gibco公司产品;胎牛血清,以色列BI公司产品;试验过程中所用到的引物,均由北京擎科公司合成(表1)。

表1 引物序列
1.1.4 主要仪器 CO2恒温培养箱,日本SANYO公司产品;多功能酶标检测仪,美国Bio-Rad公司产品;Real-time quantitative PCR仪,美国Bio-Rad公司产品。
1.2 方法
1.2.1 组织和细胞RNA提取 本试验采用Trizol法提取组织总RNA。对于组织样品,将黄豆大小的组织样品剪碎后放入液氮预冷的研钵中,将组织块研细,加入1 mL Trizol up试剂反复吹吸,使组织样品充分裂解,依照说明书提取组织或细胞总RNA,酶标仪检测所得RNA质量和浓度,置-80℃保存备用。
细胞样品经处理后,弃去上清,经PBS冲洗后加入适量Trizol up试剂,使细胞充分裂解后依据说明书提取细胞总RNA,酶标仪检测所得RNA质量和浓度,置-80℃保存备用。
1.2.2 RT-PCR检测 按照北京全式金公司TransScript®First-Strand cDNA Synthesis SuperMix试剂盒说明书进行反转录得到cDNA,反应步骤如下:在无RNase的EP管中,分别加入总RNA 1 μg、Random Primer(N9)和TransScript®RT/RI Enzyme Mix各1 μL,2×TS Reation Mix 10 μL,加Nuclease-Free Water补至20 μL,轻轻混匀后,25℃孵育10 min,42℃孵育15 min,85℃加热5 s失活TransScript®RT/RI,反应结束后将cDNA置于-20℃备用。采用SYBR方法检测mRNA表达情况,反应体系与步骤如下:在无RNase的EP管中,分别加入2×TransStart®Top Green qPCR SuperMix 10 μL,上、下游引物各0.4 μL,cDNA 1 μL,Nuclease-Free Water补至20 μL,轻轻混匀后,进行离心,避免管壁和管盖沾有液体而影响试验结果,每孔3个重复。PCR程序为:95℃ 5 min;95℃ 5 s,60℃ 30 s,40个循环进行扩增;95℃ 15 min,60℃ 1 min,±5℃进行梯度升温至95℃,持续15 s,程序结束后对目的基因的表达量进行分析。
1.2.3 大肠埃希氏菌和金黄色葡萄球菌灭活 参照Ma等[17]的试验方法,首先对细菌进行培养,将保存于-80℃的大肠埃希氏菌和金黄色葡萄球菌分别划线接种于不含抗生素的LB固体培养基中,37℃倒置培养14~16 h,待培养基中长出单菌落,并将1 mm~2 mm的单菌落用接种针接种于15 mL LB液体培养基中,37℃、180 r/min过夜培养,待细菌生长至对数期,收集菌液备用。将收集后的菌液分别进行10倍稀释至102、104、106后,分别吸取不同稀释度的菌液10 μL接种至LB固体培养基中,每个稀释度做3个重复,37℃倒置培养12 h~14 h,待培养基长出清晰可见的单菌落时,对单菌落数在50~200之间的稀释度进行计数,依据文献中的计算公式对细菌数量进行统计。将收集后的菌液在超净台中分装至2 mL无菌离心管中,做好标记并封口。采用低温灭活的方式对细菌进行灭活,依据文献中的描述,大肠埃希氏菌的灭活条件为:65℃水浴1 h,金黄色葡萄球菌为60℃水浴2 h。灭活后对菌液进行灭活检验,检验方法为:吸取10 μL灭活后的菌液,接种至LB固体培养基中倒置于37℃恒温培养箱中培养,24 h后观察培养基中是否长出单菌落,若未长出则灭活成功,将灭活成功的单菌落于-80℃中保存备用。
1.2.4 炎性细胞模型的建立 将生长良好的MAC-T细胞消化收集后,用DF12培养液重悬进行细胞计数,计数后将细胞接种于60皿中,每皿细胞数约为4×105个,培养细胞至贴壁;将预先灭活并计数的菌液收集离心,PBS清洗2次后细胞培养液重悬,大肠埃希氏菌和金黄色葡萄球菌分别以1 000∶1和100∶1的比例对细胞进行攻菌,处理24 h后分别收集上清和细胞,总RNA进行下一步试验。
1.2.5 酶联免疫吸附试验 ①试验前准备:将试剂盒平衡至室温后,20倍浓缩洗涤液于37℃水浴助溶;②收集处理后细胞上清至无菌离心管,2 500 r/min离心20 min,将上清转移至新的无菌离心管;③加样:设置空白孔,标准孔和待测样品孔,空白孔不加样品及酶标试剂,每个标准孔加不同浓度的标准品50 μL,样品孔中,样品稀释液40 μL+待测样品10 μL(样品稀释5倍);④加酶孵育:除空白孔外,每孔加入酶标试剂100 μL,封板膜封板,37℃孵育60 min;⑤洗板:20倍浓缩洗涤液蒸馏水稀释20倍,揭掉封板膜弃去试剂,甩干,每孔加满洗涤液(约350 μL),静置30 s弃去,重复5次,拍干;⑥显色:每孔先加显色剂A 50 μL,再加50 μL显色剂B 50 μL,轻轻振荡混匀,封板37℃避光显色15 min;⑦终止:每孔加入终止液50 μL终止反应;⑧测定:终止液加入15 min后,450 nm波长测定各孔吸光度。
1.2.6 统计分析 本研究中的试验数据均以“平均值±标准差(SD)”形式呈现,每个试验结果均重复3次,统计学差异由双尾t检验所得,*P<0.05认为统计学差异显著,**P<0.01认为统计学差异极显著。
2 结果
2.1 circ0000316在健康乳腺组织及炎性乳腺组织中的表达
本研究前期从现代牧业(宝鸡牧场)获得了3头健康奶牛和3头患乳腺炎奶牛的乳腺组织,分别提取总RNA反转录后采用实时荧光定量PCR检测circ0000316的表达量,结果显示circ000316在炎性组织中的表达量显著降低(图1A和图1B)。

A.炎性组织和正常组织中circ0000316的表达(n=3);B.炎性组织和正常组织中circ0000316表达的统计学分析。**P<0.01
2.2 奶牛乳腺炎细胞模型的建立
参考文献中建立奶牛乳腺上皮细胞炎症模型的方法,以大肠埃希氏菌和金黄色葡萄球菌刺激MAC-T细胞后,TNF-α显著升高为作为模型建立成功的标志,因此本研究从mRNA和蛋白分泌水平检测了TNF-α的变化,结果显示TNF-α表达量显著升高(图2A和2B),表明炎症模型建立成功。

A.大肠埃希氏菌和金黄色葡萄球菌刺激前后TNF-α基因表达情况;B.大肠埃希氏菌和金黄色葡萄球菌刺激后TNF-α分泌水平
2.3 circ0000316在奶牛乳腺上皮细胞炎症模型中的表达
在成功建立奶牛乳腺上皮细胞炎症模型后,本研究继而检测了circ0000316在该模型中的表达量,结果显示,circ0000316在奶牛乳腺上皮细胞炎症模型中呈现显著低表达(图3),与前面提到的组织中的表达情况一致。
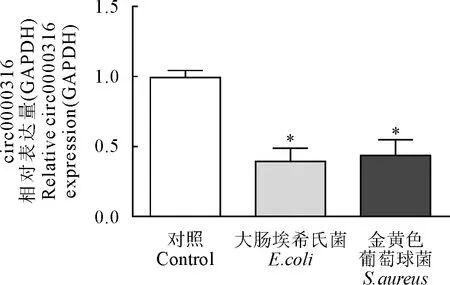
图3 circ0000316在奶牛乳腺上皮细胞炎症模型中的表达量
3 讨论
本研究参考Ma等[16]的方法以炎性标志性因子TNF-α升高为标志,建立了大肠埃希氏菌和金黄色葡萄球菌刺激的奶牛乳腺上皮细胞炎症模型,模拟奶牛发生乳腺炎时的细胞环境,验证circ0000316在奶牛乳腺上皮细胞炎症模型中的表达情况。结果显示,与奶牛乳腺组织中的表达趋势一致,也与文献中报道的高通量测序结果中circ0000316的表达趋势相一致[17]。此外,有研究表明,circKIKA通过miR-326的“分子海绵”作用参与调控MAC-T细胞的凋亡和增殖[18];而circLPP通过“分子海绵”作用降低游离miR-615的表达,导致miR-615对其靶基因SPRED3的稳定性降低,从而参与调控奶牛乳腺组织的炎症进程[19]。
本研究在大肠埃希氏菌和金黄色葡萄球菌诱导的乳腺炎模型中验证了circ0000316的表达情况,为深入研究circ0000316在奶牛乳腺炎发生过程的调控作用奠定了基础,为进一步研究奶牛乳腺炎的防控提供了新思路。

