杨梅素对心肌缺血再灌注损伤大鼠血红素加氧酶1 表达的影响
王 龙,马 磊,黄 燕,张 勇,席红娜,吕建瑞
西安交通大学第二附属医院,陕西 西安 710004
心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury,MI/RI)多见于冠心病、心肌梗死以及冠状动脉介入治疗的患者,是指心肌在受到较长时间缺血后,当血液再恢复灌注时给心肌带来的病理性组织损害,这种损害包括直接的病理性组织损伤、心脏功能下降及心脏代谢障碍等,严重者可致患者死亡[1-2]。目前 MI/RI 的发生机制还没有完全明确,治疗原则主要以预防为主[3]。中医药在预防本病中有独特优势,包括一些中药汤剂和中药提取物在本病的预防治疗方面有许多文献报道[4-5]。杨梅素即是其中之一,国内学者邵玲等[6]研究发现,杨梅素对MI/RI大鼠具有明显的保护作用,其机理与杨梅素可调节PI3K、AKT 和 mTOR 蛋白表达有关。此外还有研究[7]观察了杨梅素对离体MI/RI 大鼠模型的作用,结果发现杨梅素对其也有很好的调节作用,其作用机理是通过调节PPARγ/NF-κB 信号通路实现的,但是目前的研究还没有心肌血红素加氧酶1(heme oxygenase-1,HO-1)的研究报道,因此本研究采用杨梅素干预大鼠,观察大鼠发生MI/RI 后HO-1 蛋白及mRNA 的表达特点,以丰富杨梅素预防治疗MI/RI的理论依据。
1 材料与方法
1.1 实验动物选择72 只健康雄性SD 大鼠,清洁级,体质量180~220 g,购于西安交通大学医学院动物实验中心,实验动物合格证号:SCXK 2015-001。饲养条件:大鼠饲养于SPF 级动物房,由专业人员按照国际标准[8]饲养,在购买后先适应性喂养1周。
1.2 药物与试剂杨梅素(上海纯优生物科技有限公司,批号:529-44-2);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒(武汉华美生物工程有限公司,批号分别为:CSB-E08556m、CSB-E05840h、CSB-E04639m和CSB-E09315h);总蛋白提取试剂盒(北京索莱宝科技有限公司,批号:BC3790);总RNA 提取试剂盒(北京天根生物试剂有限公司,批号:DP419),逆转录试剂盒(美国Promega 公司,批号:A3500);兔抗大鼠血红素加氧酶1(heme oxygenase-1,HO-1)和甘油三磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国 Santa Cruz 公司,批号分别为:sc-1796 和 sc-59540);辣根酶(Horseradish Peroxidase,HRP)标记的羊抗兔二抗(北京中杉生物技术有限公司,批号:ZB-2306);引物(武汉谷歌生物设计并生产)。
1.3 实验方法
1.3.1 分组及给药 按照随机数字表法将72 只健康雄性SD大鼠分为假手术组(生理盐水1.0 mL/kg灌胃),模型组(生理盐水1.0 mL/kg灌胃),阳性对照组(阿司匹林10 mg/kg灌胃),杨梅素高(杨梅素400 mg/kg 灌胃)、中(杨梅素 200 mg/kg 灌胃)、低(杨梅素100 mg/kg 灌胃)剂量组,每组12 只。给药剂量根据文献报道[9]确定,给药2周后进行后续实验。
1.3.2 模型制备 大鼠MI/RI模型根据文献[10]报道的方法进行制备,大鼠禁食不禁水12 h后,采用戊巴比妥钠腹腔注射麻醉,后将其固定,行气管插管,同时用心电图记录仪记录大鼠心电图,找到第四根肋骨后剪断,剪开心包,暴露心脏,剥离心包膜后于左心耳下缘2~3 mm处结扎,后进行常规缺血再灌注损伤手术,而假手术组只给予穿线但不结扎。造模成功的标志为,大鼠心脏下部心肌组织颜色发白,同时心电图有明显ST 段抬高(缺血30 min,再灌注120 min)。
1.4 观察指标
1.4.1 组织学观察 1)实验完成后,采用腹主动脉取血法采集大鼠血液,血液收集后使用低温高速离心机离心(4℃,离心半径4 cm,4000 r/min,离心10 min),离心后收集血浆,将其置入超低温冰箱中用于相关生化指标的检测。血液收集后采集心脏组织,将其分成三部分:其中一部分置入组织固定液中用于相关病理学检测,一部分置入超低温冰箱中用于蛋白和mRNA 的检测,剩余一部分置入-20℃冰箱中用于心脏相关生化指标的检测。2)从组织固定液中取出心脏组织,根据文献[11]报道方法,采用HE 染色检测心肌组织病理学,检测完成后采用光学显微镜观察心肌组织病理学变化特点,每张切片均选取4个不同视野。
1.4.2 实验室指标 1)采用全自动生化分析仪检测各组血液中乳酸脱氢酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CK)含量。2)采用酶标仪测定各组大鼠心脏中SOD、MDA、IL-6 和 TNF-α 含量。3)采用 Western blot测定心肌组织HO-1 蛋白表达,从超低温冰箱中取出心脏组织,按照总蛋白提取试剂盒说明书提取总蛋白后并测定蛋白含量,后将其统一调平,完成后每组各取50 μg 行SDS-PAGE 电泳分离,半干转移法转移到PVDF 膜,5%的脱脂牛奶封闭2 h 后洗涤 3 次,后加入一抗封闭(HO-1 抗体(1∶1500),GAPDH 抗体(1∶3000))过夜,次日取出后采用TBST洗涤 3 次,加入 2 抗(1∶3000)40 min 后,洗涤 3 次,采用增强型DAB 显色试剂盒对其进行显影,后扫描膜,采用图像分析软件分析每个蛋白积分光密度值(IOD),结果以 HO-1 的 IOD 值与 GAPDH 条带的IOD 值的比值作为HO-1 的相对表达量。4)采用RT-PCR 技术检测心肌组织HO-1 mRNA 表达,从超低温冰箱中取出心脏组织,按照试剂盒提供的说明书用总RNA 提取试剂盒提取各组大鼠心肌组织总RNA,完成后按照逆转录试剂盒提供的说明书将其逆转录成 cDNA,后每组各取 2 μg 行 PCR 扩增反应,扩增反应条件为:95℃ 2 min、94℃ 10 s、60℃ 10 s、72℃ 40 s,循环次数34 次。引物序列:HO-1,上游序列:5'-AGCCCCACCAAGTTCAAACA-3',下游序列:5'-TGCCAACA GGAAGCTGAGAG-3',扩增片断 321 bp。GAPDH,上游序列:5'-GAGACCTTCAACACCCCAGC-3',下游序列:5'-CCACAGGATTCCATACCCAA-3',扩增片段446 bp,分析方法为2-ΔΔCt法。
1.5 统计学方法采用SPSS 22.0 软件进行数据分析,计量资料以表示,采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 LDH和CK活性与假手术组比较,模型组血清LDH和CK水平均明显升高(P<0.05);相较于模型组,阳性对照组和杨梅素各剂量组LDH、CK 水平均明显降低(P<0.05),其中以杨梅素高剂量组明显低于阳性对照组(P<0.05)。见表1。
表1 各组大鼠心肌酶LDH和CK水平比较() U/L
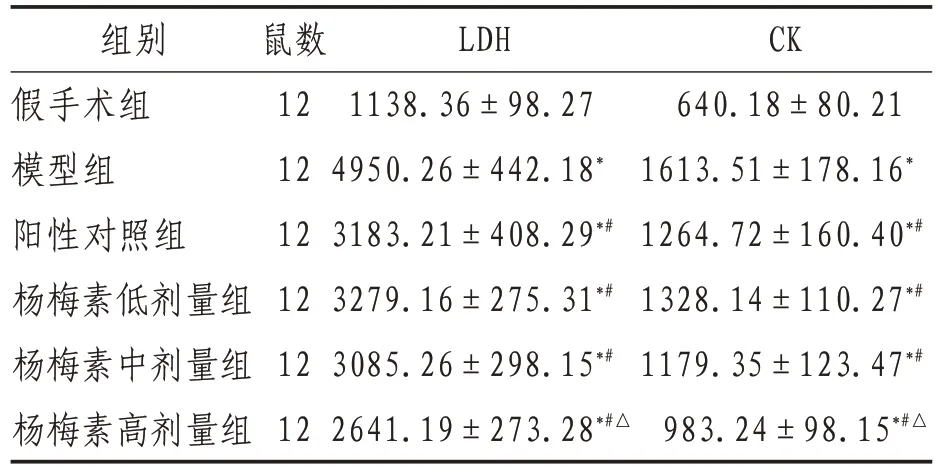
表1 各组大鼠心肌酶LDH和CK水平比较() U/L
注:*表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05;△表示与阳性对照组比较,P<0.05
组别假手术组模型组阳性对照组杨梅素低剂量组杨梅素中剂量组杨梅素高剂量组CK 640.18±80.21 1613.51±178.16*1264.72±160.40*#1328.14±110.27*#1179.35±123.47*#983.24±98.15*#△鼠数12 12 12 12 12 12 LDH 1138.36±98.27 4950.26±442.18*3183.21±408.29*#3279.16±275.31*#3085.26±298.15*#2641.19±273.28*#△
2.2 心肌组织中SOD、MDA、IL-6和TNF-α水平与假手术组比较,模型组大鼠心肌组织中MDA、IL-6和TNF-α水平显著提高,SOD水平下降(P<0.05),与模型组比较,杨梅素各剂量组和阳性对照组MDA、IL-6 和 TNF-α 水平明显降低(P<0.05),SOD 水平明显升高(P<0.05),此外杨梅素高剂量组MDA、IL-6和TNF-α水平明显低于阳性对照组(P<0.05),SOD水平明显高于阳性对照组(P<0.05)。见表2。
表2 各组大鼠心肌组织中SOD、MDA、IL-6和TNF-α水平比较()
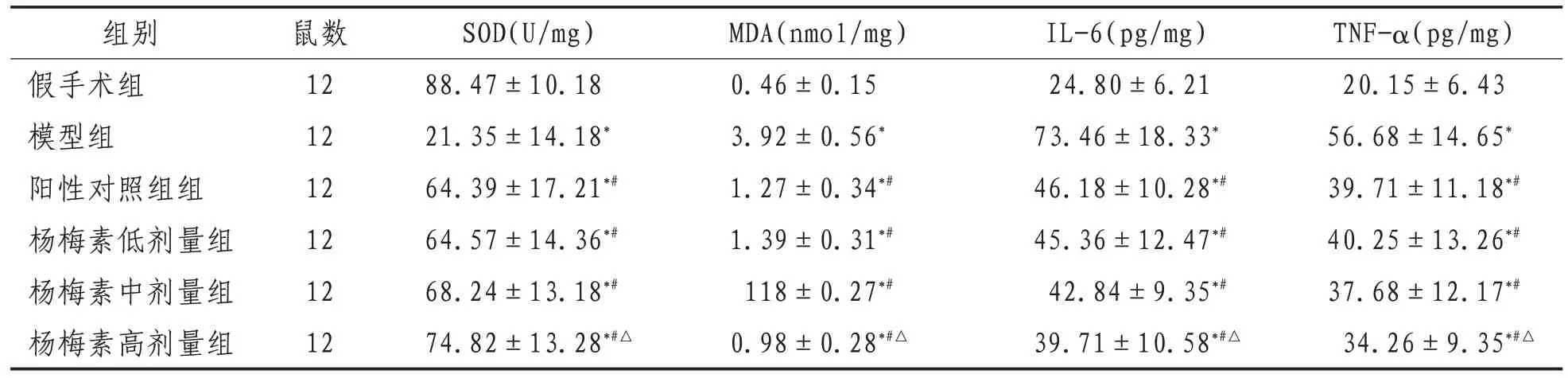
表2 各组大鼠心肌组织中SOD、MDA、IL-6和TNF-α水平比较()
注:*表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05;△表示与阳性对照组比较,P<0.05
组别假手术组模型组阳性对照组组杨梅素低剂量组杨梅素中剂量组杨梅素高剂量组TNF-α(pg/mg)20.15±6.43 56.68±14.65*39.71±11.18*#40.25±13.26*#37.68±12.17*#34.26±9.35*#△鼠数12 12 12 12 12 12 SOD(U/mg)88.47±10.18 21.35±14.18*64.39±17.21*#64.57±14.36*#68.24±13.18*#74.82±13.28*#△MDA(nmol/mg)0.46±0.15 3.92±0.56*1.27±0.34*#1.39±0.31*#118±0.27*#0.98±0.28*#△IL-6(pg/mg)24.80±6.21 73.46±18.33*46.18±10.28*#45.36±12.47*#42.84±9.35*#39.71±10.58*#△
2.3 心肌组织形态学观察大鼠心肌组织病理学可见,假手术组心肌纤维形态正常,结构清晰;模型组出现明显病理变化,主要表现为心肌纤维断裂,结构稀疏;与模型组相比,杨梅素低剂量、中剂量和高剂量组逐渐好转,特别是杨梅素高剂量组仅有少量的细胞结构变性。此外杨梅素高剂量组心肌组织形态也明显好于阳性对照组。见图1。

图1 心肌组织染色结果(HE×400)
2.4 心肌组织HO-1 mRNA和蛋白表达各组大鼠心肌组织中HO-1蛋白及mRNA表达,与假手术组比较,HO-1 蛋白模型组有一定升高(P<0.05),与模型组比较,杨梅素各剂量组和阳性对照组进一步升高(P<0.05),但杨梅素各剂量组与阳性对照组比较差异无统计学意义(P>0.05)。见图2,表3。

图2 心肌组织中HO-1蛋白表达
表3 各组大鼠心肌HO-1蛋白及mRNA相对表达量() mmol/L

表3 各组大鼠心肌HO-1蛋白及mRNA相对表达量() mmol/L
注:*表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05
HO-1 mRNA表达1.01±0.01 1.26±0.16*2.08±0.24*#1.96±0.19*#2.03±0.22*#2.19±0.18*#组别/指标假手术组模型组阳性对照组杨梅素低剂量组杨梅素中剂量组杨梅素高剂量组鼠数12 12 12 12 12 12 HO-1蛋白表达0.67±0.11 0.74±0.12*1.47±0.18*#1.45±0.12*#1.43±0.14*#1.50±0.11*#
3 讨论
MI/RI 危害极大,近年来大量流行病学调查研究发现冠心病患者在发生MI/RI后,约有10%的患者发生死亡,心功能不全的患者MI/RI 发生后死亡率高达25%,即使是已经进行手术的心肌梗死患者,也有2%~3%的患者死于MI/RI,25%的患者虽然不会死亡,但再灌注后会引起不同程度的心率失常、低血压甚至心功能不全等并发症,给患者带来极大的损害[10-14]。随着医疗技术的发展,溶栓治疗和冠状动脉介入手术广泛推广,上述治疗虽然可以极大减少心肌缺血时间,但对心肌的损伤依然存在,因此开发药物尽可能减少MI/RI是当前研究的热点[15]。近年来研究发现多种黄酮类化合物对治疗MI/RI 有独特优势。刘丹等[16]构建了MI/RI动物模型,研究结果发现柚皮苷可以通过调节葡萄糖调节蛋白78(glucose-regu-lated protein78,GRP78)表达,进而保护心肌组织。此外,梁丽梅等[17]研究发现龙血竭总黄酮可通过调节抗氧化能力保护MI/RI 大鼠心肌损伤。杨梅素也是黄酮类化合物之一,其对心肌的保护作用已有文献报道,本次研究进一步明确杨梅素保护MI/RI机理。研究中首先构建了MI/RI大鼠模型,研究结果发现,与假手术组相比,模型组心肌细胞明显断裂,心肌有一定的炎症反应发生,同时心肌酶LDH 和CK 明显升高,这提示本次研究模型成功构建,而使用杨梅素治疗后,LDH 和CK 明显降低,心肌组织病理学也明显好转,这证实了杨梅素确实可以很好地预防MI/RI大鼠心肌损害。
近年来研究发现,HO-1 蛋白具有明显提高抗氧化能力的作用,HO-1 是体内的一种常见的抗氧化调节蛋白,其调节作用可能是因为HO-1 可以氧化分解体内的血红素,而血红素可分解形成胆红素,胆红素则具有明显的抗氧化作用[18]。关于其抗氧化作用的研究,如国外学者Turkseven 等[19]构建了糖尿病小鼠模型,发现通过直接诱导HO-1表达可以提高体内多种抗氧化指标,包括SOD、内皮型一氧化氮及过氧化氢酶的表达,同时降低MDA 的含量,进而提高机体的抗氧化能力。本研究结果发现,与假手术组相比,模型组大鼠心肌组织中抗氧化指标SOD 明显增加,MDA 明显降低,这提示MI/RI 大鼠的抗氧化能力明显降低,而杨梅素则可以明显地提高SOD 活性,同时降低MDA 活性,且杨梅素高剂量组明显优于阳性对照组,这提示杨梅素对MI/RI 大鼠心肌组织中抗氧化能力的提高具有明显的促进作用。
此外近年来研究发现,HO-1 也具有强大的抗炎能力[20]。正常情况下,在心肌细胞发生缺血再灌注损伤后,心肌细胞可以释放出过多的血红素,其分泌的血红素主要有两个作用,一方面诱导巨噬细胞及粒细胞的浸润,另一方面则可以反馈调节,诱发心肌细胞中HO-1的表达。HO-1在过量表达后,可以通过抑制炎症细胞黏附、趋化和渗透,进而发挥一定的抗氧化作用。如Kapturczak等[21]研究发现,基因剔除的HO-1 小鼠血清中IgM水平会明显增高,给予这些小鼠使用脂多糖刺激后,小鼠可释放出高水平的IL-1、IL-6 和TNF-α等,而正常的小鼠则没有这种反应,这提示HO-1基因剔除的小鼠抗炎能力明显降低。本研究结果发现,与假手术组相比,模型组大鼠心肌组织中IL-6 和 TNF-α 明显升高,这提示 MI/RI 大鼠具有明显的炎症反应,而采用杨梅素治疗后,大鼠IL-6和TNF-α 明显降低,这提示杨梅素对炎症反应具有明显的调节作用。同时结合HO-1 蛋白及mRNA的表达特点发现,与模型组相比,杨梅素可以明显提高心肌组织中HO-1蛋白及mRNA的表达水平,同时这种表达的变化特点与抗氧化指标SOD和MDA、炎性因子指标IL-6 和TNF-α 的变化特点具有一致性,这提示,杨梅素抗MI/RI 大鼠炎症反应,同时提高抗氧化能力可能是通过调节心肌组织中HO-1的表达而实现的。
综上所述,杨梅素对MI/RI 大鼠心肌损伤具有明显的抑制作用,其保护作用机理是通过提高心肌中HO-1蛋白及mRNA的表达,进而降低炎症因子IL-6 和TNF-α,提高抗氧化指标SOD,降低氧化产物MDA实现的。

