利用pH传感器和光传感器探究氢氧化铝的两性
吕善荣

摘要: 利用pH传感器和光传感器实时测定铝盐溶液与强碱溶液、偏铝酸盐溶液与强酸溶液反应过程的pH和光照强度变化,并利用四重表征对实验结果作定性分析。同时结合有关平衡常数对实验数据作理论分析,从定量的角度验证氢氧化铝的两性,明确铝离子、氢氧化铝及偏铝酸根离子存在的溶液pH范围以及氢氧化铝沉淀量随溶液pH变化的规律。
关键词: 氢氧化铝的两性; pH传感器; 光传感器; 实验探究
文章编号: 1005-6629(2021)03-0079-05
中图分类号: G633.8
文献标识码: B
1 问题提出及实验目的
氢氧化铝的两性是上海市高级中学课本化学高二第一学期8.2节“铝和铝合金的崛起”[1]以及高三化学拓展型课程6.2节“一些金属化合物”的学生实验[2],学习水平是B级。学科基本要求明确在认识氢氧化铝电离平衡的基础上,通过实验探究不同酸碱性环境下铝化合物的相互转化,体会溶液的酸碱性环境对物质存在形态的重要影响,并感悟化学变化中反应物量的不同对产物的影响,是中学化学教学的重点和难点,也是化学学业水平考试和等级考试的热点。
传统的实验学生只能定性地感知氢氧化铝既能与酸又能与强碱反应,因而具有两性。对于氢氧化铝溶液的酸碱性在何种程度下以铝离子形式存在、何种程度下以偏铝酸根离子形式存在只有模糊的认识。
本实验采用pH传感器和光传感器进行研究,通过手持数字传感器技术实时采集并处理实验数据,让学生观察硫酸铝与氢氧化钠、偏铝酸钠与盐酸的反应进程,定量测定反应过程中的pH变化和光照强度变化,有利于理解反应的本质,理解量变与质变,从而更好地掌握氢氧化铝的两性性质。
2 实验仪器及试剂
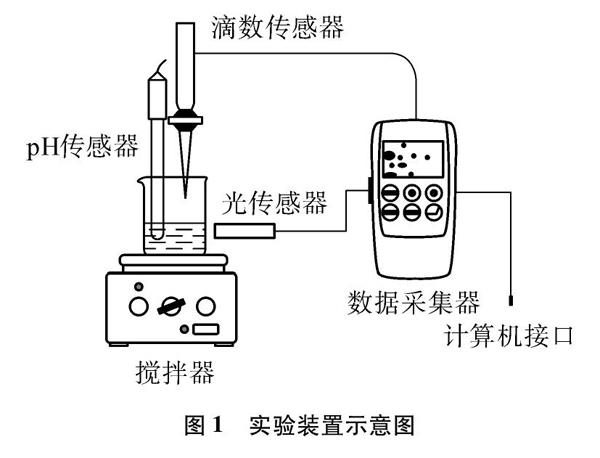
仪器: 100mL烧杯、10mL移液管、洗耳球、磁力搅拌器、Vernier pH传感器、Vernier滴数传感器、Vernier光传感器、Vernier数据采集器、电脑、铁架台
药品: 0.2mol/L及0.1mol/L硫酸铝溶液、2.0mol/L氨水、1.0mol/L氢氧化钠溶液、1.0mol/L盐酸
实验装置如图1所示。
3 实验操作步骤
3.1 实验室制备氢氧化铝
(1) 校正滴数传感器。
(2) 将氨水装入滴数传感器的滴定管中。
(3) 用移液管移取10.0mL硫酸铝溶液至烧杯中,开启pH传感器测定其pH。
(4) 打开搅拌器开关,开启滴定管活塞将氨水滴入硫酸铝溶液中,边滴边搅拌,并不断测定溶液的pH变化。
3.2 探究氢氧化铝的两性
(1) 校正滴数传感器。
(2) 将氢氧化钠溶液和盐酸分别装入滴数传感器的滴定管中。
(3) 用移液管移取10.0mL硫酸铝溶液至烧杯中,开启pH传感器和光传感器测定其pH和光照强度。
(4) 打开搅拌器开关,开启滴定管活塞用氢氧化钠溶液滴定硫酸铝溶液,边滴边搅拌,并不断测定溶液的pH变化。在某一滴滴入时,沉淀完全溶解,溶液变为澄清后停止滴加氢氧化钠溶液,停止采集。
(5) 用盐酸滴定上述已测定的溶液,选择图像附加在之前图像后,点击采集按钮。在某一滴滴入时,沉淀完全溶解,溶液变为澄清后停止滴加盐酸,停止采集。
4 数据记录及分析处理
4.1 实验室制备氢氧化铝
实验室用0.2mol/L硫酸铝溶液和2.0mol/L氨水反应制备氢氧化铝过程中,硫酸铝溶液由于水解作用,其起始pH约为2.20。随氨水的滴加,pH达到3.34时溶液白色浑浊明显增多;pH达到4.52时,氢氧化鋁沉淀完全(如图2所示)。
4.2 探究氢氧化铝的两性
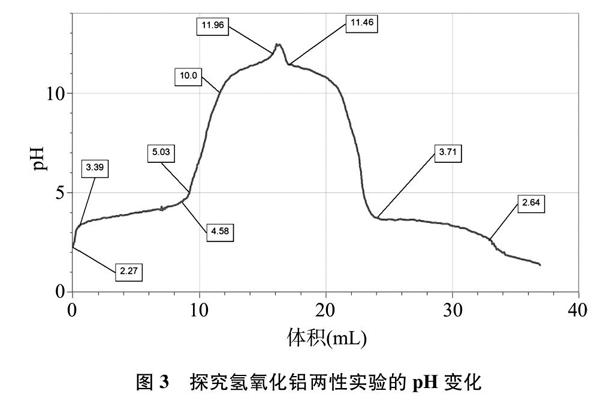
第一次实验(图3): 在0.2mol/L硫酸铝溶液中滴加1.0mol/L氢氧化钠溶液,测定pH变化。起始pH为2.27,随着氢氧化钠的滴加,pH达到3.39时溶液开始出现白色浑浊。起初,白色沉淀量增加缓慢,pH变化较小;当pH为4.58~5.03时,沉淀急剧增加,并有些发粘;此后,pH急剧变化,沉淀开始减少;当pH为10.0时,沉淀大部分溶解,此时溶液依然浑浊;当pH达到11.96时溶液变澄清。
继续用盐酸滴定,开始时盐酸中和多余的氢氧化钠,未见明显现象。随着盐酸的滴加,当pH降至11.46时出现白色浑浊,白色沉淀量增加较快,pH变化较小;此后,沉淀缓慢消失,pH迅速减小;当pH减小为3.71时,沉淀大部分溶解;当pH降为2.64时,溶液变澄清。大致经过和现象与硫酸铝溶液中滴加氢氧化钠溶液刚好相反(见图3)。
第二次实验: 鉴于第一次实验过程中氢氧化铝沉淀量的多少是通过肉眼观察来判断难以定量描述,因此,在第二次实验中尝试增加了光传感器,通过光传
感器测量光照强度以反映产生氢氧化铝沉淀量的多少。
实验结果如图4所示。
在0.1mol/L硫酸铝溶液中滴加1.0mol/L氢氧化钠溶液,测定pH及光照强度变化。起始pH为2.47,光照强度为862lux;随氢氧化钠的滴加,pH达到3.80时溶液开始出现白色浑浊;当pH在4.94~11.35时,光照强度降为233~258lux,此时白色沉淀明显;当pH为12.10时,沉淀消失,光照强度达最大1112lux。在偏铝酸钠中滴加盐酸的过程不再赘述。
从实验结果看,用0.1mol/L硫酸铝溶液与1.0mol/L氢氧化钠溶液反应,pH的变化曲线与第一次实验基本相似,实验重复性较好。第二次实验中,随着反应生成氢氧化铝沉淀对光线的遮挡,光传感器测到的光照强度随之而变化,实测结果表明,光照强度曲线能较直观地反映实验过程中氢氧化铝沉淀量的变化,有效避免了肉眼观察造成的人为偏差。
5 实验分析
5.1 四重表征理论分析
化学学习中的四重表征分析方法,结合了宏观、微观、符号和曲线表征多角度分析,有助于学生概念学习效果和图像理解能力的提高[3]。本文4.2中第二次实验0.1mol/L硫酸铝溶液中滴入1.0mol/L氢氧化钠溶液过程中的四重表征分析如表1所示。
5.2 平衡理论分析
就本文4.2中第二次实验利用铝离子的水解平衡常数、络合平衡常数K4和氢氧化铝的浓度积常数Ksp从理论上分析0.2mol/L Al3+溶液本身的pH、开始形成氢氧化铝沉淀、沉淀完全、沉淀开始消失及沉淀完全消失时的pH。
在铝盐溶液中,由于Al3+的水解溶液呈酸性,Al3+浓度为0.2mol/L溶液本身的pH:
Al3++H2OAl(OH)2++H+ pK=4.984[4]
K=1.0375×10-5
[H+]=cK=0.2×1.0375×10-5=1.44×10-3mol/L, pH=2.84
Al3+开始沉淀和完全沉淀时的pH:
Ksp[Al(OH)3]=[Al3+][OH-]3=1.3×10-33[5]
Al3+开始沉淀时的pH: [OH-]=3KspAl3+=31.3×10-330.2=1.87×10-11mol/L
pOH=10.7, pH=3.3
Al3+完全沉淀时的pH: [OH-]=31.3×10-331.0×10-5=5.1×10-10mol/L
pOH=9.3, pH=4.7
(假设溶液中离子浓度低于1.0×10-5mol/L时认为其沉淀完全)
氢氧化铝完全沉淀后随氢氧化钠溶液继续不断加入,沉淀逐渐溶解直至完全消失时的pH:
Al3++4OH-[Al(OH)4]- lgK4=33.03[6], K4=1.07×1033
对于Al(OH)3+OH-[Al(OH)4]- K=K4·Ksp=[Al(OH)-4][OH-]=1.07×1.3
氢氧化铝沉淀开始溶解时的pH:
[OH-]=[Al(OH)-4]1.07×1.3=1.0×10-51.07×1.3=7.19×10-6mol/L
pOH=5.1, pH=8.9
氢氧化铝沉淀完全消失时的pH:
[OH-]=[Al(OH)-4]1.07×1.3=0.21.07×1.3=0.144mol/L
pOH=0.84, pH=13.16
从理论计算与实际测量值比较来看,该实验结果是可信的。
6 实验结论及拓展
此实验从定量的角度验证氢氧化铝的两性。当pH<3.4时,Al(OH)3溶解在酸中,生成Al3+;当pH>12时,Al(OH)3溶解在碱中,生成Al(OH)-4(中学化学中一般简写为AlO-2);pH在4~11范围内,在溶液中以Al(OH)3沉淀存在。
实验数据清晰表明,溶液中含铝元素的微粒在不同pH范围的存在形式和量的关系,利用光传感器来监测反应中产生沉淀的量随反应进程的变化,弥补人为观察的不足,生动地展现了化学变化从量变到质变的全过程。
利用该实验装置可进一步探索中学化学常见金属阳离子(如镁离子、铜离子、铁离子等)形成氢氧化物沉淀的pH相关问题。如0.1mol/L氯化铁溶液(配制过程中用少量盐酸酸化)中滴加1.0mol/L氢氧化钠溶液过程(如图5所示)中,氯化铁溶液起始pH为1.87,起始光照强度为28.3lux;铁离子在pH为2.29时产生明显红褐色沉淀,光照强度为8.7lux;pH为3.55时,光照强度仅为3.3lux,表明氢氧化铁沉淀完全(理论上根据Ksp[Fe(OH)3],0.1mol/L的铁离子开始沉淀的pH为2.34,沉淀完全时的pH为3.68)。可见,金属阳离产生氢氧化物沉淀时的pH有一定的差异,并且不一定是在碱性条件下才有氢氧化物沉淀生成。
利用手持數字传感器技术探究金属阳离子形成氢氧化物沉淀的pH问题直观明了,有助于学生对反应本质的理解,为学生进行研究性学习提供了一个很好的案例。
参考文献:
[1]姚子鹏主编. 高级中学课本·高中二年级第一学期化学[M]. 上海: 上海科学技术出版社, 2007: 17.
[2]姚子鹏主编. 高级中学课本·化学拓展型课程[M]. 上海: 上海科学技术出版社, 2008: 125.
[3]钱扬义. 手持技术在化学实验教学中的应用和建模研究[M]. 北京: 科学出版社, 2009
[4][5][6][美]J.A. 安迪. 魏俊发等译. 兰氏化学手册(第二版)[M]. 北京: 科学出版社, 2003.

