木寡糖提高拟南芥抗病性
缪金露,张华建
(安徽农业大学植物保护学院/植物病虫害生物学与绿色防控安徽普通高校重点实验室,合肥 230036)
植物病害给人类尤其是发展中国家带来巨大的经济损失。近10年,全国农作物病害总体处于高发、频发态势,对农业生产、国家粮食安全构成了严重威胁。在病害控制措施中,利用植物抗病性是最经济、最高效、最安全的防治措施。
目前,生产实际中植物抗病性的利用主要基于“基因对基因假说”,即通过植物抗病基因编码的蛋白(R)和病原菌无毒蛋白(Avr)直接或间接的互作激活抗病反应;基于R蛋白对Avr蛋白识别而引发的免疫被称为效应子触发免疫(Effector-triggered immunity, ETI)[1,2]。Avr产物激发的植物专化抗性依赖于植物的抗病基因;专化抗性的植株具有抗性程度高的特点,但由于田间病原菌易发生变异,导致这些品种的抗性不能稳定和持久,最终易被生产所淘汰。
激发子可诱发植物广谱抗性,它不是由植物单个专化型抗病基因控制的,不易随着病原菌的变异而丧失,具有稳定持久抗性的特点,在植物病害控制中具有重要的潜力[3]。这些免疫激发子非特异于某一种病原菌中,可广泛地存在于某一类病原菌或微生物中,被称为病原/微生物相关分子模式(Pathogen/Microbeassociated molecular patterns,PAMPs/MAMPs)[4]。除PAMPs/MAMPs外,激发子还包括植物细胞壁的成分或病原菌细胞壁被降解和修饰的组分,植物—病原物互作中产生的能激发植物防卫反应的物质。按其化学性质分类,主要有寡糖、糖蛋白和蛋白质等[5]。
1985年,美国复杂碳水化合物研究中心Albersheim教授首次提出了寡糖素(Oligosaccharins),认为一类具有生物活性的寡糖可以诱导植物的防卫反应,具有调节植物防病与抗病的功能[6]。植物细胞壁来源的寡聚半乳糖醛酸(Oligogalaeturonides)属于酸性寡糖,被受体激酶WAK1识别,通过激酶CDPK调节乙烯(ET)的产生抵抗灰霉病菌Botrytis cinerea的侵染[7,8]。卵菌大雄疫霉Phytophthora megasperma f. sp.glycinea来源的葡聚寡糖(Beta-glucan)通过阴离子过氧化物酶、酚类聚合物和植保素的诱导积累,激发植物的防卫反应[9,10]。真菌稻瘟病菌Magnaporthe oryzae来源的五聚葡萄糖苷(Beta-glucan)可诱导水稻悬浮细胞中植保素的合成[11]。甲壳类动物(虾、蟹)等来源的几丁寡糖(chitin oligosaccharides,CTOS,乙酰氨基寡糖)和壳寡糖(chitosan oligosaccharides,CSOS,氨基寡糖)是目前研究最为广泛的寡糖,可有效地诱导植物抗病性。CTOS和CSOS被同一受体AtCERK1识别后经不同激酶传递,导致CTOS和CSOS信号分化[12]。以上研究结果表明,寡糖素激活不同的信号传导链,诱发植物的防卫反应。
木寡糖(Xylo-oligosaccharides,简称XOS),是由2~7个D-木糖分子以β-1,4木糖苷键连接成的低聚糖,一般从玉米芯、甘蔗渣、棉籽壳、秸秆得到木聚糖后,再降解制得[13]。利用酶解法制备的木寡糖聚合度2~5,分子量低于2000 D,溶解度高,热稳定性强,易吸收。和其他功能性寡糖如大豆低聚糖、低聚半乳糖、果寡糖、壳寡糖等相比,木寡糖有效添加量较少、对人体的生理功能多且显著[14];木寡糖作为益生元可促进双岐杆菌增殖并增加其活性,改善人体肠道菌群结构;抑制沙门氏杆菌、志贺氏杆菌、大肠杆菌、黄色葡萄球菌等微生物的生长繁殖,防止腹泻;减少有害代谢物积累以保护肝脏;有效降低总血清胆固醇;促进钙吸收和脂代谢[15]。动物中,木寡糖可激活小鼠免疫活性[16-18]。植物中,木寡糖作为一种新的植物生长调节剂增强小白菜生长、渗透调节和产量;通过提高抗氧化酶活性、降低脂过氧化、增加渗透因子、保持离子平衡以促进小白菜抗盐胁迫[19],而木寡糖在植物防卫领域的研究则处于相对滞后的地位,对木寡糖在植物防卫中的功能尚不明确。
本研究测定了不同浓度木寡糖对半活体病原细菌丁香假单胞菌番茄致病变种Pseudomonas syringae pv.tomato(Pst DC3000)、活体病原烟草花叶病毒(Tobacco mosaic virus)和死体病原真菌核盘菌Sclerotinia sclerotiorum的诱导抗性,以期为开发以植物来源激发子为主要成分的新型生物农药,设计高效、低毒的植物病害控制策略提供基础。
1 材料与方法
1.1 材料
拟南芥Arabidopsis thaliana Columbia 生态型、核盘菌Sclerotinia sclerotiorum、烟草花叶病毒侵染性克隆(TMV-GFP)、丁香假单胞杆菌番茄致病变种Pseudomonas syringae pv. tomato DC3000(Pst DC3000)均由安徽农业大学植物抗病性研究室保存和提供。木寡糖来源于中国科学院大连化学物理研究所天然产物和糖工程课题组。
1.2 方法
1.2.1 拟南芥的种植 种子经氯气消毒后,均匀播撒于MS培养基[20],4 ℃春化3 d后置于培养箱培养7 d,并移栽至土中,置于温室22 ℃、相对湿度50%、光周期16D:8L培养。
1.2.2 木寡糖预处理 上述条件培养5周大的不同拟南芥植株叶片在同一时间注射10 μL无菌水或不同浓度(25、50、100 μg/mL)的木寡糖预处理24 h后进行病原接种试验。
1.2.3 Pst DC3000接种 挑取活化的Pst DC3000单菌落接种于含有25 mg/L利福平的LB液体培养基中[21],28 ℃、200 r/min振荡培养至对数生长期,离心并收集菌体,用10 mmol/L MgCl2溶液重悬菌体至1×106cfu/mL,用无菌1 mL无针头注射器将菌液从叶片背面注入,收集Pst DC3000接种2 d后植物叶片拍照记录,试验重复3次。
1.2.4 病毒接种 挑取TMV侵染性克隆单菌落(TMV-GFP)在含有50 mg/L卡那霉素LB液体培养基中28 ℃、200 r/min培养至对数生长期,离心收集菌体,并用10 mmol/L MgCl2悬浮菌体至OD600=0.2,用无针头注射器将菌体从叶背面注入,收集TMV接种7 d后植物叶片拍照并进行定量统计。
1.2.5 核盘菌接种 经PDA平板活化的核盘菌菌株1980,用0.2 cm打孔器获得菌碟,并取5周大叶片置于培养皿中进行离体接种,将菌碟接种于叶片靠近主脉位置,22 ℃保湿培养36 h后拍照记录发病情况。试验重复3次。
1.2.6 病原细菌cfu值测定 取 Pst DC3000侵染的拟南芥叶片,用打孔器获取叶盘,加入1 mL无菌水研磨获得菌液,稀释后涂布于含有25 mg/L利福平的固体LB平板上,28 ℃培养2 d后计数单菌落。
1.2.7 Western blot分析 取TMV-GFP侵染的拟南芥叶片,液氮研磨至粉末,采用裂解buffer(50 mmol/L Tris-MES,10 mmol/L二硫苏糖醇)提取蛋白。将蛋白用12%聚丙烯酰胺凝胶电泳分离,然后转移至硝酸纤维素膜上(40 V转膜45 min),牛奶封闭后加入一抗(Anti GFP)和二抗(Goat Anti-Mouse)进行孵育,以拟南芥Actin作为内参;在硝酸纤维素膜上加入辣根过氧化物酶化学发光液显色,用Amersham Imager 600成像仪检测蛋白表达情况。
1.2.8 荧光定量PCR(Quantitative real time-PCR,qRT-PCR) 收集核盘菌侵染的拟南芥叶片,提取基因组DNA,采用Vazyme ChamQ SYBR qPCR Master Mix试剂盒,以拟南芥Atactin和核盘菌SsTublin内参基因在ABI 7500 RT-PCR仪上进行荧光定量扩增,定量检测发病植物组织中的病原量。反应程序:预变性95 ℃30 s;95 ℃ 10 s,60 ℃ 30 s,40 个循环;溶解曲线:95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。qRT-PCR 引物分别为:SsTublin :5′-GTCGTCGAGCCATATAACGC-3′和 5′-GGAAACGGAGACAGGTGGTA-3′;Atactin :5′-TCTTCTTCCGCTCTTTCTTTCC-3′和 5′-TCTTACAATTTCCCGCTCTGC-3′。采用 2-ΔΔCt法进行数据分析。
1.2.9 数据统计与分析 试验数据采用Excel和Graphpad prism 7.00软件进行差异显著性分析。
2 结果与分析
2.1 木寡糖诱发拟南芥对半活体病原细菌丁香假单胞菌番茄致病变种Pst DC3000抗性
丁香假单胞菌番茄致病变种-拟南芥是研究病原和植物互作的模式系统。木寡糖不同浓度预处理拟南芥,接种Pst DC3000症状不同(图1)。无菌水处理的拟南芥叶片,Pst DC3000接种 2 d后出现典型的黄化症状,几乎布满接种的叶面;25 μg/mL木寡糖处理的植株,Pst DC3000接种的叶片出现黄化症状,但局限于小部分面积;50 μg/mL木寡糖处理的植株,Pst DC3000侵染症状不明显,仅为少数肉眼可见的小黄点;100 μg/mL木寡糖处理的叶片,未见明显病害症状。对不同浓度木寡糖处理的Pst DC3000侵染叶片进行细菌分离培养,发现木寡糖处理的叶片细菌积累量显著下降;与无菌水处理相比,25 μg/mL木寡糖处理显著抑制了Pst DC3000积累。结果表明,木寡糖可诱发拟南芥对Pst DC3000抗性。
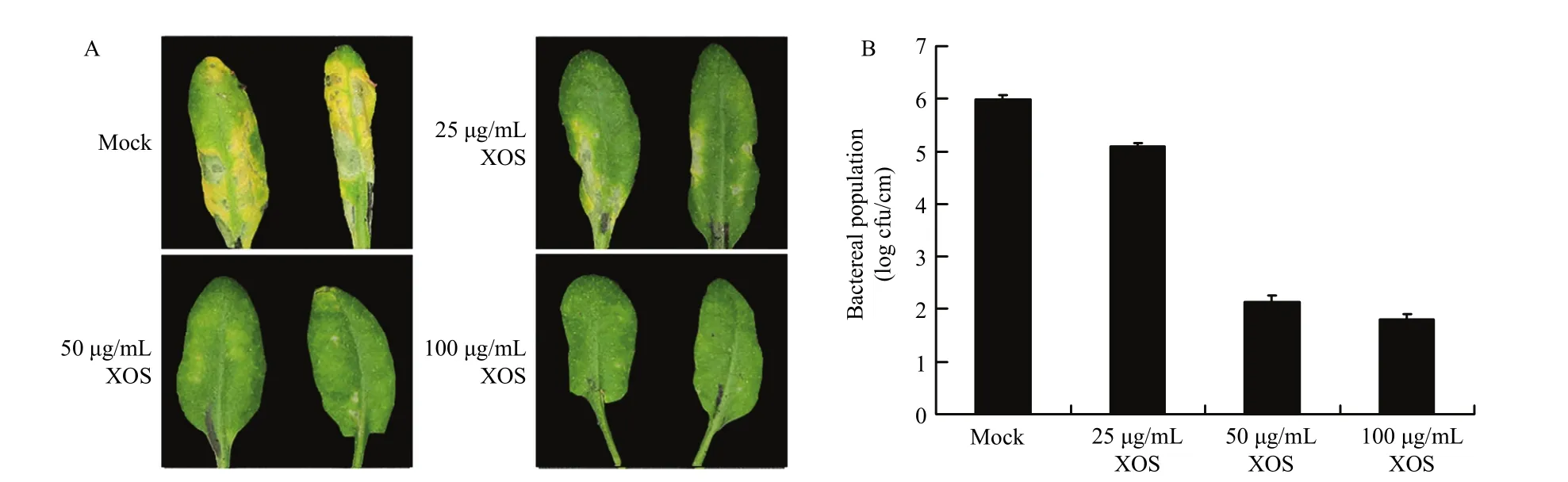
图1 木寡糖诱导拟南芥对Pst DC3000抗性Fig. 1 Enhanced plant resistance to Pst DC3000 induced by XOS
2.2 木寡糖诱发拟南芥对烟草花叶病毒抗性
TMV是一种活体营养型病原。木寡糖不同浓度诱导拟南芥,接种TMV后植物叶片发病症状有差异。TMV侵染如无菌水处理所示,叶片接种部位沿着叶缘出现黄化褪绿的症状,7 d后可扩展到整张叶片,系统叶也出现类似症状。25 μg/mL木寡糖处理的植株,接种叶和系统叶均出现黄化褪绿症状,但黄化程度略有降低;50 μg/mL木寡糖处理的植株,接种叶片黄化症状出现,但发病面积局限于接种点,系统叶肉眼可见的黄化症状不明显;100 μg/mL木寡糖处理的植株,接种叶和系统叶均未出现肉眼可见的症状(图2)。Western blotting显示无菌水处理后的拟南芥植株有明显的TMV积累,木寡糖处理的植物体内TMV含量较无菌水处理TMV含量下降;且随着木寡糖浓度升高,TMV积累逐渐降低。结果表明,木寡糖可诱发拟南芥对TMV抗性,且具有剂量依赖效应,100 μg/mL木寡糖可有效诱导拟南芥抗TMV侵染。

图2 木寡糖诱发拟南芥对TMV抗性Fig. 2 Enhanced plant resistance to TMV induced by XOS
2.3 木寡糖诱发拟南芥对死体病原真菌核盘菌抗性
木寡糖不同浓度对核盘菌侵染有显著影响。与无菌水处理比较,木寡糖处理的核盘菌引起的发病症状和病原量下降,无菌水预处理的拟南芥叶片在病原接种部位有水渍状病斑,25 μg/mL木寡糖处理的植株,水渍状病斑出现但较无菌水诱导后的病斑变小,当木寡糖增加到50和100 μg/mL时,核盘菌引起的病斑均小于25 μg/mL木寡糖处理(图3A)。qRT-PCR显示,浓度对木寡糖诱导拟南芥抗核盘菌有显著影响,当木寡糖为25 μg/mL时,核盘菌积累量比对照明显降低,下降49.74%,与50和100 μg/mL木寡糖诱导的病原菌积累量无显著差异,较对照降低73.96%(图3B)。结果说明,木寡糖诱导拟南芥抗核盘菌侵染最低有效浓度为50 μg/mL。

图3 木寡糖诱发拟南芥对核盘菌抗性Fig. 3 Enhanced plant resistance to S. sclerotiorum induced by XOS
3 讨论
在自然条件下,病原菌严重威胁植物生长和发育,导致作物减产。本研究发现半活体病原细菌 Pst DC3000、活体病原病毒TMV和死体病原真菌核盘菌是植物病原菌,均能侵染拟南芥引起明显的病害症状。激发子具有诱导抗病活性,在病害防治中有重要潜力,其主要成分有寡糖、糖蛋白和蛋白质等,其中细菌来源的harpin蛋白具有显著的诱导植物广谱抗性等多种生物学效应[22]。真菌来源的几丁寡糖能诱发植物抗细菌Pst DC3000和核盘菌病害[23];寡糖素类激发子壳寡糖CSOS能诱发拟南芥对Pst DC3000和TMV抗性[24],发现植物来源的木寡糖具有激发子活性,显著抑制Pst DC3000、TMV和核盘菌侵染,且具有剂量效应,说明木寡糖是一种新的寡糖素,具有对拟南芥广谱诱导抗病性的活性。
在动物中,木寡糖能抑制肠道细菌沙门氏杆菌、志贺氏杆菌、大肠杆菌、黄色葡萄球菌的生长,优化菌群结构,被认为是一种安全的寡糖素被用于保健品的研发和应用;而木寡糖是否调节植物病原的抗性还少有报道。本研究发现木寡糖诱导拟南芥抗细菌Pst DC3000侵染,还可抑制真菌核盘菌和病毒TMV在植株体内扩展,表明是木寡糖一种相对安全的寡糖素可用于植物诱导抗性的应用。此外,Chen等[19]发现木寡糖能增强小白菜(Chinese cabbage)抗氧化酶活性、降低脂过氧化、提高渗透因子、保持离子平衡以促进小白菜抗盐胁迫,显示木寡糖能诱发植物抗性响应病原和盐等生物和非生物逆境胁迫。激发子与植物相互作用的分子机制涉及蛋白质可逆磷酸化、活性氧迸发、蛋白激酶、离子流动和膜去极化等,推测木寡糖可能通过调节细胞内抗氧化活性、离子渗透等调节植物抗病性,而木寡糖诱发植物的生物和非生物逆境胁迫的相同点和特异性还有待进一步研究。
木寡糖是一种新的植物来源能诱发植物抗病性的寡糖素。研究发现甲壳类动物来源的寡糖素壳寡糖能诱发拟南芥抗Pst DC3000、病毒TMV和真菌链格孢菌Alternaria tenuissima侵染[24-26]。壳寡糖CSOS被拟南芥受体AtCERK1识别后经不同激酶传递,通过植物内源水杨酸(salicylia acid,SA)调节对TMV抗性;依赖SA和茉莉酸(jasmonic acid JA)信号途径调节对Pst DC3000抗性,我们发现植物来源的木寡糖能诱发拟南芥对Pst DC3000、TMV和核盘菌抗性,但通过怎么样的信号途径调节细菌、病毒和真菌的抗性还有待进一步的解析。新的木寡糖激发子诱导活性的发现,有利于其诱发植物免疫信号传导途径的解析,探究不同寡糖素激发子信号的异同点,丰富激发子诱导免疫反应分子机理,为木寡糖的应用提供依据。

