香蕉枯萎病拮抗菌贝莱斯芽胞杆菌的筛选鉴定及其生物学特性
杨 迪,杜婵娟,张 晋,潘连富,叶云峰,黄思良,付 岗*
(1. 南阳师范学院生命科学与农业工程学院,南阳 473061;2. 广西农业科学院植物保护研究所/广西作物病虫害生物学重点实验室,南宁 530007;3. 广西农业科学院园艺研究所,南宁 530007)
香蕉枯萎病是由尖孢镰刀菌古巴专化型Fusarium oxysporum f. sp. cubense(Foc)侵染引起的土传病害,是世界香蕉生产中面临的最为严重的毁灭性病害,也严重制约着我国香蕉产业的发展[1]。由于该病为土壤传播,常规化学药剂很难在土壤中起到持续控病的作用;非寄主作物轮作的方式虽然可以减轻香蕉枯萎病的发生,但需要较长的轮作周期才能达到较好的防病效果;选育抗病品种理论上是控制土传病害的最根本途径,但由于香蕉为无性繁殖作物,抗病品种选育进程缓慢[2-4]。随着生物防治技术在植物土传病害防治中的发展与应用,利用拮抗微生物防治香蕉枯萎病将是可供选择的一条有效防控途径。
分离获取具有生防潜能的微生物是开展香蕉枯萎病生物防治工作的重要基础,近年来已有多种对香蕉枯萎病有拮抗作用的不同种类的生防菌陆续被报道。伯克霍尔德氏菌Burkholderia stagnalis等在平皿上对Foc表现出一定的拮抗作用[5];荧光假单胞菌Pseudomonas fluorescens、菊欧文氏杆菌Erwinia chrysanthemi、枯草芽胞杆菌Bacillus subtilis、解淀粉芽胞杆菌Bacillus amyloliquefaciens、裂壳菌Schizothecium sp.等经盆栽试验证实对香蕉枯萎病具有较好的防效[6-11]。但受限于生防菌本身的特性和环境条件等因素,能在田间应用的生防菌还相当少,而关于贝莱斯芽胞杆菌防治香蕉枯萎病的报道更加鲜见。为了进一步发掘香蕉枯萎病的生防菌资源,本研究从香蕉根际土壤中分离筛选出2株对Foc具有明显拮抗活性的生防细菌。通过16S rRNA和gyrA基因序列及生理生化测试将其鉴定为贝莱斯芽胞杆菌,以期为香蕉枯萎病的生物防治提供新的菌种资源,也为后续抗病菌剂菌肥的开发利用奠定基础。
1 材料与方法
1.1 试验材料
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,水1 L,pH自然。NA培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,水1 L,pH 7,以不加琼脂的培养基为NA液体培养基。LB培养基:胰蛋白胨10 g,酵母提取物 5 g,氯化钠10 g,水1 L,pH 7;配制LB固体培养基时,每升LB培养基加入15 g琼脂粉[12]。
供试病原菌为Foc4号生理小种(菌株Foc1402),由广西农业科学院植物保护研究所香蕉病害研究团队分离保存。供试香蕉苗为长势一致的 5叶龄健康香蕉杯苗,品种为“威廉斯 B6”,购自南宁香洁农业科技有限公司。
1.2 香蕉枯萎病拮抗细菌的分离筛选
1.2.1 土样细菌的分离 采用五点取样法从广西各地蕉园采集距离地表3~10 cm处的香蕉根际土壤。称取2 g混匀的土壤样品加入装有18 mL无菌水的离心管中,用涡旋振荡器振荡混匀,制成土壤悬浮液,用10倍梯度稀释法依次稀释至10-7。分别用微量移液器从稀释倍数为10-4、10-5、10-6和10-7的土壤悬浮液中吸取100 µL涂布于NA平板上,28 ℃倒置培养24 h后,挑取形态不同的单菌落,纯化后4 ℃保存,备用[13]。
1.2.2 拮抗菌的初筛 将病原菌转接于PDA平板上,28 ℃培养3 d,用灭菌的打孔器沿菌落边缘打取直径为5 mm的菌碟。将菌碟转接于PDA平板中央,28 ℃培养24 h后,用接种环沾取待测细菌在菌碟两侧2 cm处平行划线,28 ℃培养4 d后观察结果,选取抑菌带宽度在3 mm以上的菌株进行下一步筛选。
1.2.3 拮抗菌的复筛 将拮抗菌转接于NA液体培养基中,28 ℃、120 r/min振荡培养72 h,制备拮抗菌发酵液,用无菌水调整菌液浓度至1×108cfu/mL,备用。将病原菌Foc1402接种于PDA试管斜面,28 ℃培养10 d,加入无菌水轻轻振荡,制备Foc1402的分生孢子悬浮液,用无菌水调整孢子浓度为1×106孢子/mL,备用。
将灭菌的牛津杯放置于已加入5 mL水琼脂的9 cm培养皿中央,将Foc1402的分生孢子悬浮液按1%体积比加入冷却至45 ℃的PDA培养基,迅速振荡混匀,倒入琼脂平板上,待凝固后取出牛津杯,28 ℃培养6 h后,加入经5000 r/min离心3 min的待测拮抗菌株发酵上清液,以无菌水为对照,每处理3次重复,28 ℃培养3 d后测量抑菌圈直径,计算抑菌率,选取抑菌率高的菌株进行后续试验[14]。抑菌率(%)=(处理抑菌圈直径-对照抑菌圈直径)/处理抑菌圈直径×100。
1.3 拮抗菌株的鉴定
1.3.1 形态学观察 将拮抗菌株在LB固体培养基上划线培养,28 ℃培养24 h,观察记录菌落形状、透明度及菌落颜色等菌落特征,并在光学显微镜下观察细菌形态。
1.3.2 生理生化特征 拮抗菌株的生理生化反应测试和结果判定参照《常见细菌系统鉴定手册》[15]和《伯杰氏细菌系统鉴定手册》[16]进行。
1.3.3 拮抗菌株的分子鉴定 将拮抗菌株接种于NA液体培养基,28 ℃、120 r/min振荡培养16 h,取1 mL细菌悬浮液15000 r/min离心1 min,收集菌体,使用Ezup柱式细菌基因组DNA抽提试剂盒(生工生物工程股份有限公司)对拮抗细菌的 DNA进行提取。使用通用引物 27F/1492R(5'-AGAGTTTGATCCT GGCTCAG-3'/ 5'-GGTTACCTTGTTACGACTT-3')和引物gyrA-F/gyrA-R(5'-CAGTCAGGAAATGCG TACGTCCTT-3'/ 5'-CAAGGTAATGCTCCAGGCATTGCT-3'),对拮抗菌的16S rRNA和DNA促旋酶A亚基蛋白(gyrA)基因序列进行PCR扩增,反应体系如下:2×TaqPCR Mix 12.5 µL,ddH2O 9.5 µL,DNA模板 1 µL,上下游引物各 1 µL;反应条件:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,30 个循环;72 ℃ 10 min[17]。PCR产物经测序后,将测序结果在NCBI网站进行BLAST比对,并使用MEGA 7.0软件,采用邻接法构建系统发育树。
1.4 拮抗菌株的生物学特性
1.4.1 温度对拮抗菌生长的影响 取1 mL拮抗菌株发酵液加入到100 mL NA液体培养基中,分别放置于10 ℃、13 ℃、16 ℃、19 ℃、22 ℃、25 ℃、28 ℃、31 ℃、34 ℃、37 ℃和40 ℃恒温摇床中, 120 r/min培养18 h,用紫外分光光度计于600 nm波长下测量吸光值,每处理3次重复[18]。
1.4.2 pH对拮抗菌生长的影响 将NA液体培养基的pH值分别调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0,取1 mL拮抗菌株发酵液分别加入到100 mL不同pH的培养基中,28 ℃、120 r/min培养18 h,用紫外分光光度计于600 nm波长下测量吸光值,每处理3次重复。
1.5 香蕉枯萎病盆栽防治效果测定
将5叶龄香蕉苗移栽至以蛭石为基质的直径20 cm、高22 cm的塑料盆内,每盆1株,室温培养,每隔3 d淋水1次。移栽定植10 d后,每株蕉苗淋入40 mL浓度为1×106个孢子/mL的Foc1402分生孢子悬浮液,同时淋入100 mL浓度为1×108cfu/mL的拮抗菌发酵液,7 d后再次淋入等量相同浓度的拮抗菌发酵液1次,以无菌水为对照。所有处理均设3次重复,每重复6株蕉苗。接种21 d后,调查各处理发病情况,并计算各处理的病情指数和防效。依据球茎纵剖面褐变面积占总面积的百分比来确定病级:0级为球茎无褐变;1级为球茎褐变面积≤25%;3级为25%<球茎褐变面积≤50%;5级为50%<球茎褐变面积≤75%;7级为球茎褐变面积>75%[19]。病情指数=∑(各级发病株数×该级代表值)/(总株数×最高级代表值)×100;防治效果(%)=(对照病情指数-处理病情指数)/对照病情指数×100。
1.6 数据统计与分析
数据利用软件DPS 9.1采用Duncan’s新复极差法分析各处理间的差异显著性。
2 结果与分析
2.1 拮抗菌的分离筛选
从广西各地蕉园采集香蕉根际土壤样品19份,分离得到细菌345株,用平板对峙法初筛得到具有拮抗作用菌株共48株,用牛津杯法测定其对Foc1402的拮抗活性,得到2株对Foc1402具有较强拮抗活性的菌株Blz67和Blz02,其中Blz67对Foc1402的抑制活性最好,抑菌圈平均直径为34.69 mm,抑菌率为74.06%,Blz02的抑菌圈平均直径为21.09 mm,抑菌率为57.33%(表1)。

表1 菌株Blz67与Blz02对香蕉枯萎病菌的拮抗活性Table 1 Antagonistic activities of strains Blz67 and Blz02 against Foc
2.2 拮抗菌的形态特征
菌株 Blz02和Blz67在LB固体培养基上28 ℃培养24 h后,形成乳白色菌落,边缘规则,近圆形,微凸,表面湿润(图1),显微镜下菌体形态呈杆状。
图1 拮抗菌Blz02(A)与Blz67(B)在LB培养基上28 ℃培养24 h的菌落形态Fig. 1 Colony morphology of the antagonistic strains Blz02 (A) and Blz67 (B) cultured at 28 ℃ for 24 h on LB medium
2.3 拮抗菌的生理生化特征
对菌株Blz67和Blz02进行生理生化测定,结果如表2所示,两株拮抗菌均为革兰氏阳性菌,硝酸盐还原反应和吲哚试验结果为阳性,硫化氢、甲基红(M.R.)和赖氨酸反应呈阴性,可水解淀粉,能利用葡萄糖、木糖、甘露糖、麦芽糖、果糖、蔗糖、乳糖和甘露醇。两株菌株的生理生化特征与RUIZ-GARCÍA等[20]描述的贝莱斯芽胞杆菌Bacillus velezensis特征基本一致。
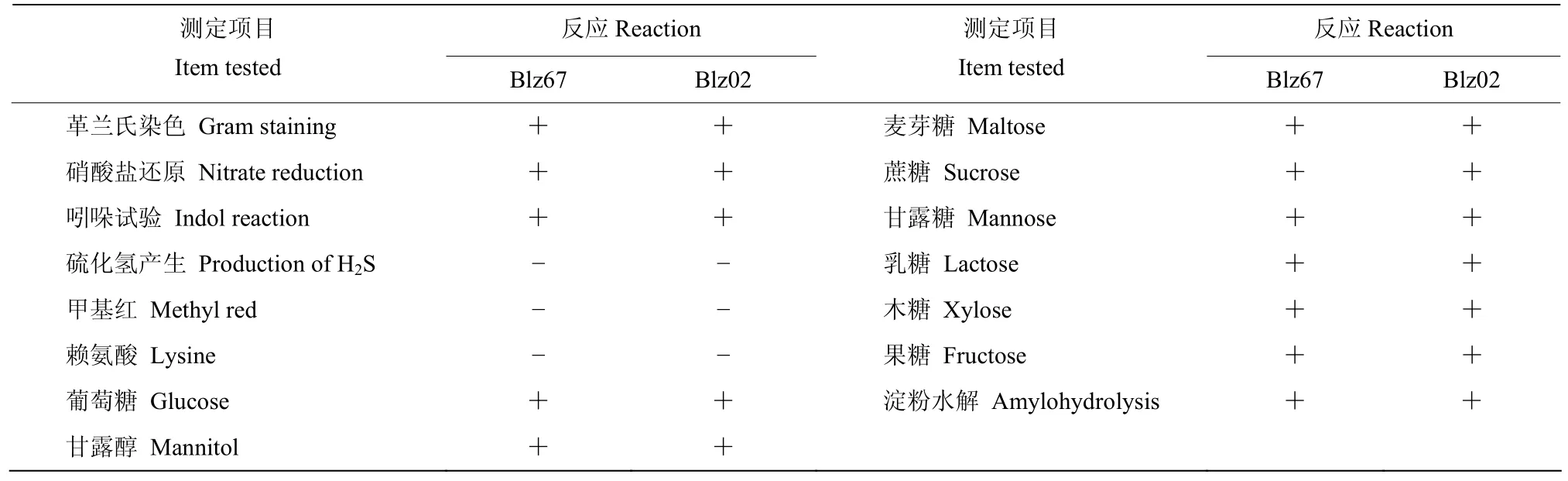
表2 拮抗菌Blz67与Blz02的生理生化特征Table 2 Physiological and biochemical characteristics of the antagonistic strains Blz67 and Blz02
2.4 拮抗菌的分子鉴定
测序获得菌株Blz67的16S rRNA基因片段序列长度为1400 bp(GenBank登录号:MN961682),gyrA基因片段序列长度为937 bp(GenBank登录号:MT380109),菌株Blz02 16S rRNA序列长度为1397 bp(GenBank登录号:MN961683),gyrA基因片段序列长度为937 bp(GenBank登录号:MT3395302)。BLAST结果显示,菌株Blz67和Blz02的16S rRNA序列和gyrA序列均与贝莱斯芽胞杆菌相似性最高,可达100%。系统发育树结果表明,在基于16S rRNA基因序列构建的系统发育树中,菌株Blz67和Blz02与贝莱斯芽胞杆菌(MT103089、MT081105、LC506620)以84%自举值聚于同一分支(图2A);在基于gyrA基因序列构建的系统发育树中,菌株 Blz67和 Blz02与贝莱斯芽胞杆菌(EU138650、CP028961、CP047157、CP046386、CP042271)以100%自举值聚于同一分支(图2B)。构建的2个系统发育树均表明这2株细菌与贝莱斯芽胞杆菌的亲缘关系最近,结合菌株菌落形态特征及生理生化特征,将拮抗菌Blz67和Blz02鉴定为贝莱斯芽胞杆菌。

图2 基于16S rRNA和gyrA基因序列构建的拮抗菌Blz02与Blz67的系统发育树Fig. 2 Phylogenetic trees based on 16S rRNA and gyrA gene sequences of the antagonistic strains Blz02 and Blz67
2.5 温度对拮抗菌生长的影响
温度对菌株Blz67和Blz02生长的影响极显著,培养18 h后,两株拮抗菌在低于19 ℃时,生长量较小,适宜生长温度为22 ℃~37 ℃,菌株的生长量随温度上升呈先增后降趋势;在温度为31 ℃时,两菌株的生长量最大,菌株Blz67和Blz02在600 nm处吸光值分别为0.7972和0.6038(图3)。
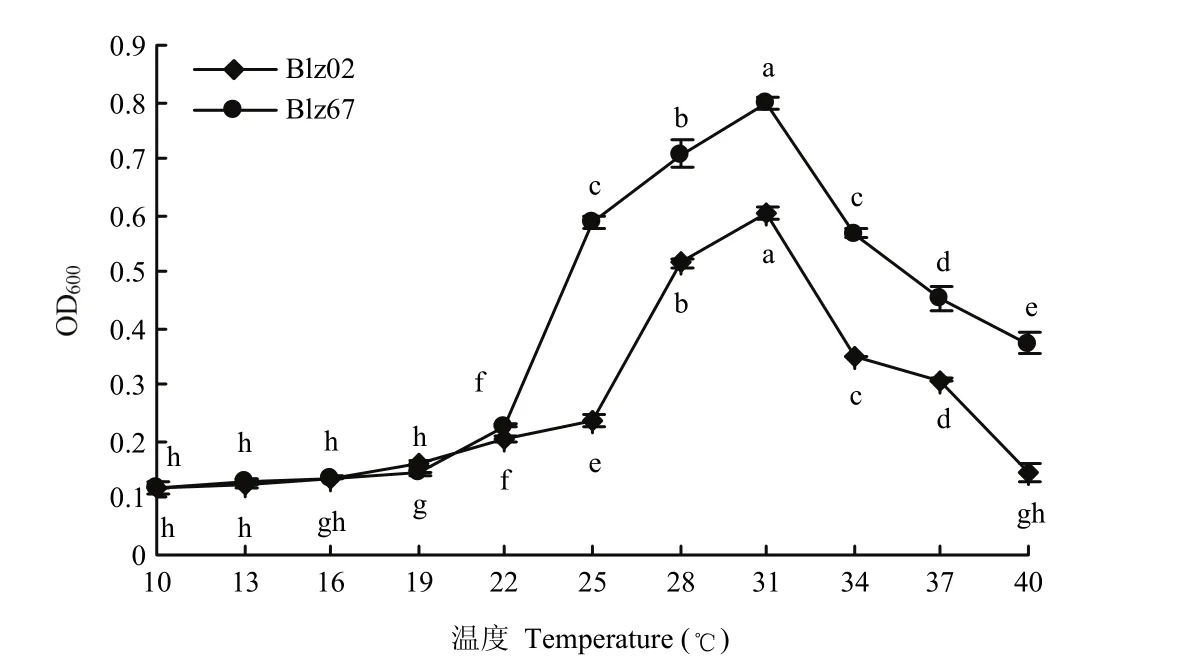
图3 温度对拮抗菌Blz02和Blz67生长的影响Fig. 3 Effect of temperature on the growth of the antagonistic strains Blz02 and Blz67
2.6 pH对拮抗菌生长的影响
两株拮抗菌菌株Blz67和Blz02最适生长pH均为5.5,在600 nm处吸光值分别为0.6132和0.6707;菌株Blz67在pH<4.5或pH>9.5时生长量较小,菌株Blz02在pH<5或pH>8.5时生长量较小(图4)。
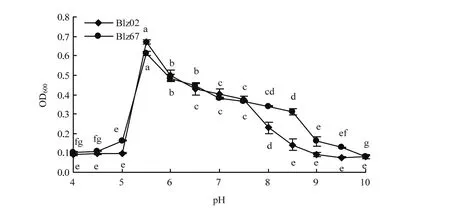
图4 pH对拮抗菌Blz02和Blz67生长的影响Fig. 4 Effect of pH on the growth of the antagonistic strains Blz02 and Blz67
2.7 对香蕉枯萎病的防治效果
蕉苗经过接种处理后21 d,可明显直观地观察到仅接种病原菌的对照组叶片发黄,而用菌株Blz67和Blz02发酵液处理的病原菌接种蕉苗叶片仍保持绿色。病情调查结果显示,对照组蕉苗病情指数为71.43,菌株Blz67处理的蕉苗病情指数为42.86,防治效果为40.00%;菌株Blz02处理的蕉苗病情指数为26.19,防治效果为63.33%(表3)。对照组蕉苗的病情指数显著高于试验组,表明两株拮抗细菌对香蕉枯萎病均有显著的抑制作用,其中以Blz02防治效果最好。

表3 拮抗菌Blz02和Blz67对香蕉枯萎病的盆栽试验防治效果Table 3 Control efficacies of the antagonistic strains Blz02 and Blz67 against banana Fusarium wilt under greenhouse conditions
3 讨论
贝莱斯芽胞杆菌B. velezensis在自然界中广泛存在,起初往往被认为是解淀粉芽胞杆菌B. amyloliquefaciens的同物异名种。随后的研究发现gyrA基因可用于区分B. amyloliquefaciens和B. velezensis[20-23]。因此,本研究选用16S rRNA基因和gyrA基因两段序列对两菌株进行分子鉴定,并结合形态学观察及生理生化测试,将两株拮抗菌鉴定为贝莱斯芽胞杆菌。
贝莱斯芽胞杆菌具有广谱的抗菌活性和促生作用,在农业生产中具有广泛的应用前景[24,25]。目前已有利用贝莱斯芽胞杆菌防治草莓炭疽病、马铃薯疥疮病、黄瓜枯萎病、小麦白粉病、小麦赤霉病、番茄青枯病、水稻稻瘟病等多种植物病害的报道[26-32]。然而关于利用贝莱斯芽胞杆菌防治香蕉枯萎病鲜有报道,本研究进一步扩展了贝莱斯芽胞杆菌抗病谱,也为香蕉枯萎病的生物防治提供了新的菌种资源。
生物学特性测试结果表明,两株贝莱斯芽胞杆菌适宜生长的温度范围较广(22 ℃~37 ℃),最适生长pH为5.5,为弱酸性。由于Foc也是在偏酸性土壤环境中更易生长和产孢[33],本研究获得的两株拮抗菌在未来田间防治香蕉枯萎病的应用中将可能具有较好的防病潜力。
本研究中两株拮抗菌平板测试的抑菌活性强弱与盆栽防效高低不一致,菌株Blz67在平板上对Foc1402的抑菌率较高(74.06%),但在盆栽试验中,却是菌株Blz02的防效较高(63.33%),菌株Blz67的防效为40%。该结果暗示两株拮抗菌可能存在不同的防病机制。在平板筛选试验中,发挥作用的主要是菌株产生拮抗物质的活性与能力,而在盆栽试验中,防病效果不仅与菌株产生的拮抗物质相关,还有可能与菌株的定殖能力、生态竞争力及诱导蕉苗抗性能力相关[4]。本研究筛选出两株生防菌株的具体防病作用机制还有待进一步探究。

