浑圆链霉菌QH−16鉴定及抑菌活性产物的结构研究
李志田,蔡淑琳,王 合,杨海青,赵 娟,刘德文,刘 娅,张殿朋*
(1. 石河子大学食品学院,石河子 832003;2. 北京市农林科学院植物保护环境保护研究所,北京 100097;3. 北京市林业保护站,北京 100029;4. 北京市平谷区果品办公室,北京101200)
关 键 字:桃细菌性穿孔病菌;放线菌;鉴定;活性物质
历年来,由桃细菌性穿孔病引发的病害对桃产业造成了巨大的经济损失,该病害也是世界上最严重的植物病害之一[1,2],其主要病原菌为Xanthomonas arboricola pv. pruni(Xap)。目前,化学防治是有效的防治方法,但存在严重的环境污染问题。因此,利用环境友好、生态和谐、有利食品安全的生物防治技术已成为植物病虫害防治的新趋势。生防微生物是生物农药的重要来源,其中放线菌是人们研究最早、并应用于生产中的一类拮抗微生物,它可以产生多种抗生素、植物激素、水解酶等抑菌活性物质,对于抑制病菌生长,提高植物抗病性具有重要作用,是颇具潜力的生物农药[3-5]。据统计,微生物产生具有生物活性的次级代谢物约22500余种,其中具有拮抗活性的约16500种,在这些拮抗物质当中有10100种(45%)产自于放线菌[6]。因此,对拮抗放线菌的筛选、鉴定及其活性物质的结构鉴定等研究已经受到国内外学者的青睐,国外学者Higginbotham和Murphy[7]分离了一株抑制金黄色葡萄球菌的放线菌,经DNA杂交显示该菌株与浑圆链霉菌有80%的同源性;王聪等[8]从广西分离一株海洋放线菌,并在次生代谢物中分离鉴定得到星型孢菌素;刘伟等[9]从一株海洋小链霉菌DY2741 代谢产物中也分离到对金黄色葡萄球菌和大肠杆菌均具有抑制作用的邻苯二甲酸二丁酯。本文通过平板对峙法从已有拮抗菌库中筛选对桃细菌性穿孔病菌具有拮抗效果的高效放线菌菌株,从形态学及分子生物学方面确定其分类学地位,并对该菌株发酵液抑菌活性产物进行研究,表征其结构,从而为新型生物农药的深入研究开发奠定基础。
1 材料与方法
1.1 供试菌菌株、培养基
1.1.1 供试菌株 菌株编号QH-16、XJ-39、XJ-35均由北京市农林科学院植物保护环境保护研究所生物防治研究室提供,从新疆和青海的土样中分离。指示菌株:番茄灰霉病菌Botrytis cinerea、西瓜枯萎病菌Fusarium oxysporum f. sp. niveum、草莓炭疽病菌Strawberry anthracnose、人参根腐病菌Fusarium oxysporum、禾谷镰刀病菌Fusarium graminearum、玉米大斑病菌Exserohilum turcicum、桃褐腐病菌Monilinia fructicola、西瓜嗜酸菌Acidovorax citrulli、枯草芽胞杆菌Bacillus subtilis、大肠杆菌Escherichia coli、桃细菌性穿孔病菌Xanthomonas arboricola pv. pruni,以上菌株由北京市农林科学院植物保护环境保护研究所生物防治研究室分离。
1.1.2 供试培养基 PDA培养基[10]用于拮抗试验,高氏一号培养基用于发酵培养[10]。生理生化特性测定所用参见《伯杰细菌鉴定手册》[11]和《链霉菌鉴定手册》[12], 放线菌形态观察采用高氏一号培养基,菌种鉴定则分别采用高氏一号培养基、察氏琼脂培养基、葡萄糖-天门冬素琼脂培养基、葡萄糖-酵母膏琼脂培养基、淀粉琼脂培养基、伊莫松琼脂培养基、马铃薯琼脂培养基、无机盐-淀粉琼脂培养基、蛋白胨-酵母膏琼脂培养基。
1.2 仪器与试剂
循环制备液相LH-9100(北京佳仪分析设备有限公司),液相色谱Agilent 1200(美国Agilent 科技有限公司),分析型色谱柱为Develosil ODS-HG-5(日本野村化学),硅胶柱层析所用硅胶为200~300 目(青岛海洋化工有限公司),薄层层析用分析板GF254(青岛海洋化工有限公司), 制备型薄层层析用分析板PLC Silica gel 60 F254(默克化工技术有限公司),旋转蒸发仪RE-5000(上海振捷实验设备有限公司),Varian核磁共振仪(美国瓦里安有限公司),液相色谱所用甲醇为色谱纯(国药集团化学试剂有限公司),其他试剂为化学纯或分析纯。
1.3 放线菌的筛选
以桃细菌性穿孔病菌(Xap)为靶标菌,采用平板对峙法对北京市农林科学院植物保护环境保护研究所生物防治研究室菌种库中85株放线菌菌株进行抑菌活性测定。拮抗放线菌接种于PDA培养基上,置于28 ℃培养箱培养2 d,将摇瓶培养24 h的桃细菌性穿孔病菌(Xap)菌液用无菌水稀释5倍后均匀涂布于接有拮抗放线菌的平板上,以不接拮抗菌株为对照,28 ℃培养3 d。每种供试拮抗放线菌设3次重复,观察抑菌效果。
1.4 菌株QH−16的鉴定
1.4.1 形态学特征 采用平皿插片法,将菌株QH-16接种于高氏一号培养基上,将灭菌的盖玻片斜插入培养基中,放置于28 ℃恒温培养箱中培养7~14 d,在光学显微镜下观察基内菌丝和气生菌丝的形态并拍照。
1.4.2 培养特征及生理特征分析 方法参考《伯杰细菌鉴定手册》[11]和《链霉菌鉴定手册》[12]。
1.4.3 菌株QH-16的16S rDNA 序列分析 用普通细菌基因组提取试剂盒提取菌株QH-16的基因组DNA后,利用 16S rDNA 的引物 243F:5′-GGATGAGCCCGCGGCCTA-3′,A3R:5′- CCAGCCCCACCTTCGAC-3′,对菌株QH-16的16S rDNA 序列进行PCR 扩增。PCR 运行程序:95 ℃预变性5 min;94 ℃变性1 min,60 ℃退火30 s,72 ℃延伸45 s,共35 个循环;72 ℃延伸10 min。所得产物由北京天一辉远生物公司进行序列测定。其余序列均下载于NCBI 网站,进化距离的计算采用邻接法,用MEGA v.5.0软件构建系统发育树。
1.5 菌株QH−16发酵液的制备
采用500 mL摇瓶发酵培养法。装液量200 mL,接种量6.5%,28 ℃、180 r/min摇床培养5 d后,将发酵培养基用快速定性滤纸抽滤,经无菌微孔滤膜(0.22 μm)滤去菌体的上清液,备用。
1.6 菌株QH−16抑菌谱的测定
1.6.1 真菌抑菌谱的测定 在PDA平板中心接种直径5 mm的1.1.1中供试真菌菌饼,平板边缘用直径5 mm打孔器打孔,取出琼脂塞,最后分别在琼脂孔中加入100 μL经过滤的菌株QH-16的菌液,设置未接种菌液为空白对照,28 ℃恒温培养3 d,观察抑菌带的情况,每个处理重复3 次。
1.6.2 细菌抑菌谱的测定 抗细菌活性检测采用琼脂平板打孔法。将100 μL指示细菌菌悬液均匀涂布于直径为9 cm的PDA培养基平板上,然后用直径5 mm打孔器在平板中心打孔,取出琼脂塞,最后分别在琼脂孔中加入100 μL经过滤的菌株QH-16的菌液。设置未接种菌液为空白对照,28 ℃恒温培养2 d,观察结果,每个试验重复3次。
1.7 抑菌物质的提取分离及结构鉴定
1.7.1 抑菌物质的提取 菌株QH-16发酵产物经预处理获得发酵液60 L,用等体积的乙酸乙酯萃取3次,有机相经35 ℃减压浓缩,得到粗提物5.719 g,置于-20 ℃冰箱保存。
1.7.2 硅胶柱层析分离 采用硅胶柱进行初步分离,硅胶柱的直径和长为2.5 cm×60 cm。装柱体积为200 mL,干法上样,用6种不同极性的洗脱液进行洗脱,分别是石油醚:乙酸乙酯=10:1(V/V)440 mL,石油醚:乙酸乙酯=5:1(V/V)360 mL,100%二氯甲烷1000 mL,二氯甲烷:甲醇=5:1(V/V)600 mL,二氯甲烷:甲醇=2:1(V/V)600 mL,二氯甲烷:甲醇=1:1(V/V)600 mL,按极性顺序梯度洗脱,合并得到6个组分。以琼脂平板打孔法来确定组分的抑菌活性,组分T1具有较强的抑菌活性。
1.7.3 制备型薄层层析分离纯化 硅胶柱层析获得抑菌活性组分T1,采用制备薄层层析进一步分离纯化,以石油醚:乙酸乙酯=10:1为展开剂,将分离得到的不同组分进行抗菌活性测定,获得的抑菌活性组分T1-1。
1.7.4 制备循环液相 用少量色谱甲醇充分溶解具有抑菌活性的样品,0.22 μm有机微孔滤膜过滤,循环制备液相色谱进行制备。流动相为70%色谱甲醇+30%水,检测波长为254 nm,进样量2.5 mL,以3.5 mL/min流速洗脱120 min。
1.7.5 抗菌活性组分的结构鉴定 对所获得化合物T1-1进行核磁共振(NMR),结合数据库对所得纯品进行结构推断。
1.8 单体物质的抑菌活性测定
取100 μL已经活化的桃细菌性穿孔病菌(Xap)均匀涂布于直径为9 cm的PDA培养基平板上,用直径5 mm打孔器在平板中心打孔,取出琼脂塞,在琼脂孔中加入60 μL用甲醇溶解的化合物,设置甲醇作为空白对照,放置于28 ℃恒温培养箱培养2 d,每个试验重复3次。
2 结果与分析
2.1 放线菌QH−16的抑菌活性及其鉴定
以桃细菌性穿孔病菌(Xap)作为指示菌,采用平板对峙培养法,对北京市农林科学院植物保护环境保护研究所生物防治研究室菌种库中85株放线菌菌株进行活性筛选,共筛选出3株有明显拮抗作用的菌株(图1),其中菌株QH-16菌抑菌直径最大,约为46 mm。
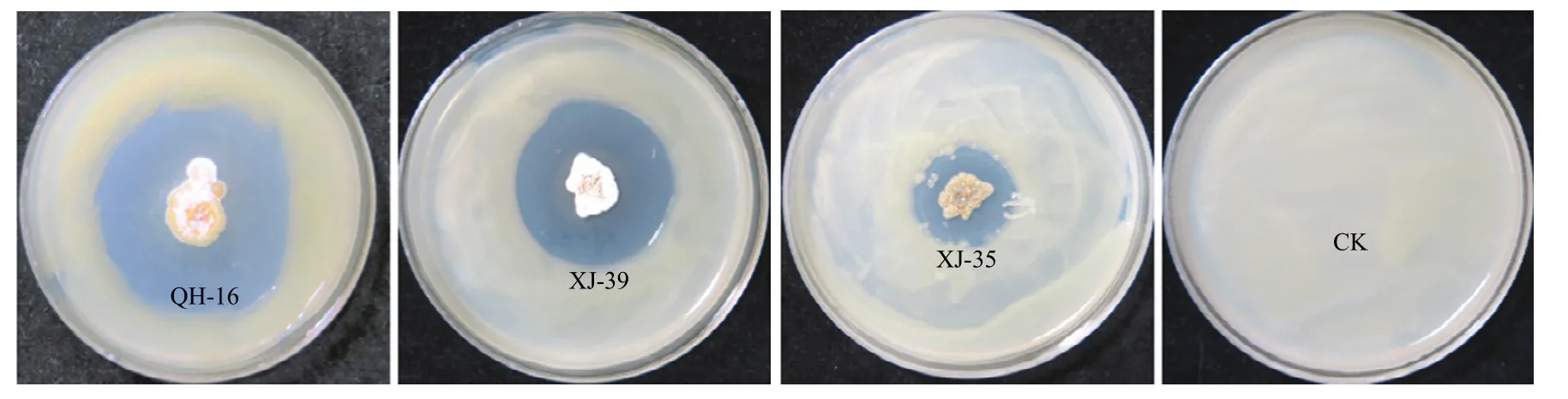
图1 部分放线菌菌株对病原菌Xap的抑菌活性Fig. 1 Inhibitory activities of antagonism against pathogen Xap
2.2 菌株QH−16的鉴定
显微观察结果表明,菌株 QH-16在高氏一号培养基上,菌落生长繁茂,气生菌丝淡粉色,基内菌丝浅褐色,菌丝呈短直状(图2)。将菌株QH-16接种在不同培养基培养7~14 d后,发现其在高氏一号、察氏、葡萄糖-天门冬素、淀粉、PDA、无机盐-淀粉、蛋白胨-酵母膏这7种培养基上,菌丝生长旺盛,基内菌丝为浅褐色、红褐色或棕黄色(偏褐色),气生菌丝显现为淡粉色、灰白色或暗灰色;在伊莫松和葡萄糖-酵母膏培养基上长势一般,无可溶性色素产生(表1)。菌株QH-16能够利用葡萄糖、乳糖、甘油、山梨醇、蔗糖、木糖和阿拉伯糖,无法利用鼠李糖、甘露糖、半乳糖;能够利用牛肉膏、蛋白胨和酵母浸,无法利用硫酸铵(表2)。根据同源性从高到低的选择原则,建立系统发育树(图3)。通过序列比对,放线菌QH-16与浑圆链霉菌S. globosus在同一系统进化分支上,且与浑圆链霉菌LZH-48相似度为99.74%。再结合培养特性观察、生理试验的验证,结果表明菌株QH-16的培养特性和生理特性与浑圆链霉菌基本符合,因此,确定菌株QH-16为浑圆链霉菌。

表1 放线菌菌株QH−16的生长状况和培养特征Table 1 The growth status and culture characteristics of actinomycetes QH−16
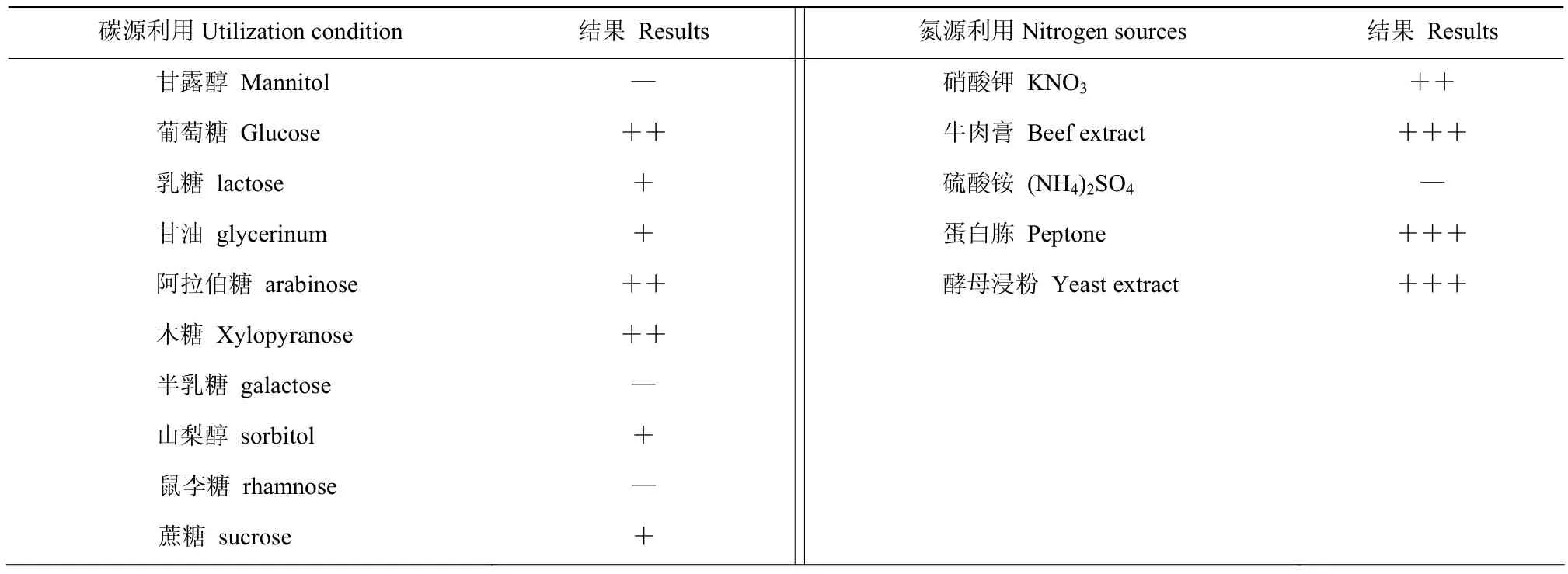
表2 放线菌菌株QH−16碳源和氮源的利用Table 2 Utilization of carbon source and nitrogen source of actinomycete strain QH−16
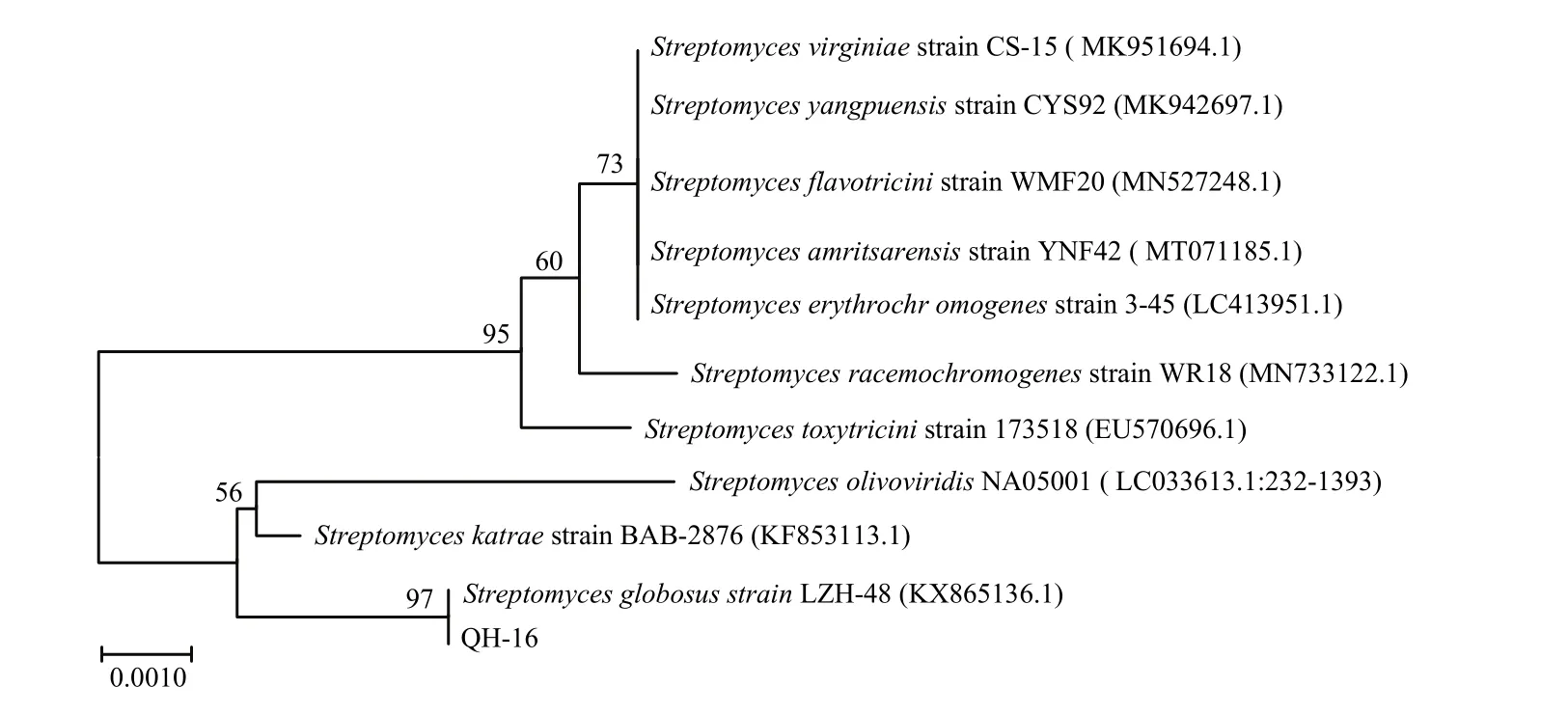
图3 放线菌QH−16的系统发育树Fig. 3 Phylogenetic tree of actinomycete QH−16
2.3 菌株QH−16抑菌谱的测定
菌株QH-16在PDA平板上对部分供试的病原真菌具有抑制作用,测定其发酵液对禾谷镰刀菌的抑菌带宽达14 mm,对番茄灰霉病菌的抑菌带宽达11 mm。采用琼脂平板打孔法测定其发酵液对除大肠杆菌外的革兰氏阳性菌和阴性菌都能产生一定的抑菌圈,对桃细菌性穿孔病菌的抑菌圈为31 mm,对西瓜嗜酸菌的抑菌圈为20 mm,对枯草芽胞杆菌的抑菌圈为22 mm(表3)。可见,菌株QH-16具有良好的广谱抗菌特性。

表3 菌株QH−16抑菌活性Table 3 Inhibiting activity of QH−16
2.4 粗提物的分离纯化结果
60 L发酵液经乙酸乙酯粗提,减压浓缩得粗提物5.719 g油状浸膏。分别用不同配比的洗脱液进行梯度洗脱,按照编号排列。将样品中的物质浓缩后,经薄层层析板检测,据TLC检测紫外灯结果,合并相同斑点1~2管、3~4管、5~32管、33~37管、38~41管、42~46管,得到6个组分,分别标记为T1、T2、T3、T4、T5、T6,通过抑菌活性检测,T1组分有抑菌活性,T2、T3、T4、T5、T6组分无抑菌活性(表4)。T1经旋转蒸发至少量液体后,收集到样品管中挥发至干,称重为132.30 mg。T1经TLC检测,出现2个清晰条带,且迁移率相差较大,采用制备薄层层析进一步纯化,得到组分T1-1和T1-2。抑菌活性检测T1-1具有抑菌活性,T1-2无抑菌活性。组分T1-1经循环制备液相色谱制备,获得纯度较高的化合物。
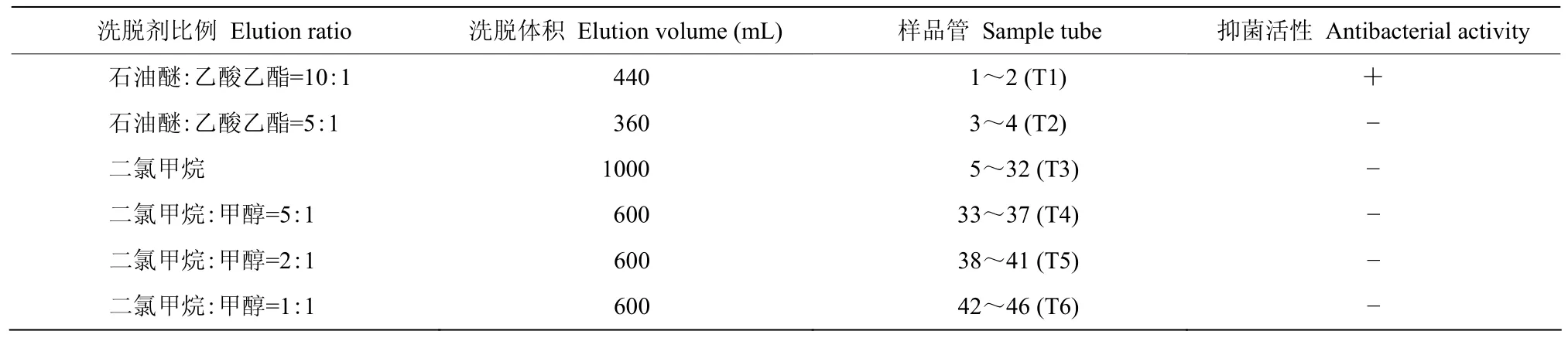
表4 粗提物的硅胶柱层析结果Table 4 The result of crude extracts after silica gel column chromatography
化合物T1-1为黄色油状物质,其核磁共振谱氢谱1H-NMR (500MHz,CD3OD)(图4),13C-NMR (125 MHz,CD3OD)(图5),1H-NMR(500 MHz, CD3OD)数据(表5)中共显示5个氢信号,δ: 7.72(2H,dd,J=5.7,3.3 Hz, H-2,5),7.63(2H,dd, J=5.7,3.3 Hz, H-3,4),4.30(4H, t, J=6.6 Hz, H-1’),1.73(4H, m, H-2’),1.47(4H, m, H-3’),0.99(6H, t,J=7.4 Hz, H-4’)。7个 C 信号,δ: 169.27(7-COO),133.55(C-1, 6),132.32(C-3, 4),129.84(C-2, 5),66.63(C-1’),31.70(C-2’),20.25(C-3’),14.05(C-4’)。
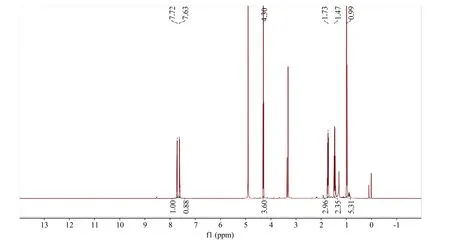
图4 单体化合物的1H NMR谱Fig. 4 1H NMR spectrum of purified compound

图5 单体化合物的13C−NMR谱Fig. 5 13C−NMR spectrum of purified compound
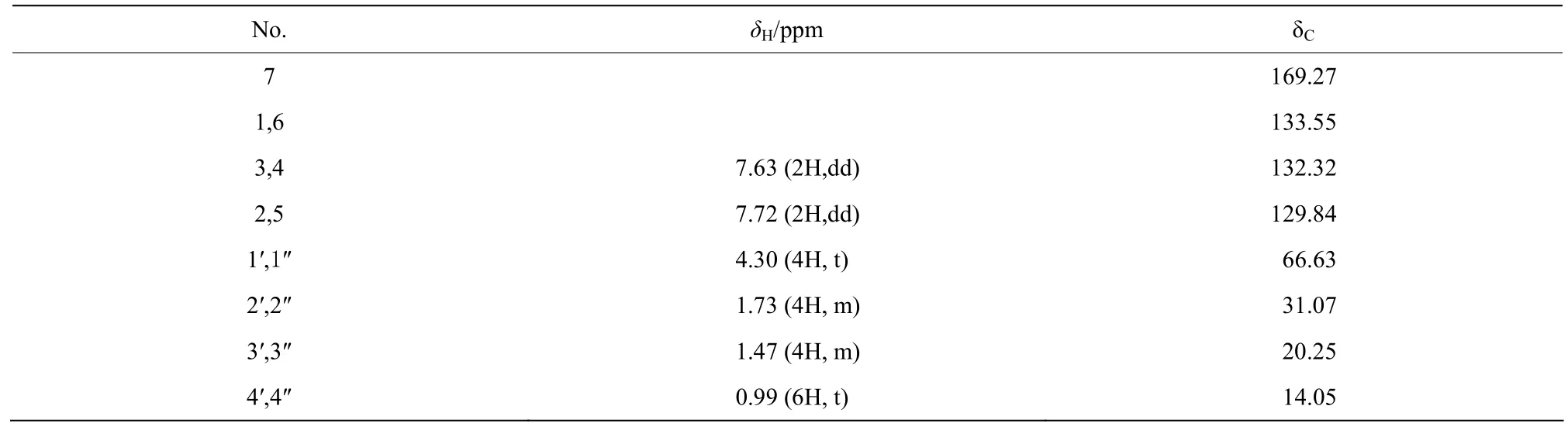
表5 纯化化合物的1H−NMR、13C−NMR数据(CD3OD, 500/125 MHz)Table 5 1H−NMR and 13C−NMR data of purified compound (CD3OD, 500/125 MHz)
经过文献对比,发现该化合物与已知化合物邻苯二甲酸二丁酯[13]的核磁数据一致,因此鉴定该化合物为邻苯二甲酸二丁酯(图6)。
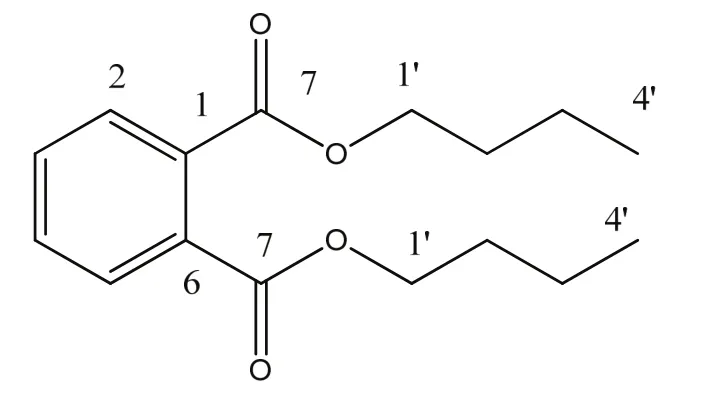
图6 邻苯二甲酸二丁酯的结构图Fig. 6 The chemical structure of DBP
2.5 分离产物的活性测定结果
通过用琼脂平板打孔法测定制备产物T1-1的活性,制备产物T1-1对桃细菌性穿孔病菌表现抑菌作用,其中B为溶剂甲醇(图7)。

图7 单体物质的抑菌活性Fig. 7 Antibacterial effect of the prepared products
3 讨论
本研究采用平板对峙法筛选出一株对桃细菌性穿孔病菌具有较强拮抗作用的放线菌 QH-16,通过形态特征观察、培养特性观察、生理试验和16S rDNA序列分析,确定菌株QH-16为浑圆链霉菌S. globosus。该菌株的代谢产物对革兰氏阳性菌、革兰氏阴性菌和真菌均表现出抑制作用,因此,可作为抗菌活性物质产生菌的优良菌株。国内外已有研究发现噬菌体[14]、荧光假单胞菌[15]、枯草芽胞杆菌[16]、无治病性的荧光假单胞菌[17]、秸秆木霉菌以及寡聚糖[18]对桃细菌性穿孔病菌具有抑制作用,但没有桃细菌性穿孔病拮抗放线菌的相关报道。
本研究经萃取、硅胶柱层析、制备型薄层层析板和循环制备液相色谱等步骤,从该菌株的发酵产物中提取、分离纯化得到化合物并初步鉴定产物的结构。最终通过NMR核对,确定活性产物为邻苯二甲酸二丁酯。邻苯二甲酸二丁酯在雷公藤[19]、海洋海藻类、山芝麻、香芸火绒草[20]、对结白蜡树[21]、多脂大戟[22]、三白草、红花酢浆花、植物姜等多种植物均有发现,表明邻苯二甲酸二丁酯为天然产物。同时,在细菌属、放线菌属,真菌属均发现有邻苯二甲酸二丁酯的产生。国内外有很多关于邻苯二甲酸二丁酯抑菌活性研究的报道。徐云玲等[20]在藏药香芸火绒草中分离纯化得到17种天然产物,其中就有邻苯二甲酸二丁酯,并通过实验证明邻苯二甲酸二丁酯对大肠杆菌、金黄色葡萄球菌和蜡状芽胞杆菌均具有抑制作用。张良菊[21]在对节白蜡树也中发现了邻苯二甲酸二丁酯,证明了其对多种真菌病原菌均具有抑制作用,其中对水稻纹枯病和小麦赤霉病具有极强的抑菌效果。马桂珍等[23]在海洋多粘类芽胞杆菌L1-9中分离鉴定了抗菌活性物质邻苯二甲酸二丁酯,证明其对5种病原真菌和细菌都具有抑制作用。Roy等[24]研究表明链霉菌S. albidoflavus 321.2产生的邻苯二甲酸二丁酯对革兰氏阳性菌、革兰氏阴性菌及酿酒酵母菌S. cerevisiae、黑曲霉Aspergill usniger、苍白弯孢菌Curvularia pallescens 均具有较强的抑制作用。顾晓洁等[25]研究发现在海洋厌氧反硝化细菌Pseudomonas stutzeri (No. DN7) 也有邻苯二甲酸二丁酯的产生,其对枯草芽胞杆菌Bacillus subtilis和铜绿假单胞菌Pseudomonas aeruginosa具有较强抑菌活性。Ramesh和Mohanraju[26]发现海洋生物发光细菌对17种病原菌具有抑菌活性,其活性成分中检测出邻苯二甲酸二丁酯。Ahsan等[27]从链霉菌KX852460代谢产物中分离得到邻苯二甲酸二丁酯,其对立枯丝核菌Rhizoctonia solani较强的抑制作用。但是,目前并未有在浑圆链霉菌代谢产物中分离纯化得到邻苯二甲酸二丁酯的相关报道。
本研究通过分离筛选得到抗菌活性的浑圆链霉菌QH-16,从该菌株的发酵产物中分离纯化得到活性产物邻苯二甲酸二丁酯,但是对其药理及毒理作用有待进一步研究。同时,浑圆链霉菌的代谢产物报道较少,今后继续开展菌株QH-16代谢产物其他抗菌成分的分离、结构鉴定以及田间试验。

