链霉菌ZZSP−7的鉴定及其对草莓炭疽病的防效
姚锦爱,黄 鹏,赖宝春,侯翔宇,余德亿*
(1. 福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福州350013;2. 漳州市农业科学研究所,漳州363005)
草莓是福建省重要的特色经济作物,生产上草莓炭疽病发生严重,为草莓的主要病害之一;该病的病原菌主要为胶孢炭疽菌Colletotrichum gloeosporioides,在草莓育苗期和移栽存活期发病最重,危害部位以短缩茎、匍匐茎和叶柄为主,造成大量烂苗、死苗,对福建草莓产业的健康发展造成负面影响[1-3]。目前,该病的防治还是以使用化学农药为主,但易导致残留和抗药性的产生[4]。生物防治是植物病害防治的发展方向之一,其中利用微生物拮抗菌因环境友好、安全性高等优点而成为研究热点[5,6]。现阶段、虽有一些贝莱斯芽胞杆菌Bacillus velezensis和解淀粉芽胞杆菌B. amyloliquefaciens的菌株被用于防治草莓炭疽病菌胶孢炭疽菌[7,8],但高效的生防资源物依旧不够,因此仍有必要分离筛选对草莓炭疽病菌胶孢炭疽菌优质、高效的生防菌株。本研究以福建省漳州市草莓种植基地的土壤为拮抗菌分离来源,室内分离测定菌株对草莓炭疽病菌胶孢炭疽菌的抑菌活性,从中筛选出抑菌率最高的菌株,在此基础上对所筛菌株进行分类鉴定及抑菌谱和盆栽防效测定,为该菌株的应用提供支持,也为利用微生物资源防控草莓炭疽病菌胶孢炭疽菌提供参考。
1 材料与方法
1.1 供试材料
供试土壤样本采集自漳州市草莓种植基地,使用Z字法采样,在草莓根系周围10~15 cm深处采集土样共20份。
供试的草莓炭疽病原菌Colletotrichum gloeosporioides、草莓黑斑病菌Alternaria alternata、草莓灰霉病菌Botrytis cinerea、草莓茎腐病菌Fusarium oxysporum、红心莲炭疽病菌Colletotrichum destructivum、辣椒疫霉病菌Phytophthora capsici和花生白绢病菌Sclerotium rolfsii等7株病原菌由福建省福州市农业科学院植物保护研究所提供。
供试草莓均为苗龄6个月的健康植株,采用经121 ℃、30 min高压蒸汽灭菌泥炭土为试验栽培基质,试验期间常规肥水管理。
供试药剂25 %吡唑醚菌酯悬浮剂(Pyraclostrobin,江苏托球农化股份有限公司)。
1.2 试验方法
1.2.1 拮抗菌株的分离 采用稀释涂布法分离土壤中的细菌[9],土样风干后称取1 g放入装有9 mL无菌水的试管中混匀,依次以10倍梯度稀释得到各浓度的土壤稀释液。分别取10-3、10-4和10-5的稀释液100 μL涂布于含0.1%青霉素的高氏一号(GSA)培养基(可溶性淀粉20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂20 g,蒸馏水1 L、pH 7.4~7.6)平板,后倒置于(28±1)℃、RH(80±5)%、光周期12L:12D的HGZ-150型光照培养箱(上海慧泰仪器制造有限公司)内培养2 d,挑取培养基上的单菌落进行转接纯化;将纯化后的细菌菌株接种于NA斜面培养基中继续培养2 d,后置于4 ℃冰箱保存备用。
1.2.2 拮抗菌株的筛选 以草莓炭疽病原菌胶孢炭疽菌为靶标菌,采用对峙法和抑菌圈法,对分离的细菌进行初筛和复筛[10]。初筛:用5 mm打孔器在纯化好的草莓炭疽病菌边缘打孔,将菌饼接入高氏一号平板培养基中心,用无菌接菌环在距菌饼25 mm的四个方向分别接入从土壤分离到的细菌,置于与1.2.1相同条件的培养箱中培养5 d,从中筛选出抑菌带宽大于5 mm的菌株进行复筛。复筛:将5 mm纯化好的草莓炭疽病菌菌饼接入高氏一号平板培养基中心,置于与1.2.1相同条件的培养箱中培养7 d,加入无菌水,轻轻刮下孢子,充分振荡混匀,过滤后稀释制成约含1×107孢子/mL悬浮液。取5 mL孢子悬浮液加入100 mL 45 ℃左右的高氏一号培养基中,摇匀,倒入培养皿中,制成含胶孢炭疽菌的平板。取初筛菌株,各自接种到装有50 mL高氏一号液体培养基的三角瓶中,置于(28±1)℃、220 r/min的ZWY-240型旋转式摇床振荡培养2 d;收集发酵种子液,于(12±1)℃、10000 r/min的KDC-140HR型高速冷冻离心机中离心20 min,后取上清液用0.22 μm滤膜过滤除菌得到无菌发酵液;在含胶孢炭疽菌的高氏一号平板上用直径5 mm的打孔器选择合适的间距打孔,并取50 μL滤液注入小孔内,静置30 min后,置于与1.2.1相同条件的培养箱中培养5 d,测量抑菌圈直径并记录试验结果。每处理重复3次,计算每株初筛菌株的抑菌率。
1.2.3 拮抗菌株的鉴定 形态学鉴定:先将菌株接种至高氏一号培养基上,37 ℃培养 24 h,初步观察菌落形态特征;再将菌株分别接种到酵母麦芽膏琼脂(ISP2)培养基(酵母膏4 g、麦芽汁10 g、葡萄糖4 g、琼脂 20 g、蒸馏水1 L、pH 7)、燕麦粉琼脂(ISP3)培养基(燕麦粉20 g、琼脂18 g、FeSO4·7H2O 0.1 g、MnCl2·4H2O 0.1 g、ZnSO4·7H2O 0.1 g、蒸馏水1000 mL)、无机盐淀粉琼脂(ISP4)培养基(可溶性淀粉10 g、K2HPO41 g、MgSO4·7H2O 1 g、NaCl 1 g、(NH4)2SO42 g、CaCO32 g、FeSO4·7H2O 0.001 g、MnCl2·7H2O 0.001 g、琼脂 20 g、蒸馏水1 L)、葡萄糖天冬素琼脂(ISP5)培养基(L-天门冬氨酸1 g、甘油10 g、K2HPO41 g、FeSO4·7H2O 0.1 g、MnCl2·4H2O 0.1 g、ZnSO4·7H2O 0.1 g、琼脂 20 g、蒸馏水 1 L、pH 7.2)和马铃薯块等培养基上,观察菌株在不同培养基上的孢子丝及可溶性色素颜色,对照《链霉菌鉴定手册》[11]从形态特征初步鉴定拮抗菌株的属。结合16S rDNA基因进行分子生物学鉴定[12],最终确定所筛拮搞菌株的种:用细菌基因组DNA提取试剂盒(OMEGA)提取拮抗细菌的基因组DNA;采用16S rDNA基因通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′/1492R:5′-TACGGCTACCTTGTTACGACTT-3′)[12],通过C1000 Thermal Cyclers 型PCR仪(Bio-Rad)对病原菌基因组DNA进行扩增,其PCR反应条件:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸3 min,35个循环;最后72 ℃延伸5 min。使用DYCP-31DN型琼脂糖水平电泳仪(北京六一生物科技有限公司,中国)回收PCR扩增产物,送样生工生物工程(上海)股份有限公司进行测序;先对所测序列进行BLAST同源性比对,后上传登录至NCBI的GenBank数据库中,并从GenBank数据库获得相关菌株的16S rDNA基因序列,在MEGA 5.0上用最大似然法构建系统发育进化树,并用自举抽样法(Bootstrapping)检验可靠性。
1.2.4 拮抗菌株对其他病原菌的抑制作用 以草莓黑斑病菌A. alternata、草莓灰霉病菌B. cinerea、草莓茎腐病菌F. oxysporum,红心莲炭疽病菌C. destructivum、辣椒疫病菌P. capsici和花生白绢病S. rolfsii等6个属的6种植物病原菌为靶标菌,按照1.2.2中初筛方法活化培养靶标菌和拮抗菌,用游标卡尺测定所鉴定菌株对6种植物病原菌的抑菌带宽,以抑菌带宽大于5 mm为抑菌指标。
1.2.5 拮抗菌株的盆栽防效 试验使用“甜查理”和“红颜”两个品种进行,试验设 3个处理:1)每株先喷施107孢子/mL草莓炭疽菌10 mL,2 d后喷施无菌水20 mL;2)每株先喷施107孢子/mL草莓炭疽病菌菌液10 mL,2 d后再喷施108孢子/mL拮抗菌ZZSP-7发酵液20 mL;3)每株先喷施107孢子/mL草莓炭疽病菌菌液10 mL,2 d后再喷施1500倍25%吡唑醚菌酯溶液20 mL。每处理30株,重复3次。接种后第14 d统计病情指数并计算防效。病情分级标准:0级,无病斑;1级,每叶病斑1~3个;2级,每叶病斑4~6个;3级,每叶病斑7~10个;4级,每叶病斑11~20个;5级,每叶病斑20个以上或病斑面积占全叶面积1/4以上[10]。病情指数=Σ(各级病株数×各级级数)/(调查总株数×5)×100;防治效果(%)=(对照区病情指数-处理区病情指数)/对照区病情指数×100。
1.3 数据统计与分析
利用DPS 7.05数据处理软件的DMRT检验法,分析比较拮抗菌株ZZSP-7对6种植物病原菌抑菌宽度及盆栽防效的差异显著性。
2 结果与分析
2.1 拮抗菌株的分离和筛选
通过稀释涂布法共分离到42株菌株,将分离得到的菌株与草莓炭疽病菌做生长对峙试验,初筛出抑菌带宽大于5 mm的菌株5株用于复筛。复筛结果显示,菌株ZZSP-7拮抗效果最好,其抑菌圈直径为17.6 mm,对草莓炭疽病菌的生长具有抑制作用(图 1A),最终挑选抑菌带宽最大、抑菌效果最好的菌株ZZSP-7用于分类鉴定及抑菌谱和防效测定。

图1 拮抗菌的抑菌圈(A)、菌落特征(B)及孢子形态(C)Fig. 1 Inhibition zone (A), colony characteristics (B) and spore morphology (C) of strain ZZSP−7
2.2 拮抗菌株的鉴定
菌株接种至高氏一号培养基上,28 ℃培养24 h后,菌落形态初期呈淡黄色、气丝白色;培养后期,气丝逐渐由白色变灰,并产生灰褐色孢子层(图2B),孢子呈圆形或椭圆形,链状聚集(图2C)。菌株在不同培养基上的孢子丝颜色与链霉菌属Streptomyces的S. costaricanus、S. murinus、S. griseofuscus和S.graminearus等4个近缘种相似,初步将该菌株归为链霉菌属。
对菌株ZZSP-7的16S rDNA序列进行扩增、经测序获得1388 bp序列片段;经Blast比对,发现其16S rDNA基因序列与链霉菌属的 S. murinus(NR_112445)、S. costaricanus(MT800028)、S. graminearus(GU223114)和S. griseofuscus(CP051006)相似度均高达99.93%,将16S rDNA的测序结果提交至NCBI的GenBank数据库中,获得登录号为MW356862,并从GenBank数据库中选取近源菌株的16S rDNA基因序列构建系统发育树(图2),结果表明菌株ZZSP-7与S. murinus、S. costaricanus、S. graminearus和S. griseofuscus聚为一支,亲缘关系均相近。结合拮抗菌 ZZSP-7的形态特征,最终将菌株 ZZSP-7鉴定为链霉菌Streptomycessp.。

图2 基于16S rDNA序列构建的系统发育树Fig. 2 Phylogenetic tree of strain ZZSP−7 based on the 16S rDNA sequences

表1 菌株在不同培养基上的孢子丝及可溶性色素与4个近缘种的比对Table 1 Colors of spore filaments and soluble pigment among strain ZZSP−7 and other four related species on different medias
2.3 拮抗菌株对其他病原菌的抑制作用
抑菌谱测定结果表明,菌株ZZSP-7对6种常见植物病原菌均具有不同程度的抑制作用,其中对葡萄孢核盘菌属的草莓灰霉病菌抑制作用最强,抑菌带宽达18.3 mm,对其他5个属的植物病原菌也有良好的抑制作用,抑菌带宽9.3~17.1 mm(表2)。由此可见,拮抗放线菌ZZSP-7对多种病原菌具有良好的抑菌效果。
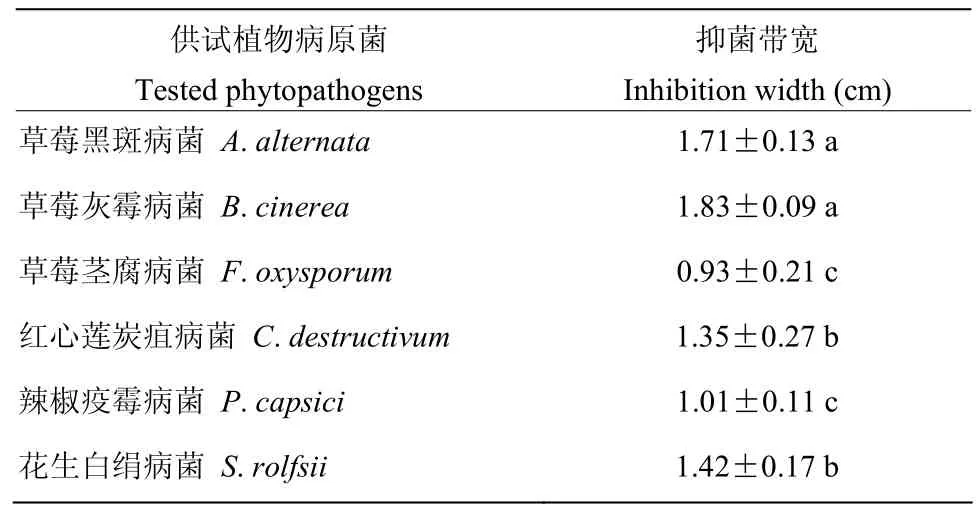
表2 菌株ZZSP−7对6种供试植物病原菌的抑菌带宽Table 2 Inhibition width of strain ZZSP−7 against 6 phytopathogens
2.4 拮抗菌株的盆栽防效
盆栽试验结果表明,接种2 d后,喷施无菌水的“甜查理”和“红颜”品种均出现了叶片焦枯、倒伏,植株死亡等病状;接种14 d后,“甜查理”品种的病情指数达31.33、“红颜”则为54.44;而经过拮抗菌ZZSP-7发酵液和1500倍25%吡唑醚菌酯处理的植株,“甜查理”品种病情指数分别为6.67和5.78;“红颜”品种病情指数分别为9.33和8.67。从防治效果可以看出,菌株ZZSP-7发酵液在“甜查理”和“红颜”上防治效果达78.64%和82.81%;该结果与1500倍25%吡唑醚菌酯防治效果81.34%和84.09%差异不显著(表3)。说明该拮抗菌对草莓炭疽菌的发生具有抑制作用。

表3 菌株ZZSP−7对草莓炭疽病的盆栽防效Table 3 Control efficacy of strain ZZSP−7 on strawberry anthracnose
3 讨论
生物防治是一种安全、有效、持久的控害方法,其中利用拮抗菌研制的生物农药在防治草莓炭疽菌上已有一定应用先例[13-16]。菌株筛选和鉴定是拮抗菌开发和应用的基础;本研究从草莓种植基地土壤中分离筛选出一株对草莓炭疽病菌胶孢炭疽菌具有显著拮抗效果的链霉菌ZZSP-7,其抑菌圈直径达17.6 mm。链霉菌作为放线菌中的重要菌种在自然界广泛分布,具有广谱抗菌活性,如姚锦爱等[10]发现酒红链霉菌S.vinaceusSVFJ-07对建兰炭疽病菌胶孢炭疽菌具有良好的拮抗作用,李娟等[14]发现淡紫灰链霉菌S.lavendulaeDTJ-24对草莓炭疽病菌胶孢炭疽菌具有良好的抑菌作用。本研究中的链霉菌ZZSP-7不仅对草莓炭疽病菌有显著的拮抗效果,对其他6种常见植物病原菌也有良好的抑制作用,抑菌谱广,研究结果为进一步研究其在田间应用中的效果提供了理论基础。
所筛菌株仅在室内中表现出拮抗作用还是不够的,只有在应用中依旧表现出良好防效的拮抗菌株,才具有生防应用潜力。本研究中菌株ZZSP-7对草莓“甜查理”和“红颜”品种上胶孢炭疽菌的盆栽防效达78.64%和82.81%,不仅与施用1500倍25%吡唑醚菌酯防治效果81.34%和84.09%无显著差异,还与陈哲等[13]利用芽胞杆菌复合菌、冯江鹏等[15]利用贝莱斯芽胞杆菌JK3、李娟等[16]利用枯草芽胞杆菌TJX-012防治草莓炭疽菌的防治效果相似。说明菌株ZZSP-7对草莓炭疽病的发生具有抑制作用,在实际应用中具有一定的生防潜力。拮抗菌株有效定殖是其发挥防治植物病害功效的重要条件,菌株ZZSP-7如欲投入生产使用,还需探讨其在草莓植株体内和栽培基质中的定殖能力及定殖后的生防能力,也需进一步分析其代谢产物中的抑菌活性物质,明确其抑菌机制,只有这样才能更加安全、有效、长久地利用拮抗菌株防控目标作物上的致病菌。

